用水解法制备水铁矿纳米团簇*
2016-11-12林立华卜胜利
林立华,周 群,卜胜利
(1. 上海理工大学 大学物理实验中心,上海 200093; 2. 上海理工大学 理学院,上海 200093)
用水解法制备水铁矿纳米团簇*
林立华1,周 群1,卜胜利2
(1. 上海理工大学 大学物理实验中心,上海 200093; 2. 上海理工大学 理学院,上海 200093)
提出了使用CuO增强Fe(NO3)3溶液水解制备水铁矿(Fe5O7(OH)·4H2O)纳米团簇的方法。将适量的CuO粉末加入到沸腾的Fe(NO3)3溶液中,将发生沉淀反应生成纳米尺寸的铁氧化物。用X射线衍射仪、透射电子显微镜、振动样品磁强计、X射线能谱仪、X射线光电子能谱分别对沉淀生成的产物的形态和大小、磁化强度、晶体结构和化学组成进行表征。产物是由大小约6.13 nm的微粒聚集形成的弱磁水铁矿纳米团簇。纳米团簇表面吸附有少量Fe(NO3)3,大小约为40 nm。本文提出了一种通过增强水解制备纳米尺寸氧化物的新方法。
硝酸铁;氧化铜;水解;水铁矿;纳米团簇
0 引 言
纳米材料具有与块体材料不同的光、磁、电、机械和化学特性而引起极大关注。纳米材料的研究主要集中于发展新型的合成方法[1]。对可控尺寸和形状的纳米晶和纳米微粒的研究期望能对其特殊现象提供基本解释,及创造出由于小尺寸(1~100 nm)而具有的新性质和功能的材料。由于分子引力及系统有减少总表面能或界面能的趋势,纳米晶往往会聚集形成纳米凝聚体,它可以发生在合成、干燥、处理或后处理等几个阶段[2]。近年来,尽管纳米微粒已引起相当的关注,但对合成复杂的三维纳米晶(如纳米花)鲜有报道[3-4]。
由于每个纳米晶粒的电/磁偶极场及晶粒有减少总表面能或界面能的趋势,纳米晶易于团聚形成纳米晶的二级结构——纳米团簇[1]。纳米团簇和纳米晶由于受到不同的相互作用导致其表现出不同的性质[5-8]。氧化铁团簇因其有趣的电,磁,催化性能及在各领域的潜在应用已引起极大的关注。例如,由较小氧化铁纳米晶组成的磁性氧化铁纳米团簇具有可调的光学响应[8]。大小约为10 nm的单晶磁铁矿微粒在室温下表现出铁磁性,而同样大小范围内由单晶磁铁矿组成的磁铁矿纳米团簇却表现出超顺磁性[9]。液相合成无机纳米晶/纳米微粒的常用方法有共沉淀法、溶胶-凝胶法、微乳液法、水热和溶剂热等方法[3]。水解法由于反应极弱,通常很少用于纳米材料的制备。然而,通过使用水解法的一些试验,已经制备出羟基氧化铁。例如,铁盐的溶解将产生相应的稀酸溶液,加入NaOH可以促进部分水解,形成FeOOH聚合物[10-11]。在硝酸铁溶液中加入氨水,合成了低晶水铁矿[12]。另外,使用改进的增强水解的方法合成了铁氧化物纳米微粒[13]。
水铁矿通常可通过在Fe(Ⅲ)盐溶液中加入碱来制的。然而,这种合成水铁矿的方法对影响沉淀过程中的各项参数非常敏感,包括浓度、Fe(Ⅲ)盐的类型、pH和温度等,以致于在制备过程中可能生成不同结晶度的水铁矿[12]。本文提出了用CuO增强Fe(NO3)3的水解,一步合成水铁矿(Fe5O7(OH)·4H2O)纳米团簇的方法,并对产物的形态,大小,磁性,晶体结构和化学组成进行了表征。因此,本文提出了水铁矿纳米团簇的形成机理及一种新的制备氧化物纳米晶/纳米团簇的方法。
1 实 验
室温下,先将Fe(NO3)3水溶液(0.25 mol/L,400 mL)加热至沸腾。再将0.10 mol粒径大小约为1 μm的CuO粉末加入到沸腾的Fe(NO3)3水溶液中,然后加热至沸腾并保持30 min,加热过程中不断搅拌。加热停止后,水铁矿纳米晶逐渐从溶液中析出。在沉淀过程中纳米晶聚集形成纳米团簇。通过离心将沉淀物从溶液中分离,用丙酮清洗沉淀物,自然干燥后得到最终产物。为了进一步研究产物的结构,将其分散在硝酸溶液(0.2 mol/L HNO3)中合成胶体。
用X射线衍射仪(XRD, XD-2)对产物的晶体结构进行了分析,透射电子显微镜(TEM,JEM-2100F)观察了产物及其胶体的形态并分析了微粒粒径的大小。X射线能谱仪(EDX, INCA SEM-350)、X射线光电子能谱仪(XPS, Thermo ESCA250)和振动样品磁强计(VSM, HH-15)分别对产物的化学组成和磁性进行了分析。
2 结果与讨论
2.1 形貌观察
图1(a)为脱水干燥后产物的TEM照片,(b)为产物分散在硝酸溶液中形成的胶体微粒TEM照片。

图1 TEM照片(a)产物(b)胶体微粒
图1表明,产物是由较小的纳米晶组成的准球形纳米团簇。对纳米团簇(a)及胶体微粒(b)的粒径进行了统计分析[14],其分布情况如图2所示。
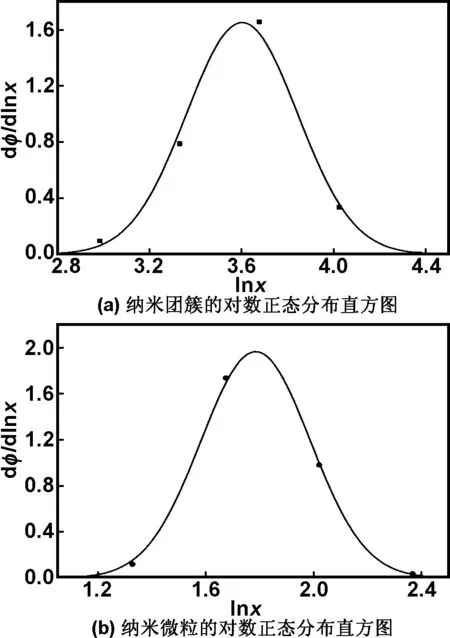
图2 (a)和(b)分别为纳米团簇和纳米微粒的对数正态分布直方图
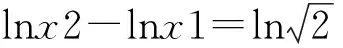
(1)
通过式(1)可以计算出纳米团簇的算术平均粒径d=37.78 nm,纳米微粒的算术平均粒径d=6.13 nm。此外,还可以推算出团簇中纳米微粒的平均个数N=(37.78/6.13)3=234。
2.2 磁化性质
在室温下测量了纳米团簇的磁化曲线,如图3所示。从曲线的变化趋势可看出纳米团簇呈弱磁性,这正好与水铁矿反铁磁[11]的特征一致。
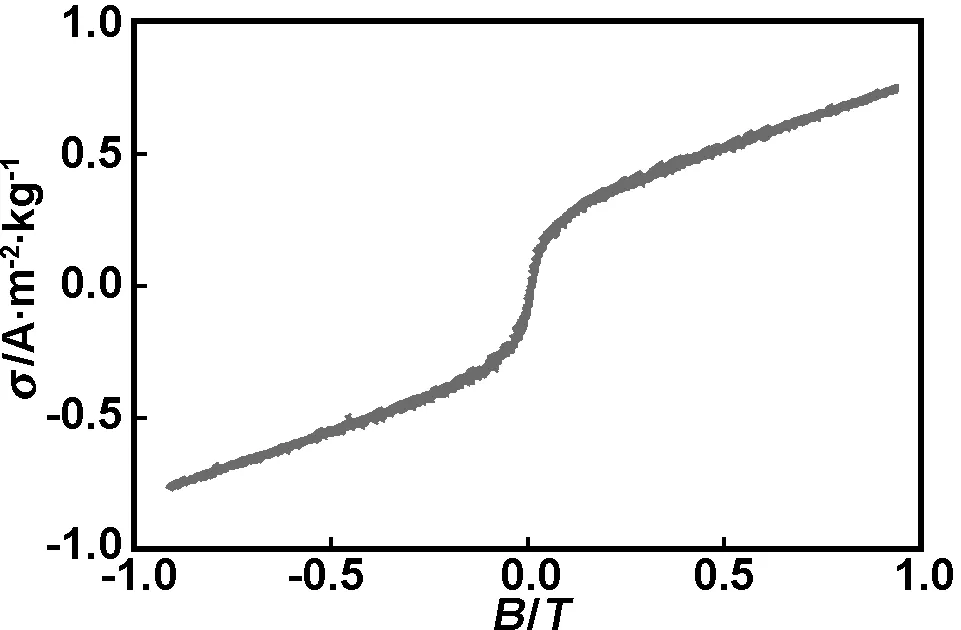
图3 纳米团簇的磁化曲线
2.3 晶体结构分析
图4为XRD图谱(a)产物(b)水铁矿,插图为电子衍射图。
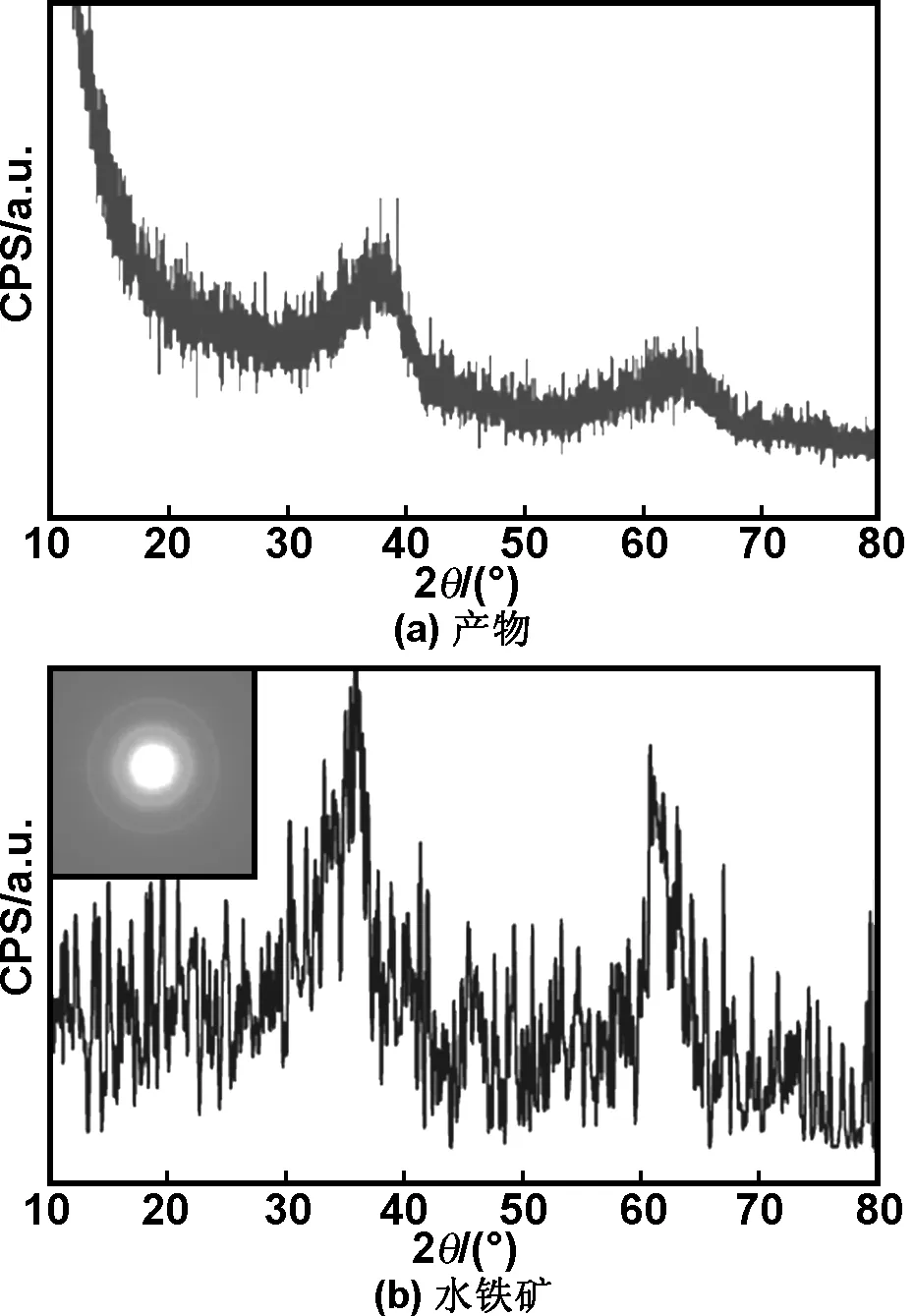
图4 XRD图谱(a)产物(b)水铁矿,插图为电子衍射图
从图4可看出,纳米团簇的XRD衍射图谱显现出非晶衍射图样,与低晶水铁矿的2-XRD衍射线[12]相吻合,但其相应的电子衍射显示出清晰的衍射环。根据衍射环可计算出其对应的晶面间距d。通过分析产物的电子衍射环所对应的晶面间距d值,确定样品d值与六角晶系Fe5O7(OH)·4H2O(PDF#29-0712)水铁矿的标准值相符,详细数据如表1所示。
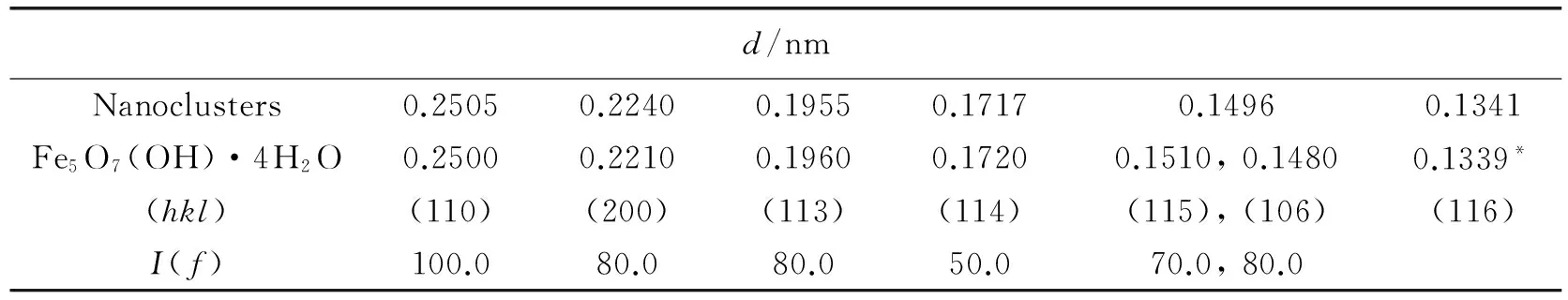
表1 电子衍射中晶面间距d值的数据分析
注:* 为计算值。
2.4 成分分析
纳米团簇的EDX能谱如图5所示,测量结果表明,该纳米团簇中含有Fe,N,O,不含Cu。XPS测量结果也证实了纳米团簇中存在Fe,N和O,而没有Cu,如图6所示,插图为对应Cu的结合能谱范围。

图5 纳米团簇的EDX能谱图

图6 纳米团簇的XPS图谱,插图为Cu的结合能范围
EDX和XPS的测量结果表明,样品中除了水铁矿(Fe5O7(OH)·4H2O)外还有硝酸化合物,但没有出现含Cu物质。硝酸化合物可能是少量Fe(NO3)3吸附在水铁矿晶体的表面,这与g-Fe2O3/Ni2O3纳米微粒经Fe(NO3)3溶液处理后生成的产物类似[15]。将纳米团簇XPS能谱中的Fe2p3/2谱分成两峰(见图7),其中
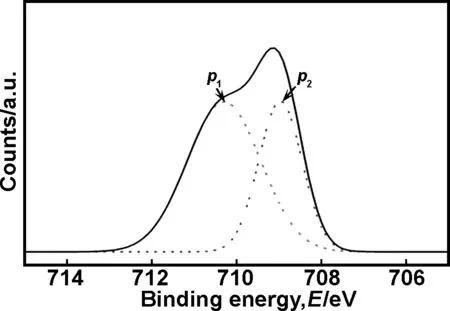
图7 纳米团簇Fe2p3/2的XPS结合能谱图
Fe5O7(OH)·4H2O中Fe2p3/2(p1)的结合能为710.23 eV,则另一峰(p2)的结合能值为(708.97 eV),而不带结晶水的Fe(NO3)3中Fe2p3/2的结合能为709.07 eV,正好与p2峰的结合能值相吻合。这表明Fe5O7(OH)·4H2O纳米团簇的表面吸附有少量的Fe(NO3)3。纳米团簇XPS结合能的详细数据如表2所示。

表2 样品中各元素的XPS结合能(eV)
3 讨 论
上述实验结果和分析表明,所制备的水铁矿纳米团簇是由CuO加入到沸腾的Fe(NO3)3溶液中合成的极细水铁矿纳米晶聚集形成的。显然,水铁矿的合成与CuO增强Fe(NO3)3的水解有直接关系,其关系式可表示如下。
Fe(NO3)3溶液的水解可表示为
(2)
事实上,由于Fe(NO3)3溶液的水解反应很弱而不能生成水铁矿纳米晶。从实验结果中可判定,虽氧化铜不能溶解在水溶液中,但却可以很好地溶解在沸腾的硝酸铁溶液中。因此,式(2)中的部分H+由于溶解反应而将被中和,表示如下
(3)
因此,这促进了Fe(NO3)3溶液的水解和水铁矿的合成。最后,合成Fe5O7(OH)·4H2O水铁矿的简化反应式可写成
(4)
从(4)式可以看出,反应生成物除了水铁矿Fe5O7(OH)·4H2O外还有Cu2+,这也正好印证了CuO加入到沸腾Fe(NO3)3溶液中经离心后所得产物上清液为蓝色的原因。由于水铁矿纳米晶较小,在沉淀过程中将会聚集形成纳米团簇。此外,Fe(NO3)3溶液的水解反应不完全,部分的Fe(NO3)3将吸附在Fe5O7(OH)·4H2O纳米晶/纳米团簇的表面。
4 结 论
虽CuO粉末不溶于蒸馏水,但会溶解在一定浓度沸腾的Fe(NO3)3溶液中,且会增强Fe(NO3)3溶液的水解。因此,在沉淀过程中Fe3+将会发生沉淀形成Fe5O7(OH)·4H2O纳米晶,纳米晶较小会聚集形成大小约为40 nm的纳米图簇。水铁矿纳米团簇容易分散在酸性水溶液中形成胶体,也可用做制备a-Fe2O3纳米微粒的前躯体[12,16]。在Fe(NO3)3溶液水解过程中,CuO起到了促进水解的作用。使用CuO粉末不仅比NaOH[10-11]或NH3水溶液[12]能更有效地增强水解反应,且在合成水铁矿纳米团簇的过程中,产物对溶液的各项参数反应不敏感,只跟CuO粉末的量有关。由此可见,由氧化物增强金属盐类的水解反应是制备氧化物纳米晶或纳米团簇的一种新途径,这将在以后做进一步的研究。
[1] Willard M A, Kurihara L K, Carpenter E E, et al. Chemically prepared magnetic nanoparticles[J]. International Materials Reviews, 2004, 49(3-4): 125-170.
[2] Wang X, Zhuang J, Peng Q, et al. A general strategy for nanocrystal synthesis[J]. Nature, 2005, 437(7055):121-124.
[3] Cushing B L, Kolesnichenko V L, O’Connor C J. Recent advances in the liquid-phase syntheses of inorganic nanoparticles[J]. Chemical Reviews, 2004, 104(9): 3893-3946.
[4] Narayanaswamy A, Xu H, Pradhan N, et al. Crystalline nanoflowers with different chemical compositions and physical properties grown by limited ligand protection[J]. Angewandte Chemie, 2006, 118(32): 5487-5490.
[6] Liu X, Qiu G, Yan A, et al. Hydrothermal synthesis and characterization of α-FeOOH and α-Fe2O3uniform nanocrystallines[J]. Journal of Alloys and Compounds, 2007, 433(1): 216-220.
[7] Iliopoulos K, Athanasiou D, Meristoudi A, et al. Nonlinear optical properties of Au nanoclusters encapsulated into hybrid block copolymer micelles[J]. Physica Status Solidi(a), 2008, 205(11): 2635-2638.
[8] Kostopoulou A, Tsiaoussis I, Lappas A. Magnetic iron oxide nanoclusters with tunable optical response[J]. Photonics and Nanostructures-Fundamentals and Applications, 2011, 9(2): 201-206.
[9] Ge J, Hu Y, Biasini M, et al. Superparamagnetic magnetite colloidal nanocrystal clusters[J]. Angewandte Chemie International Edition, 2007, 46(23): 4342-4345.
[10] Bottero J Y, Manceau A, Villieras F, et al. Structure and mechanisms of formation of iron oxide hydroxide (chloride) polymers[J]. Langmuir, 1994, 10(1): 316-319.
[11] Rose J, Manceau A, Masion A, et al. Structure and mechanisms of formation of FeOOH(NO3) oligomers in the early stages of hydrolysis[J]. Langmuir, 1997, 13(12): 3240-3246.
[13] Brullot W, Reddy N K, Wouters J, et al. Versatile ferrofluids based on polyethylene glycol coated iron oxide nanoparticles[J]. Journal of Magnetism and Magnetic Materials, 2012, 324(11): 1919-1925.
[14] Granqvist C G, Buhrman R A. Ultrafine metal particles[J]. Journal of Applied Physics, 1976, 47(5): 2200-2219.
[15] Li J, Qiu X, Lin Y, et al. A study of modified Fe3O4nanoparticles for the synthesis of ionic ferrofluids[J]. Applied Surface Science, 2010, 256(23): 6977-6981.
[16] Schwertmann U, Friedl J, Stanjek H. From Fe(Ⅲ) ions to ferrihydrite and then to hematite[J]. Journal of Colloid and Interface Science, 1999, 209(1): 215-223.
Preparation of ferrihydrite nanoclusters using hydrolysis
LIN Lihua1, ZHOU Qun1, PU Shengli2
(1. Experiment Center of College Physics, University of Shanghai for Science and Technology,Shanghai 200093, China;2. College of Science, University of Shanghai for Science and Technology, Shanghai 200093, China)
A new method of preparing Ferrihydrite(Fe5O7(OH)·4H2O) nanoclusters using Fe(NO3)3solution hydrolysis enhanced by CuO. Ferrihydrite nanocrystals during precipitation will gather to form Ferrihydrite nanoclusters. The morphology and size, magnetization, crystal structure and chemical composition of the precipitated products were characterized by TEM, VSM, XRD, EDX and XPS. The results show that the product is weakly magnetic nanoclusters, the size of nanoclusters are about 40 nm gathered by about 6.13 nm Fe5O7-(OH)·4H2O nanocrystallites, and the surface of the nanoclusters are absorbed by Fe(NO3)3. A new method of preparing nano-sized iron oxide using hydrolysis enhanced by CuO is proposed.
ferric nitrate; copper oxide; hydrolysis; ferrihydrite; nanoclusters
1001-9731(2016)10-10180-04
上海高校青年教师培养资助计划资助项目(ZZSLG14029);上海市自然科学基金资助项目(BZR1427400)
2015-09-16
2016-04-07 通讯作者:卜胜利,E-mail: shenglipu@gmail.com
林立华 (1987-),男,福建龙岩人,硕士,师承李建教授和卜胜利教授,从事磁性纳米微粒的制备及物理性质研究。
TB332;O469
A
10.3969/j.issn.1001-9731.2016.10.033
