丁苯酞氯化钠注射液对大鼠延髓缺血后神经元凋亡、NGF、BDNF表达的影响
2016-11-12张玉坤
朱 江,张玉坤,张 杰,郭 森,丁 萌
丁苯酞氯化钠注射液对大鼠延髓缺血后神经元凋亡、NGF、BDNF表达的影响
朱江1,张玉坤2,张杰2,郭森3,丁萌4
目的探索丁苯酞氯化钠注射液对大鼠延髓缺血后脑神经元凋亡、神经生长因子(NGF)、脑源性神经生长因子(BDNF)表达的影响。方法将Wistar大鼠分为假手术组、丁苯酞氯化钠注射液治疗组(以下简称治疗组)、缺血对照组。采用电凝双侧椎动脉和结扎右侧颈总动脉的方法制造大鼠延髓缺血模型。分别给予治疗组和缺血对照组丁苯酞氯化钠注射液及等计量生理盐水腹腔注射。大鼠于相应时段灌注取材,每组标本分别采用尼氏染色、Tunel染色,免疫组织化学方法显示脑组织中的神经元、凋亡神经元数量、BDNF和NGF。光镜下观察脑组织中神经元数量、神经元凋亡的数量。同时观察NGF和BDNF的变化,利用灰度值进行分析。结果神经元凋亡数量及NGF、BDNF灰度值治疗组均低于缺血对照组。结论NGF、BDNF水平与神经元数量密切相关,丁苯酞可上调大鼠缺血脑组织中NGF、BDNF的表达,减轻脑组织损伤。
丁苯酞注射液;延髓缺血;神经元;凋亡;神经生长因子;脑源性神经生长因子;大鼠
缺血性脑血管病病理机制复杂,是由多个病理环节导致脑组织缺血、缺氧性坏死,出现相应神经功能损伤[1]。脑组织血液供应障碍势必会对神经元及神经营养因子造成相应影响。
近年来对缺血性脑血管病损伤机制的认识已进入分子水平[2],其中神经生长因子(nerve growth factor,NGF)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)可以明显促进缺血后神经元的存活和生长发育,改善神经元的病理状态,促进受损神经元再生及分化成熟,在中枢神经系统损伤修复过程中具有重要的作用[3]。
丁苯酞氯化钠注射液(butylphthalide)具有清除自由基和神经保护作用[4],改善脑缺血后的能量代谢,减轻神经功能损伤的程度[5]。
本研究从丁苯酞氯化钠注射液对大鼠延髓缺血脑组织中NGF和BDNF表达的改变及其最终对神经元分布的影响的角度,对丁苯酞氯化钠注射液在延髓缺血过程中起到的保护作用进行深入的探讨。
1 材料和方法
1.1动物与分组SPF级Wistar成年健康雄性大鼠,220~260 g,购于河北医科大学实验动物中心。60只大鼠随机分为3组:假手术组、丁苯酞治疗组、缺血对照组。其中假手术组每组6只大鼠,其余按时间点分为7 d、14 d两个亚组,每组12只大鼠。
1.2方法
1.2.1延髓缺血模型制备结扎右侧颈总动脉:10%水合氯醛腹腔注射麻醉(350 mg/kg),仰卧固定,颈部正中切口,钝性分离胸锁乳突肌,暴露分离出右侧颈总动脉并结扎切断,检查无活动性出血后,用生理盐水和青霉素(1×105U/L)冲洗后缝合伤口。电凝椎动脉:大鼠俯卧固定,于后正中线第一颈椎水平处作纵形切口,沿中线分开肌层,暴露第一颈椎横突孔,将高频电刀的电凝刀头插入横突孔内凝闭椎动脉3~4 s,检查无活动性出血后,用生理盐水和青霉素(1×105U/L)冲洗后缝合伤口。待清醒后,单笼保温喂养。
1.2.2实验动物的干预方法假手术组只暴露双侧椎动脉及右侧颈总动脉,不做血管阻断处理。治疗组、缺血对照组均在阻断双侧椎动脉及右侧颈总动脉后立即开始治疗。治疗组每天腹腔注射丁苯酞氯化钠注射液两次,时间间隔12 h,每次注射计量按3 mg/kg计算,到术后7 d和14 d两个时间点分别处死,取延髓。缺血对照组每天腹腔注射生理盐水两次,时间间隔12 h,注射剂量为0.5 ml/次。到术后7 d和14 d两个时间点分别处死,取延髓。
1.2.3实验标本制作应用10%水合氯醛 (350 mg/kg)腹腔注射。仰卧位固定于鼠板上,快速剪开腹腔和胸腔的前壁,清晰的暴露出心脏,用连有输液管的预先处理为钝圆的针头插入左心室内,快速输入温生理盐水(37 ℃)100 ml,同时用眼科剪剪破右心耳,此时血液由右心耳处流出,待大鼠四肢末端变白,换上4%多聚甲醛(0.1 mol磷酸盐缓冲液配成pH 7.4)灌流固定。灌流结束后取出延髓,用冰生理盐水冲洗,除去血液。石蜡包埋切片。
1.2.4电镜标本制作将取得的标本切成1×1×1 mm3的小块,25%戊二醛固定4 h,0.1 mol/L的PBS冲洗3次,每次5 min,1%锇酸固定1.5 h,0.1 mol/L的PBS漂洗12 h,丙酮梯度脱水,Epon812浸透包埋,超薄切片,铀铅染色。
1.2.5Tunel法操作步骤(1)组织切片至于二甲苯Ⅰ、Ⅱ中各20 min,用无水乙醇洗2×3 min,95%乙醇、90%乙醇各洗一次,每次3 min,蒸馏水洗两次;(2)将组织切片置于蛋白酶K(20 μg/ml,pH 7.4)溶液中,室温孵育15 min;(3)0.01mol/L PBS (pH 7.4)冲洗3次;(4)擦干样品周围的水,滴加50 μl的Tunel反应混合液溶液,在温盒中37 ℃孵育60 min;(5)0.01 mol/L PBS (pH 7.4)冲洗3次;(6)擦干样品周围的水份,加入50 μl的转化剂-POD,在温盒中37 ℃孵育30 min;(7)0.01 mol/L PBS (pH 7.4)冲洗3次;(8)加入50 μl的DAB底物溶液,室温孵育10 min;(9)0.01 mol/L PBS (pH 7.4)冲洗3次;(10)依次分别用70%、95%、100%乙醇脱水,干燥;(11)二甲苯透明,中性树胶封片。
1.2.6尼氏染色主要步骤(1)组织贴片自然晾干;(2)无水乙醇+氯仿(1∶1)4 h;(3)100%乙醇(Ⅰ)3 min;(4)100%乙醇(Ⅱ)3 min;(5)95%乙醇3 min;(6)70%乙醇3 min;(7)50%乙醇3 min;(8)双蒸水1 min;(9)1%甲苯胺蓝染液,60 ℃恒温箱内染色50 min;(10)双蒸水浸泡数遍;(11)50%乙醇1 min;(12)70%乙醇(含1%冰醋酸)数秒钟,注意观察切片分色情况;(13)95%乙醇(Ⅰ)1 min;(14)95%乙醇(Ⅱ)1 min;(15)100%乙醇(Ⅰ)1 min;(16)100%乙醇(Ⅱ)1 min;(17)二甲苯(Ⅰ)5 min;(18)二甲苯(Ⅱ)5 min;(19)中性树胶封片。
1.2.7观察指标(1)每只大鼠取3张切片(片厚20 μm),每张切片在400倍光镜下随机选取5个视野,输入医学显微图像分析系统(MiVnt)进行图像处理。计数神经元及凋亡神经元,取其平均值为这只大鼠的神经元及凋亡神经元的细胞数。其中,凋亡神经元在光镜下呈现棕黄色[6]。(2)神经营养因子:NGF、BDNF蛋白表达的测定用SP免疫组织化学染色法,所有切片染色均采用相同条件,每批染色均设阴性对照。阴性对照用PBS替代一抗孵育切片。结果判定:阳性细胞的胞浆、胞膜、轴突呈棕黄色着色。图像分析:用Simple PCI-8图像分析软件对图像进行统计学分析。每张切片在光镜下选5个视野,取平均灰度值进行统计学分析。该分析仪器的灰度级为0~256灰级,平均灰度表示阳性细胞的反应强度,平均灰级越高,说明反应强度越低。
2 结 果
2.1各组脑组织中神经元数量的变化通过对7 d、14 d后实验动物的观察,治疗组及缺血对照组中神经元的数量较假手术组明显减少。治疗组神经元减少幅度在各时段均低于缺血对照组。同时,治疗组神经元凋亡数量幅度较缺血对照组的幅度低。与假手术组相比较有统计学差异(见表1、表2)。
2.2各组脑组织中NGF、BDNF灰度值的变化通过对7 d、14 d后实验动物的观察,治疗组及缺血对照组中灰度值较假手术组显著增加。但是,治疗组NGF、BDNF灰度值增加的程度低于缺血对照组NGF、BDNF灰度值增加的程度。其中,治疗组各时段NGF、BDNF灰度值均低于缺血对照组。与假手术组比较有统计学差异(见表3、表4)。
2.3各组脑组织中组织学观察在假手术组中,神经元胞体中央有大而圆的细胞核,胞体的细胞质内含有发达的粗面内质网、游离核糖体、高尔基复合体等。神经元尼氏体丰富。线粒体膜完整,线粒体嵴清晰。缺血对照组实验7 d时,可观察到神经元数量减少,核固缩、碎裂、溶解,膜结构模糊。核仁偏位,核膜内陷。线粒体体积较前增大,线粒体嵴变短。实验14 d时可观察到,神经元数量较前进一步减少,神经元溶解消失。
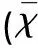
表1 各组大鼠脑组织中神经元数量比较±s)
与假手术组比较#P<0.05,##P<0.01
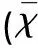
表2 各组大鼠脑组织中神经元凋亡数量比较±s)
与假手术组比较#P<0.05,##P<0.01
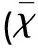
表3 各组大鼠脑组织中NGF蛋白阳性表达灰度值比较±s)
与假手术组比较#P<0.05,##P<0.01
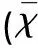
表4 各组大鼠脑组织中BDNF蛋白阳性表达灰度值比较±s)
与假手术组比较#P<0.05,##P<0.01
3 讨 论
BDNF、NGF是NT家族的成员,对神经系统发育及促进再生等方面具有重要作用[7],可调控氨基酸和小分子的摄入,增强功能蛋白和结构蛋白的合成,促进神经修复与再生功能[8]。有研究表明,BDNF、NGF对缺血损伤的神经元有保护作用,能阻断脑缺血时神经元凋亡的发生[9]。脑缺血后,BDNF、NGF均增加[10],通过拮抗兴奋性氨基酸毒性,稳定细胞内钙离子浓度,增强蛋白激酶活性,保护神经元作用[11]。
在延髓缺血后,出现神经元数量减少,凋亡神经元数量增加。在缺血条件下,神经胶质细胞大量增生填充于坏死区域,引起局部微循环障碍,即微血管凋亡的数量大于其新生的数量[12,13],更促进了神经元的凋亡。脑缺血后,脑神经元损伤的程度与BDNF和NGF的表达水平密切相关[14]。
丁苯酞是一种新型抗脑缺血药物,可通过解除微血管痉挛、抑制血小板聚集、抑制TXA2的合成等多个环节阻断脑缺血引起的病理过程。丁苯酞能清除自由基、抑制脂质过氧化反应,提高BDNF、NGF水平,进一步促进对神经元的保护作用,有效抑制其凋亡的发生。
本研究发现,在延髓缺血状态下,与假手术组相比较,治疗组神经元数量降低程度明显低于缺血对照组;治疗组NGF、BDNF的灰度值增加的程度明显低于缺血对照组;与缺血对照组相比较,丁苯酞氯化钠注射液治疗7 d、14 d时,神经元凋亡降低趋势与BDNF、NGF灰度值降低趋势呈正相关。通过实验发现,在脑组织慢性缺血的前提下,治疗组中NGF、BDNF表达水平升高,提示丁苯酞氯化钠注射液可以减少自由基产生等一系列机制保护神经元,更重要的是,可促进NGF、BDNF的表达,通过激发神经生长因子途径对神经元起到保护作用。
[1]董为伟.神经保护的基础[M].北京:科学出版社,2002.239-245.
[2]Hsu CY,An G,Liu JS,et al.Expression of immediate early gene and growth factor mRNAs in a focal cerebral ischemia model in the rat[J].Stroke,2001,24(12):178-181.
[3]孙春艳,胡豫,王雅丹,等.脑源性神经营养因子在多发性骨髓瘤患者血浆中的表达增高及其意义的初步探讨[J].中国实验血液学杂志,2005,13(1):104-109.
[4]Kalaria RN.The role of cerebral ischemia in Alzheimer’s disease[J].Neurobiol Aging,2000,21(2):321-330.
[5]Takeda A,Onddera H,Sugimoto A,et al.Coordinated expression of messenger RNAs for nerve growth factor,brain-derived neurotrophic factor and nerotrophin-3 in the rat hippocampus following transient forebrain ischemia [J].Neuroscience,1993,55(1):23-31.
[6]Blondeau N,Lauritzen I,Widmannc,et al.A potent protective role of lysophospho lipids against global cerebral ischemia and glutamate excite toxicity in neuronal cultures[J].J Cereb Blood Flow Metab,2002,22(10):1205-1211.
[7]Aloe L,Levi-Montalcini R.The discovery of nerve growth factor past and present studies[J].Neurol Res,2010,3(7):139-143.
[8]Diensthuber M,Lenarz T.Neurotrophic factor expression in vestibular schwannoma[J].Laiyngorhinootologie,2006,85(10):731-739.
[9]Kirland RA,Saavedra GM.Rapid activation of antioxidant degenses by nerve growth factor suppresses reactive oxygen species during neuronal apoptois[J].J Neurosci,2007,27(42):1115-1126.
[10]Gura T.Inna immunity Ancient system gets new respect[J].Science,2001,291(5511):2068-2071.
[11]Lemaitre B,Reichhart JM.Drosophilia host defense differential induction of antimicrobial peptide genes after infection by various classes of microorganism[J].Proc Natl A Cad Sci USA,1997,94(26):14614-14619.
[12]Barde YA,Edgar D,Thoenen M.Purification of a new neurotrophic factor from mammalian brain[J].EMBO J,1982,1(5):549-530.
[13]Ferrer I,Krupinski J,Goutan E,et al.Induction of brain-derived neurotrophic factor and the receptor trkB mRNA following middle cerebral artery occlusion in rat[J].Neurosci Lett,1996,211(1):57-60.
[14]Wolters FJ,Rinkel GJ,Vergouwen MD.Clinical course and treament of vertebrobasilar dolichoectasia:a systematic review of the literature[J].Neurol Res,2013,35(2):131-137.
The effect of butylphthalide on neuron apoptosis,expression of NGF and BDNF in ischemia stroke tissue of rat cerebrum
ZHUJiang,ZHANGYukun,ZHANGJie,etal.
(DepartmentofNeurology,AffiliatedHospitalofChengdeMedicalCollege,Chengde067000,China)
ObjectiveTo study the effect of butylphthalide on neurons apoptosis,expression of NGF and BDNF in medullary ischemia of rat cerebrum.MethodsThe Wistar rats were divided randomly into three groups,sham-operated group,butylphthalide-creating and medullary ischemia group.The model of medullary ischemia in rats were ligated the right common carotid artery and blocked the bilateral vertebral by electrocoagulation.The rats in the butylphthalide treatment group and ischemia control group respectively received butylphthalide and normal saline by intraperitoneal injections.Nissl staining and Tunel method were used to show the neurons and apoptotic cells respectively.The immunohistochemistry was used to evaluate effects of Butylphthalide on NGF and BDNF expression.We observed brain neuron apoptosis density through the optical microscope to observe brain neuron apoptosis density,grayscale values of NGF and BDNF plays,using the grey value were analyzed.ResultsTreatment group of neurons apoptosis,model NGF and BDNF grayscale values were lower than control group ischemia.ConclusionModel NGF,BDNF level are closely associated with neurons density.Comparing to control group,butylphthalide can significantly up-regulate the expressions of NGF and BDNF in genetic transcription level,and protect from the medullary ischemia injury.
Butylphthalide;Medullary ischemia;Neurons;Apoptosis;Nerve growth factor(NGF);Brain-derived neurotrophic factor(BDNF);Rats
1003-2754(2016)02-0165-03
治疗
2015-10-23;
2016-01-28
2013年度河北省教育厅河北省高等学校科学研究项目(No.QN20131075)
(1.承德医学院附属医院神经内科,河北 承德 067000;2.承德县医院,河北 承德 067400;3.承德医学院人体解剖学教研室,河北 承德 067000;4.承德医学院附属医院检验科,河北 承德 067000)
丁萌,E-mail:2270065 ding @126.com
R743.3
A
