重症肌无力患者外周血Foxp3和CD152表达变化及其相关性分析
2016-11-12张哲峰梁华刚杜海荣
张哲峰,梁华刚,薛 雷,杜海荣,张 璐,贾 瑞,高 鲲
重症肌无力患者外周血Foxp3和CD152表达变化及其相关性分析
张哲峰,梁华刚,薛雷,杜海荣,张璐,贾瑞,高鲲
目的研究重症肌无力(MG)患者经全胸腺切除治疗外周血中调节性T细胞(CD4+CD25+Treg)中Foxp3及CD152(CTLA-4)的表达情况。方法采集重症肌无力经手术切除胸腺患者50例术前和术后6个月外周血为实验组,对照组为25例健康志愿者的外周血。应用流式细胞分析方法检测患者手术前后和健康志愿者外周血中的调节性T细胞Foxp3及CD152(CTLA-4)的表达情况。结果患有MG患者术前外周血中调节性T细胞Foxp3及CD152(CTLA-4 )表达水平与对照组相比显著降低(P<0.05);全胸腺切除6个月后CD4+CD25+Foxp3+Treg细胞及CD152(CTLA-4)表达比例与手术前比较升高(P<0.05),与健康对照组比较水平低(P<0.05);调节性T细胞中Foxp3表达水平与CD152 (CTLA-4 )表达水平呈现一定的正相关性(P<0.001)。结论重症肌无力患者外周血调节性T细胞中Foxp3和CD152(CTLA-4)表达水平较低,手术治疗能够明显提高Foxp3及CD152(CTLA-4),然而与正常人比较还不能达到正常的水平,为重症肌无力发病机制与胸腺切除治疗提供了理论依据。
Foxp3;CD152(CTLA-4);重症肌无力;全胸腺切除
重症肌无力(myasthenia gravis,MG)是乙酰胆碱受体抗体介导、T细胞依赖、补体参与的发生于神经肌肉接头处的自身免疫性疾病[1]。一些研究显示行胸腺切除术后的MG患者细胞免疫、体液免疫均受抑制,提示胸腺在MG的发生发展中起重要作用[2,3]。CD4+CD25+调节性T细胞(Treg)是维持机体内稳态的重要细胞,具有免疫抑制功能,参与多种免疫性疾病的发生,而Foxp3是其特异性表达的转录因子,它的突变或表达减少或功能下降均会导致Treg数量减少或功能缺陷,从而导致MG等自身免疫疾病的发生[4]。研究人员[5]表明Foxp3和CD152水平可较好地反映Treg细胞功能状态。本研究旨在通过检测MG患者手术前、术后及健康对照组外周血CD4+CD25+Treg中Foxp3和CD152的水平变化来探讨MG这种疾病的发病机制,以及全胸腺切除治疗重症肌无力的理论依据。
1 材料与方法
1.1研究对象选取2014年1月-2015年6月秦皇岛市第一医院胸外科住院的MG手术患者共50例,年龄23~72(46.2±10.1)岁,男女性别比9 ∶16。患者均根据临床症状、新斯的明试验、乙酰胆碱受体抗体、重频刺激试验和肺部CT确诊为MG,并排除了其他自身免疫性疾病、恶性肿瘤、严重感染、严重器官不全等患者。另将25例健康体检者作为对照组,年龄22~68(43.7±11.2)岁,男女性别比2∶3。患者和对照者年龄差异无统计学意义(t=0.512,P=0.552);两组性别比差异无统计学意义(χ2=2.258,P=0.066)。本研究得到秦皇岛市第一医院伦理委员会的批准,检查者均已签署书面知情同意书。
1.2主要试剂和仪器PE标记的抗人CD25抗体,Alexa-fluor 488标记的抗人Foxp3抗体,PerCP-Cy5.5标记的抗人CD4抗体,APC标记的抗人CD152抗体,PE-CY7 标记的抗人CD3抗体(以上流式抗体从美国BD公司购买),固定/打孔液从eBioscience公司购买, PI(propidium iodide)从美国Sigma公司购买淋巴细胞分离液Ficoll-Hypaque(1.077)从美国Sigma公司购买;台式离心机从美国BECKMAN公司购买;FACS Fortessa流式细胞仪从美国BD公司购买;正置光学显微镜从日本OLYMPUS公司购买。
1.3制备外周血单个核细胞在早晨空腹采集患者及健康对照组静脉血15 ml,放入肝素抗凝管中,放在冰盒准备分离单个核细胞。将15 ml 1×PBS稀释外周血将其混匀,将15 ml淋巴细胞分离液加入到50 ml离心管中,然后将稀释后的外周血轻轻加到淋巴细胞分离液上层,形成血样和淋巴细胞分离液分层。2000 rpm,离心30 min后将中间的白膜层吸出后再次离心,分离出单个核细胞。
1.4流式细胞仪荧光抗体标记及检测将滴定后的CD3、CD4、CD25流式抗体10 μl加入100 μl重悬的细胞中混匀,4 ℃避光孵育30 min后,加入2 ml的FACS media溶液,1400 rpm,5 min离心,弃上清后再重复洗一遍。配固定打孔工作液,加500 μl固定打孔工作液重悬细胞,4 ℃避光60 min。取1×打孔缓冲液,1650 rpm,4 ℃,离心5 min,洗两次,弃尽上清后进行细胞内染色,取Foxp3抗体CD152抗体加至样品流式管中,混匀,4 ℃避光孵育60 min,加入1×打孔缓冲液,1650 rpm,5 min离心弃尽上清,加打孔缓冲液300 μl/管重悬细胞。通过FACS Fortessa流式细胞仪对标记处理的细胞进行检测,用Flowjo软件对所得数据相应细胞表型可以进行分析。
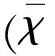
2 结 果
2.1通过检测调节性T细胞的Foxp3和CD152的比例表明重症肌无力患者术前明显低于健康人MG患者术前外周血CD4+CD25+Treg中Foxp3表达比例为(2.21±0.51),CD152表达比例为(0.88±0.25);健康组Foxp3表达比例为(4.58±0.88),CD152表达比例为(3.36±1.32)。MG患者术前Foxp3和CD152表达明显低于健康对照组,具有统计学意义(P<0.05)(见表1)。
2.2重症肌无力患者手术后外周血中调节T细胞Foxp3和CD152的水平手术后6个月MG患者外周血调节性T细胞Foxp3表达水平为3.66±1.2,CD152表达水平为2.44±1.12。与手术前相比Foxp3和CD152的表达水平明显高于患者手术前水平,经比较具有统计学意义(P<0.05);与对照组比较,手术后Foxp3和CD152水平仍低,未达到健康者水平,差异有统计学意义(P<0.05)(见表1)。
2.3Foxp3与CD152比例相关性分析重症肌无力患者外周血调节性T细胞的Foxp3与CD152呈正相关性(r=0.679,P<0.001)。
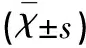
表1 各组外周血Treg 检测结果
与术前组比较*P<0.05;与对照组比较#P<0.05
3 讨 论
MG的发病与胸腺关系密切,临床上胸腺切除的疗效已得到公认。本研究50例患者合并胸腺瘤42例,胸腺增生8例,眼肌型MG28例,全身型MG22例。经过胸腺切除术后完全缓解22例,缓解20例,无效8例,总有效率为84%。
胸腺为T淋巴细胞的发育器官,MG患者胸腺内Treg数量的下降与其自身反应性T细胞的大量激活及其免疫耐受的破坏具有相关性。Foxp3主要是表达于CD4+CD25+Treg和异位表达于CD4+CD25-T细胞上,但可使CD4+CD25-T细胞转换成Treg,因此具有两大功能特性:免疫无能及免疫抑制[6]。所以Foxp3是影响Treg分化和功能的一种很重要的转录因子。有研究表明CD4+CD25+T细胞改变可能与MG患者胸腺手术状态及疾病的进展具有相关性。Sun Y等研究表明症状未控制的MG患者外周血CD4+CD25+T 细胞比例明显低于稳定期的MG患者,与此同时胸腺切除术后患者外周血CD4+CD25+T细胞比例明显高于未手术患者和正常对照[7]。我们在研究中发现,MG患者外周血中Foxp3表达显著低于对照组,提示Foxp3在MG发病中起重要的负性调节作用。Foxp3表达降低可以引起CD4+CD25+Treg的数量下降、功能下调,才引起机体自身免疫抑制失衡而导致MG发病。我们的研究发现胸腺切除术后CD4+CD25+T细胞较手术前明显上升,考虑胸腺(包括胸腺瘤)切除术后,非胸腺来源的CD4+CD25+T细胞可能进入外周血维持这一细胞亚群的平衡,可能激活了外周既往存在的胸腺来源的Treg细胞的克隆扩增。
CD152(CTLA-4)细胞毒性T淋巴细胞抗原是T细胞表面表达的一类共刺激分子,在T细胞中主要表达于调节性T细胞。CD4+CD25+Treg细胞主要依赖CD152(CTLA-4)直接接触方式介导抑制T细胞的活化和增殖[8]。CD152并不能稳定表达于细胞表面,而是贮存于Treg细胞的膜下囊泡中[9],细胞内高表达CTLA-4是Treg细胞的表型特征之一,其表达水平能够反映其潜在的功能状态。有研究[10]显示肿瘤患者外周血CD4+CD25+Treg免疫抑制作用增强与其胞内高表达CTLA-4有关。因此,MG患者CD4+CD25+Treg胞内CTLA-4表达量减少可能减弱了CD4+CD25+Treg潜在的免疫抑制作用,限制了其免疫负性调节能力。
Treg细胞与CD152分子都可作为削弱免疫反应的工具,无论是何种亚型或起源。Treg或CD152分子任意一种升高或者过表达,都可造成肿瘤患者的免疫抑制状态[11]。早期研究发现,CD152和Treg在免疫调节功能上有部分重叠。占多数比例的CD152依赖性免疫反应包含了存在于Treg中CD152的活动,CD152同样可对常规T细胞起作用。CD152反映了Treg功能的主要机制,Treg亦可作用于大量非CD152依赖的抑制性免疫机制[12]。本研究结果显示MG患者外周血Treg细胞Foxp3和胞内CD152的表达存在正相关性,这可能由于Foxp3可能直接指导CD152表达有关。CD152可能是代表Foxp3+Treg细胞抑制活性的重要分子,但CD152和Foxp3之间的确切关系还有待于进一步研究。
综上所述,本研究显示胸腺切除术影响MG患者外周血中细胞免疫,尤其是提高了外周血Treg细胞比例,但这一结果受到许多因素影响,如肌无力分型、是否应使用糖皮质激素、是否合并胸腺瘤等因素影响。因此,需要扩大样本以及细化分类等进一步研究。
[1]Vincent A.Unravelling the pathogenesis of myasthenia gravis[J].Nat Rev Immunol,2002,2(10):797-804.
[2]孟云霄,毕娅兰,卢朝辉,等.胸腺瘤与自身免疫性疾病[J].中国神经免疫学和神经病学杂志,2014,21(4):294-297.
[3]Sakaguehi S,Wing K,Yamaguchi T,et al.Dynamics of peripheral tolerance and immune regulation mediated by Treg[J].Eur J Immunol,2009,39(9):2331-2336.
[4]饶静,任明山.FoxP3:重症肌无力发病过程中的重要调控因子[J].国际免疫学杂志,2010,33(1):16-18.
[5]Tang AL,Teijaro JR,Njau MN,et al.CTLA4 expression is an indicator and regulator of steady-state CD4+FoxP3+T cell homeostasis[J].J Immunol,2008,181(3):1806-1813.
[6]Bacchetta R,Passerini L,Gambineri E,et al.Defective regulatory and effector T cell functions in patients with FOXP3 mutations[J].J Clin Invest,2006,116(6):1713-1722.
[7]Sun Y,Qiao J,Lu CZ,et al.Increase of circulating CD4+CD25+T cells in myasthenia gravis patients with stability and thymectomy[J].Clin Immunol,2004,112:284-289.
[8]Sojka DK,Hughson A,Fowell DJ.CTLA-4 is required by CD4+CD25+Treg to control CD4+T-cell lymphopenia-Induced proliferation[J].Eur J Immunol,2009,39(6):1544-1551.
[9]Tai X,Van Laethem F,Pobezinsky L,et al.Basis of CTLA-4 function in regulatory and conventionalCD4(+)T cells[J].Blood,2012,119(22):5155-5163.
[10] Kono K,Kawaida H,Takahashi A,et al.CD4(+)CD25high regulatory T cells increase with tumor stage in patients with gastric and esophageal cancers[J].Cancer Immunol Immunother,2006,55(9):1064-1071.
[11]Erfani N,Ghayumi MA,Haghshenas MR,et al.Increase of regulatory T cells in metastatic stage and CTLA-4 over expression in lymphocytes of patients with non-small cell lung cancer[J].Lung Cancer,2012,77(2):306-311.
[12]Metzler B,Wraith DC.Phenotypic analysis of CTLA-4 and CD28 expression during transient peptide-induced T cell activation in vivo[J].Int Immunol,1999,11(5):667-675.
Expression and correlation of Foxp3 and CD152 in the myasthenia gravis patients’peripheral blood
ZHANGZhefeng,LIANGHuagang,XUELei,etal.
(DepartmentofThoracicSurgery,theFirstHospitalofQinhuangdao,Qinhuangdao066000,China)
ObjectiveThis study aimed to identify the results of Foxp3 and CD152 of CD4+CD25+regulatory T cells in peripheral blood after total thymectomy in patients with myasthenia gravis.MethodsWe included a total of 50 MG patients following total thymectomy.We set 25 healthy people as the control.Blood samples were selected from preoperative groups,postoperative groups and control groups.Using flow cytometry study to examine the peripheralblood and analyze the expression of Foxp3 and CD152 of CD4+CD25+regulatory T cells.ResultsThe preoperative levels of Foxp3 and CD152 of CD4+CD25+regulatory T cells in peripheral blood were significantly decreased (P<0.05) compared with the healthy control.The total proportion of Foxp3 and CD152 in the postoperative group were markedly higher than that in the preoperative group(P<0.05),however,comparing to the healthy control the proportion were lower (P<0.05).We found the level of Foxp3 and CD152 were positively correlated in Tregs in myasthenia gravis patients (P<0.001).ConclusionOur report showed that myasthenia gravis patients had low expression of Foxp3 and CD152 of Tregs in peripheral blood,total thymectomy could markly increase the expression of them.Together,our research provided theoretical basis for pathogenesis of myasthenia gravis and thymectomy.
Foxp3;CD152(CTLA-4);Myasthenia gravis;Thymectomy
1003-2754(2016)02-0154-03
2015-10-12;
2015-11-28
秦皇岛市科学技术研究与发展计划项目(No.201502A086)
(河北秦皇岛市第一医院胸外科,河北 秦皇岛 066000)
高鲲,E-mail:15133526006@163.com
R746.1
A
