MicRNA-124可能通过PI3K/Akt通路调节缺血脑组织细胞凋亡
2016-11-12王长明蒋国红张金菊刘海军魏志杰
王长明,蒋国红,徐 平,张金菊,刘海军,魏志杰,张 丽
MicRNA-124可能通过PI3K/Akt通路调节缺血脑组织细胞凋亡
王长明,蒋国红,徐平,张金菊,刘海军,魏志杰,张丽
目的探讨脑缺血环境下对micRNA-124表达的影响。方法采用Western blot、荧光定量PCR技术检测脑缺血后缺血皮质区不同时间点bax、bcl-2、caspase-3、ROCK1、micRNA-124蛋白或基因的表达水平。 结果缺血脑组织细胞micRNA-124基因表达量与调控细胞凋亡指标bax、bcl-2、caspase-3增高一致;bax、bcl-2、caspase-3、ROCK1活化片段蛋白表达量逐渐升高,在随后观察的时点内持续处于高表达状态(P<0.01)。结论micRNA-124可能参与缺氧致脑组织细胞凋亡的过程,其机制可能是通过PI3K/Akt通路,激活或抑制bax、bcl-2、caspase-3、ROCK1其中一个或是多个基因调节缺氧脑组织细胞凋亡。
micRNA-124;ROCK1;Western blot;荧光定量PCR;细胞凋亡
脑缺血性卒中患者大量脑神经元因缺血缺氧损伤发生不可逆性的变性坏死,大脑局部缺血时导致多种micRNAs的表达发生异常改变,这些micRNAs水平的改变可影响其靶基因的表达。脑缺氧环境刺激micRNA-124表达上调,而micRNA-124与磷酯酰肌醇-3激酶 (phosphatidylinositol 3-kinase,PI3Ks)、蛋白激酶B(protein kinase B,PKB也被称作Akt)通路关系密切,PI3K/Akt通路具有调节细胞增殖、分化和凋亡的作用。目前micRNA-124对缺血脑卒中神经元凋亡及再生的调控机制不明,本研究通过构建大鼠脑缺血模型,检测脑缺血后缺血皮质区不同时间点micRNA-124及可能靶基因bax、B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia2,bcl-2)、半胱氨酸天冬氨酸蛋白水解酶(caspase-3)、Rho相关的卷曲螺旋蛋白激酶(Rho-associated coiled-coil protein kinase,ROCK)中ROCK1的表达水平,探讨脑缺血环境下对micRNA-124表达的影响。
1 材料与方法
1.1材料健康雄性SD大鼠35只,体重(200±20)g(中山大学实验动物中心提供,实验动物生产许可证号为:SCXK粤监2011-0029);数码凝胶图像分析系统,LG2000,杭州朗基科学仪器有限公司。电泳、电转系统,Mini型蛋白电泳系统(小型全套蛋白电泳系统)Bio-rad(美国伯乐)。Goat anti-rabbit IgG-HRP和Goat anti-mouse IgG-HRP购自SANTA CRUZ。荧光定量仪ABI 7300,SYBR Premix EX Taq ⅡKit TaKaRa(RR820A),PrimeScript TMRT reagent Kit TaKaRa(RR047A)。
1.2研究方法
1.2.1MCAO模型的制作、鉴定与分组参照改良的Longa 等方法制作MCAO模型。分为正常组、假手术组、灌注组1 d、灌注组3 d、灌注组7 d(每组7只大鼠)。假手术组大鼠仅游离血管,其它同缺血组大鼠。取缺血后1 d SD大鼠脑组织行TTC染色。SD大鼠MCAO模型麻醉清醒后出现左侧肢体神经功能缺损和右侧出现Horner征者表明模型制作成功,Zea longa评分1~3分者选为实验研究对象。
1.2.2Western blot技术检测ROCK1的蛋白表达用RIPA法提取总蛋白,BCA法测定蛋白质浓度。加入5×SDS蛋白上样缓冲液(按1∶4的比例),100 ℃煮沸5~10 min。-20 ℃保存备用。用SDS-PAGE蛋白分离,蛋白转印到硝酸纤维素膜,转膜后所有蛋白用5%的脱脂奶粉封闭,室温封闭1~2 h或4 ℃封闭过夜。孵育一抗,根据所需抗体浓度,用TBST稀释(目的蛋白bax:1∶2000;bcl-2:1∶1000;caspase-3:1∶400)。4 ℃孵育过夜。孵育二抗,根据所需抗体浓度,用TBST稀释,室温孵育2 h左右(二抗所用浓度均为1∶5000)。用ECL显色试剂盒显色,在暗房中观察荧光的明亮度确定曝光的时间,洗片进行显影和定影。结果用LabWor 3.0 UVP软件,以目的条带与β-actin的灰度值进行分析。
1.2.3荧光定量PCR检测bax、bcl-2、caspase-3、micRNA-124基因表达(1)引物设计合成:GenBank上查找目的基因mRNA序列,在CDS区设计特异性引物:bcl-2:Forward Primer:5’-GGCATCTGCACACCTGGAT-3’,Reverse,Primer:5’-ATCAAACAGAGGTCGCATGCT-3’;bax:Forward Primer:5’-CCCACCAGCTCTGAACAGTTC-3’,Reverse Primer:5’-TCTCCCCAGCCATCCTCTCT-3’;caspase-3:Forward Primer:5’-AGTGGAGGCCGACTTCCTGTA-3’,Reverse Primer:5’-TGGCGCAAAGTGACTG;micR-124:RT Primer:5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTCATT-3’;Forward Primer:5’-AGCTCGTAAGGCACGCGGT-3’,Reverse primer:5’-GTGCAGGGTCCGAGGT-3’;GAPDH(内参):Forward Primer:5’-AGGGCTGCCTTCTCTTGTGA-3’,Reverse Primer:5’-AACTTGCCGTGGGTAGAGTCA-3’;U6(内参):Forward Primer:5’-TGACACGCCACTTCAGCAA-3’,Reverse Primer:5’-CTTCAGCTTCTCTGCCTCCAG-3’。(2)组织RNA的提取:取适量组织至1.5 ml EP管中,用剪刀剪碎组织加Trizol 1 ml后用玻璃棒研磨,充分振荡混匀,室温放置5 min。加入氯仿0.2 ml ,盖紧盖子,用振荡器振荡15 s,室温孵育2~3 min,4 ℃ 12000 r/min 离心15 min,取上清液至新的1.5 ml Eppendorf 管,加与上清液等体积的异丙醇,轻轻混匀,-20 ℃孵育样品20~30 min,4 ℃ 12000 r/min 离心10 min,弃上清液。75%乙醇(含DEPC水)800 μl洗涤沉淀一次,4 ℃ 7500 r/min 离心5 min,弃乙醇。空气或真空干燥5~10 min(不要完全干燥),加DEPC处理水20~50 μl溶解RNA,-80 ℃保存备用。若长期保存,加入2.5倍体积乙醇,置-80 ℃保存。纯度检测:取1 μl RNA样品50倍稀释,在岛津(日本)UV-1750紫外分光光度仪上测定OD值,OD260/OD280的比值在1.8~2.0之间,说明制备的RNA较纯,无蛋白质污染。总RNA完整性检测:挑5例取RNA样品1 μl,1%琼脂糖凝胶电泳80 V×20 min,用凝胶成像系统观察总RNA的5 s rRNA、18 s rRNA和28 s rRNA条带,3条条带完整的话即可证明总RNA抽提比较完整。(3)逆转录反应:取4 μl RNA模板做逆转录反应,仪器为BIO-RAD定性PCR仪,反应体系RNase Free dH2O 10 μl,5×Prime ScriptTM Buffer (for real time)2 μl,PrimeS,criptTM RT Enzyme Mix I 1 μl,Oligod T Primer(50 μmol)1 μl,Random 6 mers (100 μmol) 2μl,RNA 4 μl,总体积20 μl。MicRNA124逆转录RNase Free d H2O 12.5 μl,5×Prime ScriptTM Buffer (for real time)2 μl,Prime ScriptTM RT Enzyme Mix I 1 μl(非MicRNA124)。MicRNA124:RT Primer:(10 pmol/μl)0.5 μl,RNA 4 μl,总体积20 μl。反应条件:37 ℃ 15 min,然后85 ℃ 5 s。(4)荧光定量PCR反应:反应体系:H2O 6.8 μl,SYBR®Premix Dimer Eraser(2×)10 μl,Forward Primer (10 pmol/μl) 0.6 μl,Reverse Primer (10 pmol/μl)0.6 μl,cDNA2 μl,总体积20 μl。
2 结 果
2.1MCAO模型的制作SD大鼠MCAO模型麻醉清醒后,左侧肢体神经功能缺损和右侧出现Horner征者表明模型制作成功,Zea longa评分1~3分者选为实验研究对象。取缺血后1 d SD大鼠脑组织行TTC染色(见图1)。
2.2荧光定量PCR检测micRNA-124基因表达荧光定量PCR (SYBR Green法)检测大鼠缺血脑组织bax、bcl-2、caspase-3、miR-124基因表达。脑缺血组织bax、bcl-2、caspase-3基因表达量第一天逐渐升高,3 d达高峰。miR-124基因表达量与缺血后脑细胞的细胞凋亡指标bax、bcl-2、caspase-3变化基本一致,也是第一天逐渐升高,3 d达高峰。与对照组比较,差别有统计学意义(P<0.01)(见图2、图3)。
2.3Western blot技术检测ROCK1的蛋白表达根据WB图谱分析,内参蛋白和目的蛋白都有条带。bax、bcl-2、caspase-3、ROCK1活化片段在缺血再灌注1 d后逐渐升高,在随后观察的时点内持续处于高表达状态,与对照组比较,差别有统计学意义(P<0.01),ROCK1与缺血后脑细胞的细胞凋亡指标bax、bcl-2、caspase-3变化一致(见图4)。

图1 A模型组 B手术组
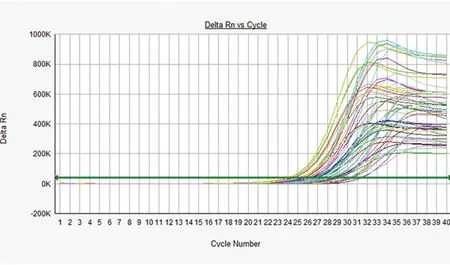
图2 micRNA-124样本扩增曲线图
注释:Ct值是:每个反应管内的荧光信号达到设定的域值时所经历的循环数;每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小
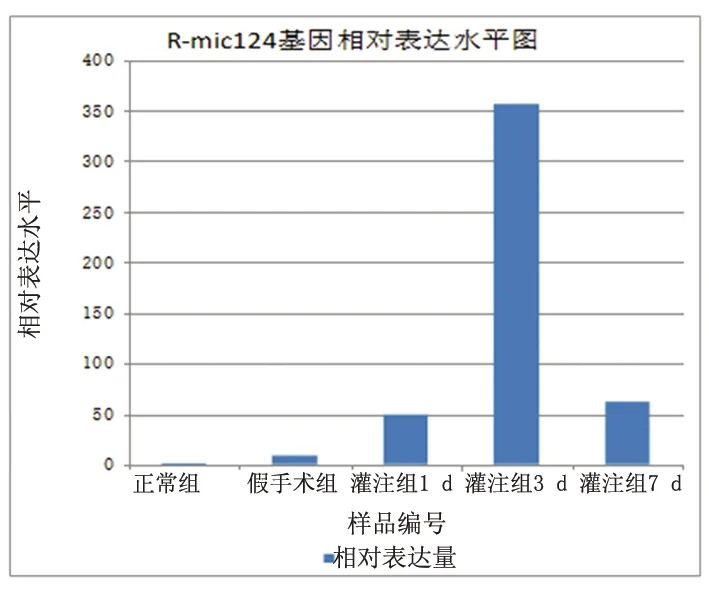
图3 MicRNA-124基因相对表达量
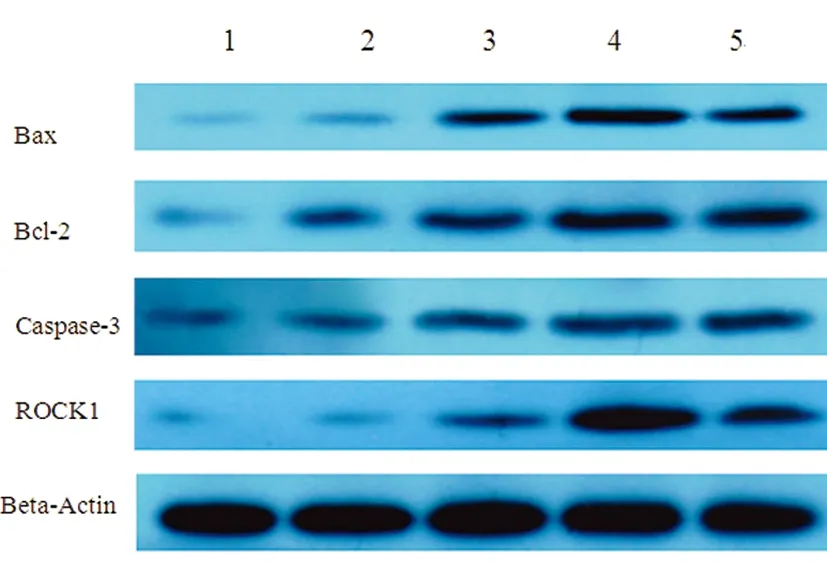
图4bax、bcl-2、baspase-3、ROCK1的蛋白表达(正常组、假手术组灌注组1 d、灌注组3 d、灌注组7 d)
3 讨 论
MicRNA是一类高度保守非编码RNA分子,长度大约为18-22个碱基对。尽管目前只发现了数百种micRNA,但每种micRNA都可能调节数百个靶基因,人类超过1B(billion)的基因可能由micRNA调控。micRNA在神经系统中大量表达,脑组织中特有的micRNA包括micRNA-9、micRNA-124a、micRNA-124b、micRNA-135、micRNA-153、micRNA-183和micRNA-219等[1]。Lagos-Quintana M等研究micRNAs表达的组织特异性时发现micRNA-101、124、127、128、131和132在小鼠脑组织中特异性表达,其中micRNA-124表达最为明显,在大脑皮质中脑和小脑中特异性表达均高,约占脑部总micRNAs的25%~48%,在中枢神经系统(central nervoussystem,CNS)中的表达量比其他组织高100多倍[2]。多种micRNAs在脑组织中高度表达,这些micRNAs可能与脑组织的发育、神经元的分化及高级神经功能的行使等密切相关[3]。
脑缺血后众多与NSCs增殖分化相关的特异micRNAs表达水平也发生急剧的变化,提示micRNAs可能也参与了脑缺血后NSCs增殖分化过程的调控。但哪些特异micRNAs参与调控及如何调控脑缺血后的NSCs增殖分化过程并不完全清楚。micRNA-124是CNS中含量最多的一种micRNA[4],micRNA-124的高表达提示其在中CNS中有着极其重要的作用,因此micRNA-124成为分子生物学和神经生物学最受关注的micRNA之一[5]。micRNA-124在缺血性脑卒中通过影响氧和葡萄糖剥夺而诱发细胞凋亡[6]。近来也有学者在局限性脑缺血的大鼠模型上发现,micRNA-124可以在缺血区通过调节Ku70mRNA和其蛋白水平从而促进脑缺血/再灌注后脑的损伤和功能障碍[7]。
PI3K/Akt信号通路是细胞内重要存活和抗凋亡的信号转导通路。PI3K是一类脂性激酶,PI3K家族与细胞增殖、抗凋亡、细胞迁移、膜泡转运、细胞癌性转化等众多过程相关,这些生物效应主要是通过PI3K催化形成的“锚”分子3-磷酸肌醇脂(PIP、PIP2、PIP3)介导。Akt是一种丝氨酸/苏氨酸激酶,活化的Akt通过磷酸化多种酶、激酶和转录因子等进而调节细胞功能。Akt的磷酸化激活主要依赖PI3K的活化,活化的Akt通过磷酸化和纯化其下游底物,经由多种途径而促进细胞的存活。脑损伤后多种神经营养因子通过激活PI3K/Akt信号途径发挥脑保护作用。研究表明在成年兔脑组织中Akt有微量表达,创伤性脑损伤后1 h p-Akt表达开始增加,在损伤皮质边缘区其免疫反应性增强[8],全脑组织中p-Akt区域表达的差异可能导致细胞损伤程度的不同。提示PI-3K/Akt信号通路参与调控了创伤性脑损伤后的病理过程。
脑缺氧环境刺激micRNA-124表达上调,而micRNA-124与PI3K/Akt通路关系密切,PI3K/Akt通路具有调节细胞增殖、分化和凋亡的作用。目前micRNA-124对缺血脑卒中神经元凋亡及再生的调控机制不明。本研究通过构建大鼠脑缺血模型,荧光定量PCR检测大鼠缺血脑组织bax、bcl-2、caspase-3、micRNA-124基因表达。结果显示脑缺血组织bax、bcl-2、caspase-3基因表达量第一天逐渐升高,3 d达高峰。micRNA-124基因表达量与缺血后脑细胞的细胞凋亡指标bax、bcl-2、baspase-3变化基本一致,亦在第1天逐渐升高,3 d达高峰;Western blot技术检测bax、bcl-2、caspase-3、ROCK1的蛋白表达,结果表明bax、bcl-2、caspase-3、ROCK1活化片段在缺血再灌注1 d后逐渐升高,在随后观察的时点内持续处于高表达状态,与对照组比较,差别有统计学意义(P<0.01)。
bax、bcl-2、caspase-3、ROCK1均为细胞凋亡调控基因。bcl-2作为抗凋亡基因、bax作为促进凋亡基因,都可作为caspase-3的上游调控基因,bcl-2、bax蛋白位于线粒体上游,是线粒体膜的通透性改变的重要调控因素,其过度表达能活化下游caspase-3蛋白酶,介导细胞的存活或死亡。ROCK可以被caspase-3激活,ROCK1是活化的caspase-3的直接裂解底物,而激活的ROCK1又可以反馈激活caspase-3。MicRNA-124与细胞凋亡基因一样在缺血脑组织中表达明显增高,表明micRNA-124可能参与了缺氧致脑细胞凋亡的过程,其机制可能是通过PI3K/Akt通路。激活或抑制bax、bcl-2、caspase-3、ROCK1其中一个或是多个基因,在缺氧脑组织细胞凋亡中起调节作用。但其在该过程中是抗凋亡或是促进细胞凋亡,以及具体调控靶基因及机制需要我们进一步深入研究探讨。
[1]Gao FB.Posttranscriptional control of neuronal development by microRNA networks[J].Trends Neurosci,2008,31(1):20-26.
[2]Lagos-Quintana M,Rauhut R,Yalcin A,et al.Identification of tissue-specific microRNAs from mouse[J].Curr Biol,2002,12(9):735-739.
[3]Yu JY,Chung KH,Deo M,et al.MicroRNA miR-124 regulates Neurite out growth during neuronal differentiation[J].Expcell Res,2008,314(14):2618-2633.
[4]Akerblom M,Sachdeva R,Barde I,et al.MicroRNA-124 is a subventricular zone neuronal fate determinant[J].J Neurosci,2012,32(26):8879-8889.
[5]Gao FB.Context-dependent functions of specific microRNAs in neuronal development[J].Neural Dev,2010,5:25.
[6]Sun Y,Gui H,Li Q,et al.MicroRNA-124 protects neurons against apoptosis in cerebral ischemic stroke[J].CNS Neurosci Ther,2013,19(10):813-819.
[7]Zhu F,Liu JL,Li JP,et al.MicroRNA-124(miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/reperfusion[J].J Mol Neurosci,2014,52(1):148-155.
[8]Zhao S,Fu J,Liu X,et al.Activation of Akt/GSK-3beta/beta-catenin signaling pathway is involved in survival of neurons after traumatic brain injury in rats[J].Neurol Res,2012,34(4):400-407.
MicRNA-124 may regulating hypoxia brain cells apoptosis through PI3K/Akt pathway
WANGChangming,JIANGGuohong,XUPing,etal.
(DepartmentofNeruology,1stAffiliatedHospitalofZunyiMedicalCollege,Zunyi563003,China)
ObjectiveTo explore micRNA-124 expression under the condition of cerebral ischemia.MethodsUsing Western blot and fluorescence quantitative PCR technique to detect bax,bcl-2,caspase 3,ROCK1,micRNA-124 protein or gene expression of ischemic cortex at different time points after cerebral ischemia.ResultsGene expression of MicRNA-124 with bax,bcl-2,caspase-3 increased consistently;bax,bcl-2,caspase-3 and ROCK1 segments of activated protein expression quantity increased.In the subsequent observation point inside the continued at a high expression.ConclusionMicRNA-124 may be involved in the process of anoxia brain tissue cell apoptosis,its mechanism may be through PI3K/Akt pathway to activate or inhibit bax,bcl-2,caspase-3,ROCK1 one or multiple genes,regulating cell apoptosis of the anoxia brain tissue.
micRNA-124;Western blot;ROCK1;Luorescence quantitative PCR;Cell apoptosis
1003-2754(2016)02-0146-04
2015-12-04;
2016-01-30
遵义市科技计划,遵市科合社字(2014,No.78)
(遵义医学院附属医院神经内科,贵州 遵义 563003)
蒋国红,E-mail:421855696@qq.com
R743.32
A
