急性脑梗死早期血中miRNAs水平与脑侧支循环建立的关系
2016-11-12吴大玉孙家兰吴菲菲顾夏菊李龙宣
彭 彬,吴大玉,孙家兰,黄 澍,吴菲菲,顾夏菊,朱 玮,周 飞,李龙宣
急性脑梗死早期血中miRNAs水平与脑侧支循环建立的关系
彭彬1,吴大玉2,孙家兰2,黄澍2,吴菲菲2,顾夏菊2,朱玮2,周飞2,李龙宣1
目的探讨急性脑梗死早期外周血清中miRNAs水平与侧支循环建立的关系及临床意义。方法选择2014年1月-2015年11月在我院住院的急性脑梗死患者,根据其脑侧支循环状况,分为侧支循环良好组(42例)与不良组(28例),另设31例健康体检者为对照。比较各组间一般临床资料及梗死早期血清中一组miRNAs的分子变化,并进一步用Logistic回归分析miRNAs水平与梗死患者侧支循环建立的关系。结果血清中抑制血管新生的MIR-15b、MIR-92a及促血管新生的MIR-126、MIR-132和MIR-210水平在侧支循环良好、不良组及对照组间存在差异表达,部分特异性miRNAs分子组间比较有显著性差异(P<0.05,P<0.01);Logistic回归显示,这些抑制或促血管新生的miRNAs,特别是促血管新生的MIR-126、MIR-132和MIR-210是急性脑梗死侧支循环建立好坏的影响因素。结论早期血清中一组特异性miRNAs分子可能作为一种预测急性脑梗死患者脑内侧支循环状况的便捷指标。
急性脑梗死;侧支循环;小分子RNA
缺血性脑卒中是一类严重危害人类健康的常见疾病,病死率、致残率一直居高不下。多项临床研究发现,脑内侧支循环/血管新生的建立和形成,影响着缺血性脑卒中的发生、发展、治疗与预后[1~3],因此,如何早期预测脑内侧支循环/血管新生状况,是制定后续治疗方案和判断预后的关键。虽然目前评价侧支循环的方法很多,如TCD、TCCD、CTA、MRA、MRP、DSA、SPECT和PET等,但上述检查存在费时、昂贵、有创伤、分辨率低或受条件限制等诸多因素影响,不能在临床上广为推广。因此,迫切需要在临床上筛选出一种/一组能早期、便捷、特异性预测脑内侧支循环状况的生物学标记物,以便用于判断预后及指导治疗。微小核糖核酸(micro-ribonucleic acids,miRNAs)是一种长度约为22个核苷酸的非编码单链RNA分子,通过介导信使RNA降解或转录抑制,从而调控蛋白质合成。研究发现,在血管内皮细胞和血管平滑肌细胞特异性表达的miRNAs,通过调控细胞增殖、分化、凋亡、应激反应等,在血管新生中发挥重要作用[4~6]。近期体内外实验表明,miR-126[7~9]、miR-210[10~12]和miR-132[13]有促血管新生作用,而miR-92[14]、miR-15/16[15,16]则抑制血管新生。临床研究显示,正常人血液中miRNAs含量较低,而在卒中患者的血样中miRNAs含量较高,甚至在卒中发生后几个月还可以检测到miRNAs表达的改变[12]。以上这些研究提示,血液中的miRNAs可能作为卒中后指导治疗、判断预后的新血液学标记物。那么,这些促进或抑制血管新生的miRNAs分子,在早期脑梗死中的表达情况如何?是否也参与调节脑梗死患者脑内侧支循环的建立与形成,并进而改善脑梗死患者神经功能缺损程度及减少脑梗死体积?弄清这些问题,对于临床筛查出早期预测性生物学指标具有重要意义,值得探讨。
1 资料与方法
1.1研究对象所有病例来自于2014年1月-2015年11月,在上海市浦东新区公利医院神经科住院的急性缺血性卒中患者。符合第四届全国脑血管病学术会议制定标准,并排除复发性脑梗死。患者均在发病24 h内入院,未服用他汀类、促红细胞生成素药物或2 m以上。均剔除急慢性感染、手术、创伤、严重肝肾功能不全、恶性肿瘤、结缔组织病、自身免疫病、先天性心脏病、急性心包炎、急性心肌炎、继发性高血压、心力衰竭、心瓣膜病、肺动脉栓塞以及存在酗酒、服用避孕药者。健康对照组来自我院同期健康体检者31例,与入选患者的年龄、性别等构成情况均衡可比。所有患者入院时尽快行头部CT扫描,于发病24~48 h内行MRI(包括MRI平扫与DWI)检查以明确诊断。根据2014年《中国急性缺血性脑卒中诊治指南》对患者进行诊治,患者入院后接受同一脑血管病专业治疗组的治疗。本研究获得公利医院伦理委员会批准,所有研究对象或其家属均签署知情同意书。
1.2方法
1.2.1神经功能缺损评分根据美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale Score,NIHSS)对患者进行神经功能缺失程度评分。
1.2.2脑血管DSA检查签署脑血管造影知情同意书,入院5 d时行DSA检查,采用改良的Seldinger技术穿刺股动脉,以5-F的Pigtail导管先行主动脉弓造影,观察弓上各大血管开口情况,然后以5-F的单弯导管分别行两侧颈总动脉、锁骨下动脉选择性脑血管造影。以4帧/s速率采集,充分显示动、静脉期的血管影像。按美国神经介入和治疗神经放射学会/介入放射学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology,ASITN/SIR)将侧支循环评估分级为:0级:没有侧支血流到缺血区域;1级:缓慢的侧支血流到缺血周边区域,伴持续的灌注缺陷;2级:快速的侧支血流到缺血周边区域,伴持续的灌注缺陷,仅有部分到缺血区域;3级:静脉晚期可见缓慢但是完全的血流到缺血区域;4级:通过逆行灌注血流快速而完全的灌注到整个缺血区域。0~1级视为侧支循环不良;2~4视为侧支循环良好[17]。
1.2.3梗死体积测定发病第5天时,患者在行DSA术后,复查头部CT,测定脑梗死灶体积,测量低密度灶的长宽厚3径,根据Pullicino提出的脑梗死灶体积计算方法:脑梗死灶体积(cm3)=长×宽×CT扫描阳性层数×π/6,如有数个病灶,其体积累加即为梗死总体积。
1.2.4RNA抽提和miRNAs表达检测在患者发病24 h内,抽取空腹外周静脉血6 ml置于EDTA抗凝管。按文献报道[18]的方法,用Trizol LS试剂(Ambion),按试剂操作说明抽提各样本血浆中总RNA,应用TaqMan microRNA Reverse Transcription kit(Applied Biosystems)按操作说明进行逆转录。通过qRT-PCR法测定miR-92、miR-15a、miR-15b、miR-16、miR-126、miR-210和miR-132的表达(TaqMan试剂盒,Applied Biosystems),内参选择U6。通过2-ΔΔCt法测定miRNAs相对表达量,每个受试者至少测定3次。
2 结 果
2.1一般情况与临床资料比较符合条件入组的急性脑梗死住院患者共70例,男性38例,女性32例,年龄33~82岁,平均(62.83±12.78)岁。其中,侧支循环良好的急性脑梗死患者42例,侧支循环不良者28例。另有31例健康体检者抽血行miRNAs分子水平检测,作为对照组。3组在年龄、性别构成、吸烟史、高血压病史、舒张压、高胆固醇血症、糖尿病史方面各组间与无显著性差别(P>0.05),而侧支循环良好组在收缩压、入院时NIHSS以及脑梗死体积方面与侧支循环不良组比较有显著性差别(P<0.05)(见表1)。
2.2血清miRNAs表达比较各组血清miRNAs的水平表示为与健康对照组的相对比值,健康对照组水平视为1。结果显示:侧支循环良好、不良急性脑梗死患者在MIR-15a、MIR-16的表达水平上无差异,而在MIR-15b、MIR-92a、MIR-126、MIR-132和MIR-210的表达上均有显著性差异(P<0.01)。其中,抑制血管新生的MIR-15b、MIR-92a,在侧支循环良好患者组显著低于不良组;而促血管新生的MIR-126、MIR-132和MIR-210,在侧支循环良好患者组显著高于不良组。与健康对照组相比,抑制血管新生的MIR-15b、MIR-92a表达水平,在侧支循环不良组显著上升(P<0.01),而在侧支循环良好组无明显差异。侧支循环良好组与不良组,血清中促血管新生的MIR-126、MIR-132、MIR-210均比健康对照组表达上调,但仅仅是侧支循环良好组与健康对照组间的差异有显著性(P<0.01)。
2.3多因素Logistic分析以有无良好的侧支循环为因变量,以表1中的观察指标miRNAs分子为自变量进行Logistic回归分析,剔除两组间无统计学差异的自变量MIR-15a、MIR-16,筛选脑梗死后侧支循环的影响因素,在修正年龄、性别、吸烟、高血压、糖尿病和高血脂症等可能的混杂因素后,结果显示:抑制血管新生分子MIR-15b、MIR-92a以及促血管新生分子MIR-126、MIR-132和MIR-210均是脑梗死后侧支循环建立的影响因素,MIR-15b、MIR-92a对侧支循环的建立呈负相关,而MIR-126、MIR-132和MIR-210呈正相关(见表2)。
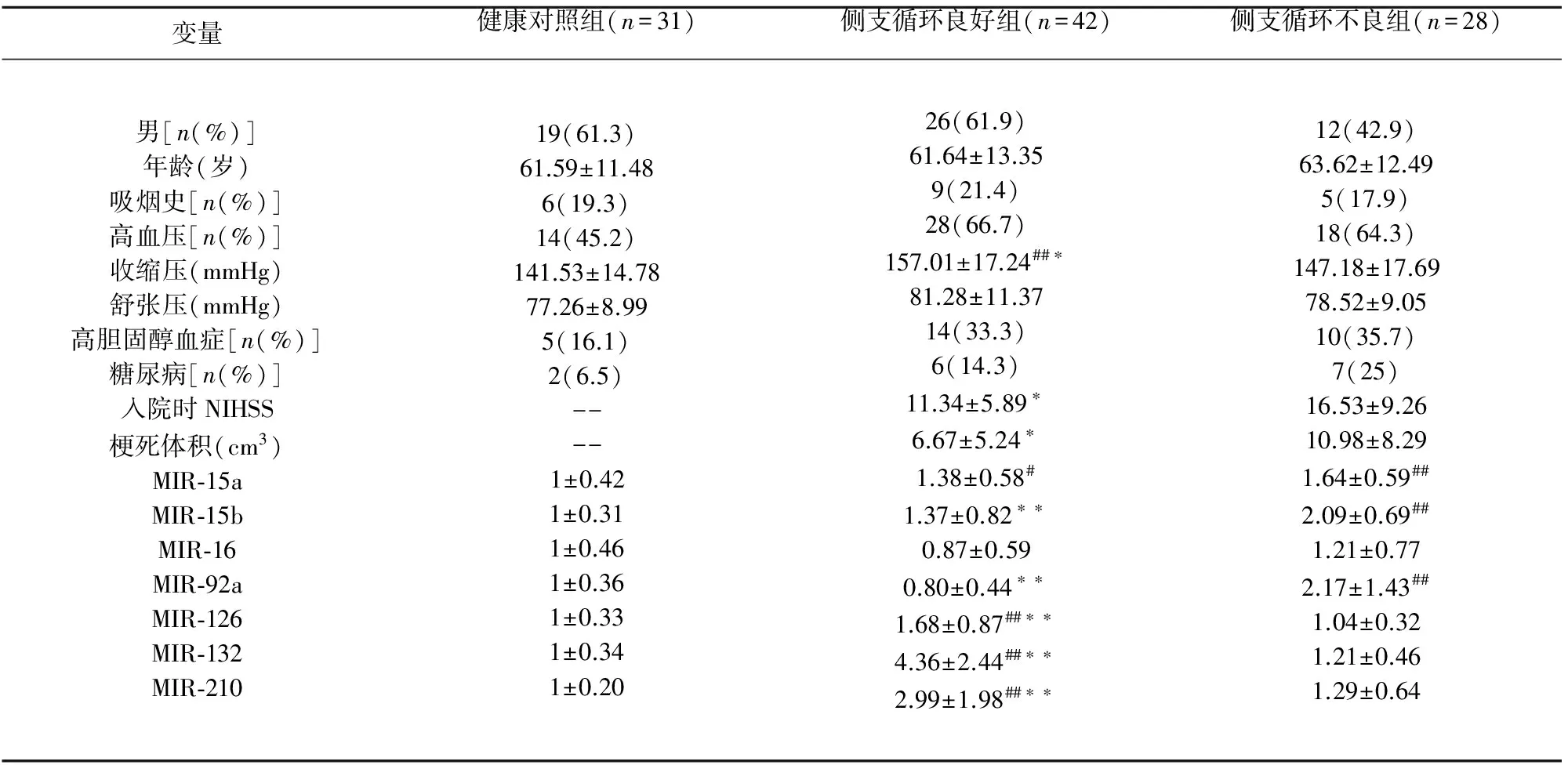
表1 3组样本临床资料及血清miRNAs的表达比较
注:数据为(均数±标准差)或率(%);NIHSS,National Institutes of Health Stroke Scales;与对照组比较#P<0.05,##P< 0.01;与侧支循环不良组比较*P<0.05,**P<0.01
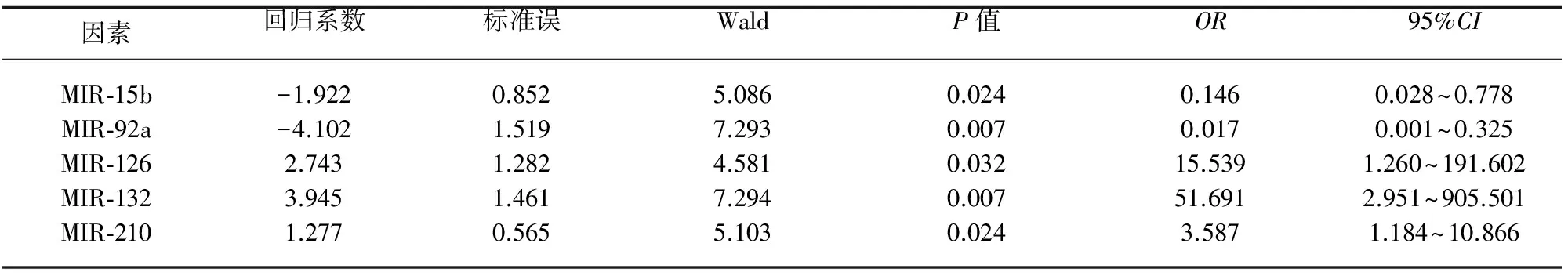
表2 影响脑梗死患者侧支循环的多因素Logistic分析
3 讨 论
本研究我们首次探讨了急性脑梗死患者血清中miRNAs水平与其脑内侧支循环建立的关系,发现梗死早期血清中miRNAs水平在侧支循环良好、不良脑梗死组以及健康对照组间存在差异表达;且脑梗死患者早期血清中相关miRNAs水平可在一定程度反映其脑梗死侧支循环建立的好坏。
3.1良好的侧支循环对急性脑梗死患者具有重要的保护作用资料显示,脑缺血后,微血管新生的范围和程度直接关系到半暗带血流改善,影响神经功能恢复,也决定预后[19]。缺血性卒中患者的临床表现和治疗效果存在很大差异,其关键影响因素之一就是侧支循环的存在。在本研究中,我们以侧支循环评估的金标准DSA,评价了急性脑梗死患者脑内侧支循环状况,根据侧支循环建立的好坏分为侧支循环良好组和不良组。结果发现,侧支循环良好的急性脑梗死患者入院时,神经功能缺损程度(即NIHSS评分)较侧支循环不良组明显较轻,且梗死体积明显较小。再次证实,侧支循环是维持脑功能正常活动的重要基础,良好的侧支循环对脑梗死患者具有重要保护作用。
3.2相关miRNAs水平是脑梗死侧支循环建立好坏的影响因素研究显示,一些miRNAs分子在血管新生信号通路中起正调节作用。体外与动物实验证实,血管内皮细胞特异性表达的miR-126在维持体内血管完整性和血管发育过程中起关键作用,还有促血管形成作用[8,9]。而对缺氧反应最敏感的miR-210上调是缺氧刺激引起内皮细胞增殖、迁移和分化的关键因素[11]。重要的是脑缺血患者血液中可检测出miR-210,并发现脑卒中患者miR-210水平越低,预后越差[12]。此外还发现,miR-132是调节血管生长的开关和血管内皮细胞活化的标志分子[13]。而另外一些miRNAs分子则在血管新生中起抑制作用。内皮细胞中miR-92a过度表达可阻碍血管新生;而miR-15/16分子则可损害健康循环促血管新生细胞的生存与迁移,提示miR-15/16也在血管新生中具有抑制作用。但是,上述miRNAs分子与脑梗死患者侧支循环的关系如何,以及血液中miRNAs的变化能否反应脑内侧支循环的状况,均未见报道。本研究中,我们探讨了急性脑梗死早期血中miRNAs水平与侧支循环建立的关系,发现与侧支循环不良组比较,侧支循环良好的梗死患者早期血清抑制血管新生的MIR-15b、MIR-92a水平明显降低,而促血管新生的MIR-126、MIR-132和MIR-210则明显升高。由于高血压、高脂血症、糖尿病、吸烟等缺血性脑卒中危险因素都可影响侧支循环的建立,因此我们修正了年龄、性别、吸烟、高血压、糖尿病和高血脂症等可能的混杂因素的影响,发现脑梗死患者血清抑制血管新生的MIR-15b、MIR-92a以及促血管新生的MIR-126、MIR-132和MIR-210仍是脑梗死侧支循环建立好坏的影响因素,分别呈负向和正向相关。
3.3血清miRNAs分子可能作为预测梗死患者侧支循环状况的标记物在本研究中,我们还同时比较观察了脑梗死早期血清miRNAs水平与健康对照组之间的差别,结果显示,与健康对照组相比,侧支循环不良组抑制血管新生的MIR-15b、MIR-92a水平明显上升,这可能是其侧支循环建立不良的原因之一;侧支循环良好组与不良组血清促血管新生的MIR-126、MIR-132、MIR-210均比健康对照组表达上调,且侧支循环良好组与健康对照组间的差异有显著性,提示,急性脑梗死患者体内促血管新生的miRNAs分子水平增加有助于脑侧支循环的建立,较高水平的促血管新生的miRNAs分子表达可能是侧支循环建立的必要条件。我们还注意到,侧支循环良好组抑制血管新生的MIR-15b、MIR-92a水平与对照组无明显差异,而促血管新生的MIR-126、MIR-132、MIR-210水平则明显增加,提示促血管新生的miRNAs水平增加可能在促进脑梗死患者侧支循环建立中居于主导地位。
综上所述,脑梗死患者体内表达的抑制或促进血管新生的miRNAs分子,特别是促血管新生的MIR-126、MIR-132和MIR-210是脑梗死侧支循环建立好坏的影响因素。梗死早期检测血清中上述miRNAs水平检测有助于间接反应脑梗死患者脑内侧支循环的状况;通过对表达发生改变的特异性miRNAs进行调控,即降低有害miRNAs表达而增加有益miRNAs表达可达到治疗目的,有望为临床卒中的治疗开启一条新途径。
[1]Bang OY,Saver JL,Kim SJ,et al.Collateral flow predicts response to endovascular therapy for acute ischemic stroke[J].Stroke,2011,42(3):693-699.
[2]hristoforidis GA,Karakasis C,Mohammad Y,et al.Predictors of hemorrhage following intra-arterial thrombolysis for acute ischemic stroke:the role of pial collateral formation[J].AJNR Am J Neuroradiol,2009,30(1):165-170.
[3]Lima FO,Furie KL,Silva GS,et al.The pattern of leptomeningeal collaterals on CT angiography is a strong predictor of long-term functional outcome in stroke patients with large vessel intracranial occlusion[J].Stroke,2010,41(10):2316-2322.
[4]Katoh M.Therapeutics targeting angiogenesis:genetics and epigenetics,extracellular miRNAs and signaling networks(Review) [J].Int J Mol Med,2013,32(4):763-767.
[5]Finn NA,Searles CD.Intracellular and extracellular miRNAs in regulation of angiogenesis signaling[J].Curr Angiogenes,2012,4(102):299-307.
[6]Yin KJ,Hamblin M,Chen YE.Angiogenesis-regulating microRNAs and Ischemic stroke[J].Curr Vasc Pharmacol,2015,13(3):352-365.
[7]Nikolic I,Plate KH,Schmidt MH.EGFL7 meets miRNA-126:an angiogenesis alliance[J].J Angiogenes Res,2010,2(1):9.
[8]Fish JE,Santoro MM,Morton SU,et al.miR-126 regulates angiogenic signaling and vascular integrity[J].Dev Cell,2008,15(2):272-284.
[9]Ebrahimi F,Gopalan V,Smith RA,et al.miR-126 in human cancers:clinical roles and current perspectives[J].Exp Mol Pathol,2014,96(1):98-107.
[10]Giannakakis A,Sandaltzopoulos R,Greshock J,et al.miR-210 links hypoxia with cell cycle regulation and is deleted in human epithelial ovarian cancer[J].Cancer Biol Ther,2008,7(2):255-264.
[11]Fasanaro PD,Alessandra Y,Di Stefano V,et al.MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand Ephrin-A3[J].J Biol Chem,2008,283(23):15878-15883.
[12]Tan KS,Armugam A,Sepramaniam S,et al.Expression profile of MicroRNAs in young stroke patients[J].PLoS One,2009,4(11):e7689.
[13]Anand S,Majeti BK,Acevedo LM,et al.MicroRNA-132-mediated loss of p120RasGAP activates the endothelium to facilitate pathological angiogenesis[J].Nat Med,2010,16(8):909-914.
[14]Bonauer A,Carmona G,Iwasaki M,et al.MicroRNA-92a controls angiogenesis and functional recovery of ischemic tissues in mice[J].Science,2009,324(5935):1710-1713.
[15]Spinetti G,Fortunato O,Caporali A,et al.MicroRNA-15a and microRNA-16 impair human circulating proangiogenic cell functions and are increased in the proangiogenic cells and serum of patients with critical limb ischemia[J].Circ Res,2013,112(2):335-346.
[16]Yin KJ,Olsen K,Hamblin M,et al.Vascular endothelial cell-specific MicroRNA-15a inhibits angiogenesis in hindlimb ischemia[J].J Biol Chem,2012,287(32):27055-27064.
[17]Bang OY,Saver JL,Buck BH,et al.Impact of collateral flow on tissue fate in acute ischaemic stroke[J].J Neurol Neurosurg Psychiatry,2008,79(6):625-629.
[18]Long G,Wang F,Duan Q,et al.Circulating miR-30a,miR-195 and let-7b associated with acute myocardial infarction[J].PLoS One,2012,7(12):e50926.
[19]Arai K,Jin G,Navaratna D,et al.Brain angiogenesis in developmental and pathological processes:neurovascular injury and angiogenic recovery after stroke[J].FEBS J,200,276(17):4644-4652.
The correlation between miRNAs levels and collateral pathway in the patients with acute cerebral infraction
PENGBin,WUDayu,SUNJialan,etal.
(DepartmentofSino-FrenchCooperativeCentralLab;DepartmentofNeurology,GongliHospital,PudongNewArea,Shanghai200135,China)
ObjectiveTo investigate the correlation and the clinical significance between the micro-ribonucleic acids (miRNAs) levels and collateral pathway in the patients with acute cerebral infraction.MethodsPatients with acute cerebral infraction during the period from January 2014 to November 2015 in our hospital were enrolled in the study.Seventy patients were divided into two groups according to their collateral status,that is,Good Collaterals and Poor Collaterals,and 31 healthy cases were chosen as Controls.Multivariate models were generated to determine the contribution of demographic,clinical and serum pro-and anti-angiogenesis miRNAs variables in the early stage of infarction between the groups.ResultsThere were significant differences in some of the serum pro-and anti-angiogenesis miRNAs levels between the Good Collaterals,Poor Collaterals and the Controls (P<0.05 orP<0.01).And the Logistic regression showed that the specific pro-and anti-angiogenesis miRNAs,especially the pro-angiogenesis miRNAs such as MIR-126,MIR-132 and MIR-210 were significantly associated with the collateral status in the patients with acute cerebral infraction.ConclusionSome specific serum miRNAs levels in the early stage of acute cerebral infraction can be used as predictors in a fast,convenient,and reliable fashion for the cerebral collateral status following ischemic stroke.
Acute cerebral infarction;Collateral pathway;MicroRNAs
1003-2754(2016)02-0100-04
2015-12-04;
2016-01-29
国家自然科学基金面上项目(No.81171244;No.81571203);上海市自然科学基金项目(No.15ZR1437200);上海市浦东新区卫生系统重点学科建设资助(No.PWZx2014-08);上海市浦东新区卫生系统领先人才培养计划(No.PWR12014-05);上海市浦东新区科技发展基金(No.PKJ2014-Y21);上海市医学重点专科建设计划项目(No.ZK2015B16)
(1.上海市浦东新区公利医院中法合作中心实验室,上海 浦东 200135;2.上海市浦东新区公利医院神经科,上海 浦东 200135)
李龙宣,E-mail:Longxuanlee30@aliyun.com
R743.3
A
