超微血流成像(SMI)技术诊断颈动脉斑块新生血管1例报告
2016-11-12王丽娟周杨杨邢英琦
陈 盈, 王丽娟, 周杨杨, 邢英琦
超微血流成像(SMI)技术诊断颈动脉斑块新生血管1例报告
陈盈,王丽娟,周杨杨,邢英琦
脑梗死的发生与动脉粥样硬化斑块关系密切,但起决定作用的多非粥样斑块引起的管腔狭窄,而是粥样斑块的性质。易损斑块破裂继发血栓形成及破溃脱落的血栓碎片导致栓塞才是脑梗死发生最重要的病理基础。有研究发现,斑块内新生血管形成可以诱发斑块内出血和斑块破裂,与斑块的易损性密切相关。目前评估斑块内新生血管的主要方法是超声对比增强造影成像(contrast-enhanced ultrasound,CEUS)技术,通过增强血流及组织回声的对比分辨力来判断斑块内新生血管的情况,但CEUS是有创检查,操作复杂,费用较高,且存在风险。超微血流成像(Superb Microvascular Imaging,SMI)是一种全新的血流成像技术,应用新的自适应算法来鉴别并移除组织运动杂乱信号,显示真正的低速血流,可以在不使用造影剂的条件下清晰显示斑块内新生血管,克服了斑块造影的缺点,无创、简便、价廉、可重复操作。现将1例脑梗死患者应用SMI技术评估易损斑块内新生血管形成,取得良好效果,报道如下。
1 临床资料
患者,男,46 岁,因右侧肢体活动不灵6 d,加重3 d入院。患者入院前6 d无明显诱因自感右侧肢体发沉,在当地治疗未见明显缓解,且上述症状进行性加重,逐渐出现走路困难。患者既往于2012年曾患“脑梗死”,主要表现为右下肢活动差,经治疗,未遗留后遗症;12 y前心肌梗死病史;吸烟30余年,平均20支/d,至今未戒烟。入院查体:血压138/72 mmHg(左侧),血压140/79 mmHg(右侧),心率59次/min,神清语明,脑神经检查未见异常,右侧肢体肌力4级,左侧肢体肌力5级,四肢肌张力正常,腱反射正常,右侧共济查体正常,深浅感觉未见明显异常。右侧Babinski征及Chaddock征阳性,左侧Babinski征及Chaddock征阴性,无项强,克氏征阴性。血脂:甘油三酯1.83 mmol/L(0.28~1.80),低密度脂蛋白胆固醇:5.84 mmol/L(2.06~3.10);同型半胱氨酸:113.20 μmol/L(0~20);叶酸测定:2.32ng/ml(3.1~19.9)。头部核磁DWI像:左侧额颞叶内分水岭区串珠样多发新鲜梗死灶(见图1)。颈动脉超声:双侧颈部动脉斑块形成(多发),右侧颈内动脉起始段管径狭窄(<50%),右侧椎动脉开口处管径狭窄(50%~69%),左侧颈内动脉起始处管径狭窄(70%~99%)(见图2)。经颅多普勒超声:左侧颈内动脉发出眼动脉之前重度狭窄,侧支情况:左侧后交通开放、左侧颈外动脉到左侧颈内动脉侧支开放。SMI:左侧导致颈内动脉重度狭窄的斑块顶部延至核心区可见散在树枝状新生血管形成(见图3 )。微栓子监测:左侧大脑中动脉监测30 min监测到10个微栓子信号(见图4),证实左侧颈动脉粥样硬化斑块不稳定,存在动脉到动脉栓塞。心电图:窦性心律,多发多源室性期前收缩。心脏彩超:左室增大,室壁节段性运动异常,左室舒张功能减低,二尖瓣轻度返流。临床诊断为:脑梗死(左侧额颞叶)、脑动脉狭窄、高脂血症、高同型半胱氨酸血症、低叶酸血症、冠状动脉粥样硬化性心脏病、陈旧性下壁心肌梗死、心律失常-多发多源室性期前收缩、心功能II级。给予改善循环、抑制血小板聚集、强化降脂稳定斑块,营养神经治疗,患者症状好转后出院。
2 讨 论
本例患者为中年男性,既往有脑梗死、心肌梗死病史,存在吸烟、高脂血症、高同型半胱氨酸血症、低叶酸血症诸多动脉粥样硬化危险因素,此次发病以进展性卒中为主要表现。颈动脉超声提示患者左侧颈内动脉起始处重度狭窄,头部核磁DWI像可见左侧额颞叶内分水岭区多发串珠状高信号影。对于颈动脉狭窄后导致缺血性卒中发生的机制,目前研究认为主要的就是脑血流低灌注、动脉到动脉栓塞的存在,及二者的协同作用后致栓子清除能力的下降。我们在分析该患者进展性卒中的发病机制时,首先明确其左侧颈内动脉起始处重度狭窄后会导致远端的低灌注,核磁DWI像左侧额颞叶存在散在新鲜梗死灶,微栓子监测左侧大脑中动脉监测30监测到10个微栓子信号,证实其存在动脉到动脉栓塞,所有的证据都指向了导致颈动脉狭窄的斑块是易损斑块,有栓子不断脱落,导致了患者进展性卒中的发生。我们从普通颈动脉超声上单纯依靠斑块的回声,纤维帽是否完整,并不能准确的判断易损斑块,Coli等[1]的研究显示普通颈动脉超声上斑块回声与组织学之间没有很好的相关性。目前研究显示斑块内新生血管的形成与斑块稳定性及临床症状的出现密切相关,并且经过了病理组织学的证实[2~4]。本病例中我们没有应用传统的CEUS技术诊断斑块内新生血管,而是应用最新的SMI技术清楚的显示了斑块内新生血管,证实了斑块的易损性,清晰的阐述了患者的发病机制,完成了卒中患者的危险性分层。
正常情况下动脉的滋养血管(vasa vasorum)供应动脉外膜部分,动脉内膜由管腔内弥散而来的氧滋养。随着动脉粥样硬化的形成和发展,动脉的内中膜增厚,超过了血液中氧弥散的极限(一般是250~500 μm)引起局部缺血,由此触发动脉内皮细胞释放细胞因子,诱导新生血管的形成。新生血管由简单内皮细胞围成,缺少平滑肌细胞和完整的基底膜,细胞间隙大,因而管腔内的细胞成分容易渗出,炎性基质及炎症细胞容易通过并沉积在内中膜处的细胞外基质内,使斑块进一步增大,不断沉积的细胞外基质更加减少了来自管腔内氧的弥散量,进一步刺激了新生血管形成。新生血管引起斑块不稳定的原因在于:(1)新生血管的内皮细胞释放更多的粘附因子,从而粘附更多的淋巴细胞[5];(2)新生血管较脆弱,易破裂出血,这一方面使斑块进一步增大,另一方面可导致更多的巨噬细胞浸润及斑块中央坏死内核的增大[6]。Babot等[7]的研究显示已经破裂的斑块中新生血管密度最高可达稳定性斑块的4倍,而易损斑块中新生血管密度也明显增加为稳定性斑块的2倍。在巨噬细胞浸润明显的纤维帽、脂质富集区、炎症活跃区等部位可以见到较多的新生血管。
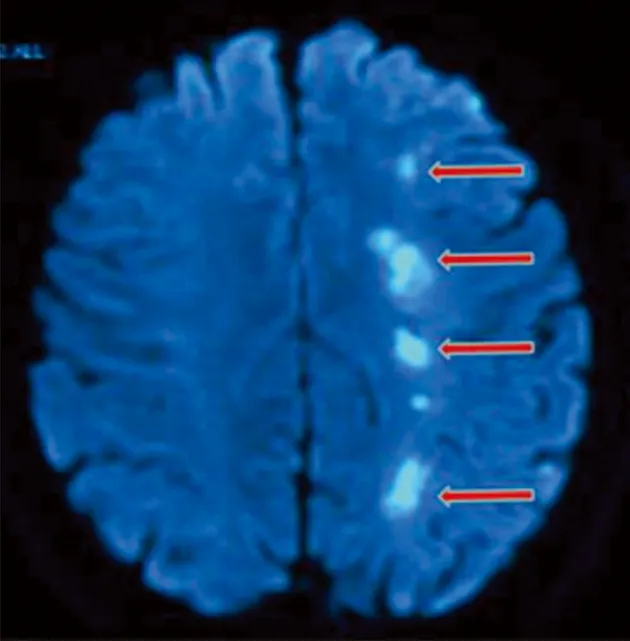
图1头部核磁弥散加权成像(DWI)显示左侧额颞叶内分水岭区串珠样多发高信号影(箭头)

图2 颈动脉超声图像:左侧颈内动脉起始处重度狭窄(箭头)
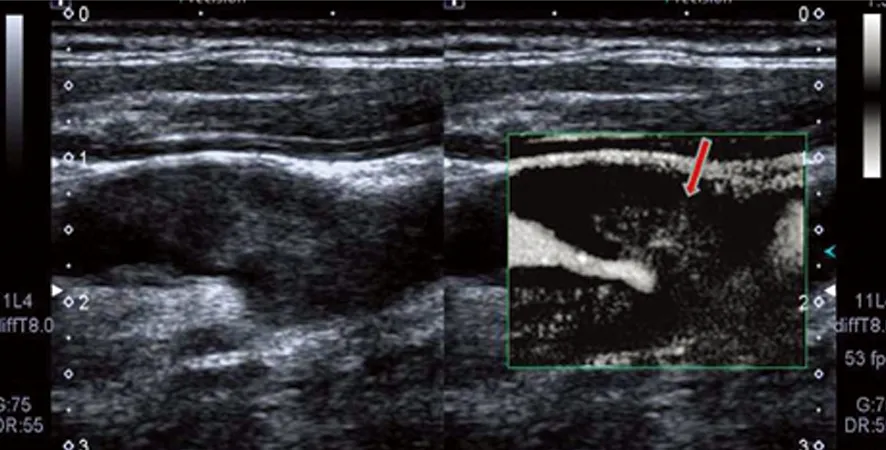
图3颈动脉斑块超微血流成像显示:左侧导致颈内动脉重度狭窄的斑块顶部延至核心区可见散在树枝状新生血管形成(箭头)
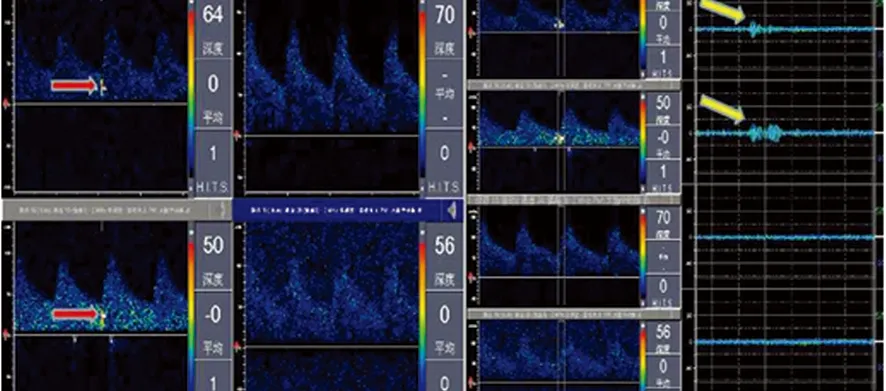
图4微栓子监测示:左侧大脑中动脉不同深度范围内30 min监测到10个微栓子信号(红色箭头);时间窗信号图呈典型纺锤形(黄色箭头),证实栓子来源是左侧颈内动脉
Fleiner等[8]对比了22例有症状和无症状的动脉粥样硬化患者,发现有症状组较无症状组斑块内有丰富的新生血管。Mccarthy等[9]的研究结果显示有症状组的新生血管明显多于无症状组,且有症状组的新生血管更大,形态更不规则,斑块内的新生血管与斑块内出血及斑块破裂之间相关。Moreno等[10]研究了269例动脉粥样硬化的主动脉标本,采用免疫组织化学法对斑块内的微血管密度进行量化,结果显示斑块内微血管的增多与斑块破裂有关,斑块破裂组的微血管密度高于未破裂组,另外,在斑块内有明显的巨噬细胞浸润及斑块内出血时斑块内的微血管密度也明显增高。
斑块内新生血管形成与斑块易损性密切相关,对新生血管评估的金标准是病理学的免疫组织化学法,而对每个斑块都进行病理学检测显然是不现实的。目前公认有效相对简便的评估方法是CEUS技术,其通过增强血流及组织回声的对比分辨率来判断斑块内新生血管的情况,与病理组织学得到了很好的相关性分析结果。但CEUS技术需要静脉注射造影剂是有创检查,存在过敏风险及肾功能耐受等问题并且费用较高,SMI技术则可以克服上述缺点,在不使用造影剂的条件下清晰显示斑块内新生血管,经本病例证实在评估斑块易损性方面,SMI与微栓子监测及核磁成像上的新发梗死灶间均显示了很好的相关性。总体来说,SMI是一项全新的技术,对斑块内新生血管的判断具有明显的优势,在斑块易损性的评估上有着广泛的应用前景,未来将对颈动脉粥样硬化疾病防治策略的制定及预防脑梗死的发生产生深远的影响。
[1]Coli S,Magnoni M,Sangiorgi G,et al. Contrast-enhanced ultrasound imaging of intraplaque neovascular- ization in carotid arteries:correlation with histology and plaque echogenicity[J]. J Am Coll Cardiol,2008,52(3):223-230.
[2]Dunmore BJ,McCarthy MJ,Naylor AR,et al. Carotid plaque instability and ischemic symptoms are linked to immaturity of microvessels within plaques[J]. J Vasc Surg,2007,45(1):155-159.
[3]Giannoni MF,Vicenzini E,Citone M,et al. Contrast Carotid Ultrasound for the Detection of Unstable Plaques with Neoangiogenesis:A Pilot Study[J]. Eur J Vasc Endovasc Surg,2009,37(6):722-727.
[4]Saito K,Nagatsuka K,Ishibashi-Ueda H,et al. Contrast-Enhanced Ultrasound for the Evaluation of Neovascularization in Atherosclerotic Carotid Artery Plaques[J]. Stroke,2014,45(10):3073-3075.
[5]O’Brien KD,McDonald TO,Chait A,et al. Neovascular expression of E-selectin,intercellular adhesion rnolecule-1,and vascular cell adhesion molecule-1 in human atherosclerosis and the irrelation to intimal leukoeyte content[J]. Circulation,1996,15;93(4):672-682.
[6]Kolodgie FD,Gold HK,Burke AP,et al. Intraplaque hemorrhage and Progression of coronary atheroma[J]. N Engl J Med,2003,349(24):2316-2325.
[7]Juan-Babot JO,Martínez-González J,Berrozpe M,et al. Neovascularization in human coronary arteries with lesions of different severity[J]. Rev Esp Cardiol,2003,56(10):978-986.
[8]Fleiner M,Kummer M,Mirlaeher M,et al. Arterial neovascularization and inflammation in vulnerable Patients:early and late signs of symptomatic atheroselerosis[J]. Circulation,2004,110(18):2843-2850.
[9]McCarthy MJ,FRCS,Loftus IM,et al. Angiogenesis and the atherosclerotic carotid plaque:An association between symptomatology and plaque morphology[J]. J Vasc Surg,1999,30(2):261-268.
[10]Moreno P,Purushothaman K. Plaque Neovascularization Is Increased in Ruptured Atherosclerotic Lesions of Human Aorta Implications for Plaque Vulnerability[J]. Circulation,2004,110(14):2032-2038.
1003-2754(2016)05-0466-02
R445;R743
2016-01-10;
2016-03-10
(吉林大学白求恩第一医院神经内科头颈血管超声中心,吉林 长春 130021)
邢英琦,E-mail:xingyq@sina.com
