磁共振成像评价去铁酮、氯碘羟喹对大鼠脑出血后铁超载的干预效果
2016-11-12韩健鹏王改青甄俊平
韩健鹏, 王改青, 胥 毅, 甄俊平
磁共振成像评价去铁酮、氯碘羟喹对大鼠脑出血后铁超载的干预效果
韩健鹏1,王改青1,胥毅2,甄俊平2
目的比较去铁酮、氯碘羟喹对大鼠脑出血模型铁含量及脑水肿的干预效果。方法将24只Wistar大鼠随机分为假手术组、脑出血(ICH)组、去铁酮组、氯碘羟喹组,大鼠右侧纹状体区注入胶原酶IV 0.4 U、肝素钠4 U制作脑出血模型。术后6 h开始灌胃干预组分别给予去铁酮[125 mg/(kg·次),1 次/12 h]、氯碘羟喹[50 mg/(kg·次),1次/12 h],假手术组和脑出血组给予等量溶剂。并于术后1 d、3 d、7 d、14 d各时间点行神经功能学行为评分,通过ESWAN评估病灶铁含量、T2*WI评估血肿体积、T2WI评估血肿周围水肿体积,14 d处死大鼠行脑组织铁染色。结果脑出血1 d后即出现神经功能缺损以1~3 d最重。14 d与假手术组无明显差别。与此相似,MRI显示血肿周围脑水肿体积以1~3 d最明显,7~14 d与假手术组无显著差别。MRI同时显示出血后脑铁含量增加,以7~14 d最明显,其后逐渐消退。氯碘羟喹可改善大鼠神经功能缺损,以第3~7 d最明显,可减少出血后3 d血肿周围水肿及3~7 d血肿周围脑组织铁含量,而去铁酮干预显著减轻脑出血后3~7 d铁含量,血肿周围水肿体积未见明显减少、神经功能缺损未见明显改善。结论MRI显示脑出血后1~3 d血肿周围水肿体积、7~14 d脑铁含量较对照组显著增加,去铁酮、氯碘羟喹均可降低脑铁含量,氯碘羟喹可降低出血后3d血肿周围水肿体积,改善出血后3~7 d神经功能缺损。
脑出血;去铁酮;氯碘羟喹;磁共振成像;脑水肿;铁含量
脑出血是脑卒中重要亚型,病死率、致残率居高不下。脑出血后病理生理机制尚未完全阐明,其中铁离子作为血红蛋白重要代谢产物,可介导脂质、蛋白质和DNA氧化损伤而加重脑损害[1~3]。多数研究采用铁超载作为药物干预靶点,其中去铁胺使用较多。实验证实去铁胺在大鼠全血脑出血模型中的神经保护作用[1]。去铁酮临床去铁疗效确切,具有口服易吸收、血脑屏障通透性高[4]、价格低廉等特点,有望替代去铁胺治疗。而二价铁螯合剂氯碘羟喹可恢复神经退行性疾病脑内铁水平,逆转神经萎缩,神经保护作用已显现[5]。本课题组前期从脑内铁代谢相关蛋白表达[2,4]、铁介导的氧化损伤[5]方面考察上述两种药物脑出血干预效果。MRI作为一种无创、活体、动态、多参数定量工具[6],已广泛用于脑出血研究。目前尚未有MRI方面铁螯合剂效果评价相关文献报道。本实验旨在从MRI角度动态观察去铁酮、氯碘羟喹对血肿大小、脑水肿、铁含量及神经功能的影响。
1 材料及方法
1.1模型制备选取3月龄雄性Wistar大鼠24只,体重250~300 g,由山西医科大学动物实验中心提供。标准饲料喂养和自由饮水,室内温度20~25 ℃,湿度适中。采用随机数字表法,分为4组:假手术组、脑出血组、去铁酮组、氯碘羟喹组,每组再分为1 d、3 d、7 d、14 d 4个亚组,每亚组6只。大鼠称重后腹腔注射5%水合氯醛(0.8 ml/100 g体重),麻醉程度适宜后将大鼠俯卧位固定于立体定位仪上实施手术。头正中纵行切开长约1 cm手术切口,充分暴露前囟,将针头固定在立体定位仪(深圳瑞沃德)上,参照Fan等[7]的方法调整坐标为前囟后0.2 mm,矢状缝右侧旁开3.0 mm,标记后钻孔,抽取配制的药物:胶原酶IV(美国Sigma) 0.2 U/μl+肝素钠2 U/μl共2μl后再次固定微量注射器(上海高鸽),缓慢进针深度为5.5 mm,药物在5 min内注射完毕,停留10 min后缓慢退针防止药液溢出,用骨蜡封闭钻孔,局部消毒,缝合皮肤,做好标记后回笼饲养。假手术组同之前麻醉、固定、切开、定位、钻孔、进针、退针、缝合等步骤,不同的是不注入药物。因氯碘羟喹(武汉鸿信康)、去铁酮(加拿大奥贝泰克)分别为脂溶性、水溶性药物,配制时用1%羧甲基纤维素钠生理盐水溶液2 ml作为溶剂。术后6 h开始灌胃干预组分别给予去铁酮(125 mg/(kg·次),1次/12 h)、氯碘羟喹[50mg/(kg·次),1次/12 h]。假手术组和脑出血组灌胃等量溶剂。
1.2行为学评分术后1 d大鼠Rosenberg评分[8]达到1级以上,且MRI扫描示大鼠纹状体区局灶性圆形或类圆形的出血灶则认为造模成功,如无明显神经功能缺损或MRI上血肿破入脑室的大鼠予以剔除。脑出血组麻醉时及术后7 d大鼠各死亡1只,氯碘喹组术后死亡1只,均再次造模补足数量。按Garcia 等的方法[9]在术后1 d、3 d、7 d和14 d等相应时间点行神经功能障碍程度评分。
1.3MRI检查利用我院影像科Signa 1.5T HDXMRI设备、膝关节线圈对各组别各时间点的大鼠成像。腹腔注射水合氯醛麻醉大鼠后,将其俯卧置于膝关节线圈中,用三维扫描成像序列定位大鼠在磁体中的坐标。扫描序列包括T1WI 、T2WI 、T2*WI、ESWAN序列。T1WI、T2WI采用快速自旋回波序列,T2*WI采用梯度自旋回波序列。参数如下:(1)FSE T1WI:TR:580 ms,TE:25.5 ms,FOV:18.0 mm,phase FOV:0.6,层厚:2.0 mm,间隔:0.2 mm,矩阵:512×448,激励次数:6。(2)FSE T2WI:TR:2380 ms,TE:127.7 ms,FOV:18.0 mm,phase FOV:0.6,层厚:2.0 mm,间隔:0.2 mm,矩阵:512×448,激励次数:8。FOV:16.0,phase FOV:0.6。(3)T2*WI:TR:400 ms,TE:15 ms,层厚:2.0 mm,间隔:0.2 mm,矩阵:448×384,翻转角:15°,激励次数:4。(4)ESWAN:TR:49.5 ms,层厚:21.5 mm,矩阵:448×448,翻转角:15°,激励次数:4,FOV:18.0,phase FOV:0.75。
1.4血肿体积、水肿体积测定参照Jack等[10]的方法,在T2*WI测量血肿病灶各层面的长径A 、宽径 B,取3次测量平均值,按公式:∏/6×A×B计算出各个层面病灶面积,各层面积之和乘以血肿层数、层厚即为血肿体积。类似方法计算T2WI序列上血肿+水肿带的体积,两者相减得到水肿体积。不同时间点各序列血肿及周围组织信号的变化特征由两名经验丰富神经科医师描述提供,均对实验设计不知情。
1.5铁含量测定扫描结束后,将数据传送至MRI后处理工作站中,利用Functool软件包处理ESWAN序列获得幅度图、相位图。采用盲法,由1位有MRI诊断经验的医师选取感兴趣区最清楚的层面并勾画出其边界、测量数值。3次测量的平均值作为最终幅度值,因其数值分散,故取幅度log值进行比较。
1.6铁染色脑组织后半部分切成层厚2 mm的薄片,放入4%多聚甲醛中4 ℃过夜,之后入30%蔗糖溶液脱水直至脑组织沉底,行25 μm冰冻切片,入20%亚铁氰化钾5 ml、浓盐酸0.9 ml组成的工作液浸染30 min,蒸馏水洗涤2次每次3 min,伊红水溶液复染20 s,再次入蒸馏水水洗3次(同上),常规脱水,透明中性树胶封片。显微镜(10×40)下随机选取血肿周围不重叠视野,照相后利用image J软件分析计算每只大鼠脑片铁沉积颗粒面积。

2 结 果
2.1行为学评分脑出血组及两个干预组在术后1~14 d的神经功能缺损评分显著低于各相应时点的假手术组(P<0.05),且4组均呈现相同的趋势,以术后1~3 d神经功能缺损最重;与脑出血组比较,氯碘羟喹干预脑出血可显著改善大鼠神经功能,以3~7 d最明显,14 d与脑出血组无明显差别。去铁酮干预组神经功能缺损未见明显改善(见表1)。
2.2脑血肿体积的比较T2*WI上脑出血后第1 d血肿体积最大,之后血肿逐渐吸收缩小。干预组血肿体积与脑出血组差异无统计学意义,即去铁酮、氯碘羟喹对血肿演变无影响。两个干预组间各时间点血肿体积无显著差异(见表2、图1)。
2.3脑水肿体积测定与假手术组相比,T2WI上脑出血组脑水肿体积在脑出血后1 d即显著升高,术后1~3 d最显著,随后逐渐下降,7~14 d无显著差别。两组干预组脑水肿体积变化与脑出血组呈现相同趋势,但在脑出血后给予氯碘羟喹干预可显著减少3~7 d脑水肿体积,且去铁酮干预与ICH组比较无统计学差异(见表3、图2)。
2.4脑组织含铁量测定ESWAN序列显示脑出血后血肿区幅度log值逐渐降低,即铁沉积逐渐增多,术后3~7 d最明显,第14 d达峰值;与脑出血组比较,干预组各时点大鼠的幅度log值均显著高于对照组,铁沉积明显较少,以3~7 d减少最明显。两个干预组间比较差异无统计学意义(见表4、图3)。
2.5铁染色中血肿周围铁离子沉积测定14 d处死大鼠行脑组织学铁染色,脑出血组、去铁酮组、氯碘羟喹组血肿周围铁离子沉积量分别为52.43±1.52、24.88±1.01、27.84±3.11,均显著高于假手术组,两个干预组铁含量均低于脑出血组,提示铁螯合剂可减轻脑铁含量,而干预组间铁颗粒面积无统计学差异(见图4)。
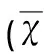
表1 不同时间点行为学评分的比较±s,n=6)
与假手术组比较#P<0.05;与脑出血组比较*P<0.05;与去铁酮组比较&P<0.05;与同组前一时间点比较△P<0.05
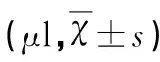
表2 T2*WI序列测量的脑血肿体积的比较
与同组前一时间点比较△P<0.05
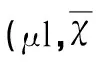
表3 T2WI序列测量的脑水肿体积的比较±s)
与假手术组比较#P<0.05;与脑出血组比较*P<0.05;与去铁酮组比较&P<0.05;与同组前一时间点比较△P<0.05
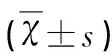
表4 ESWAN序列幅度log值的比较
与假手术组比较#P<0.05;与脑出血组比较*P<0.05;与去铁酮组比较&P<0.05;与同组前一时间点比较△P<0.05
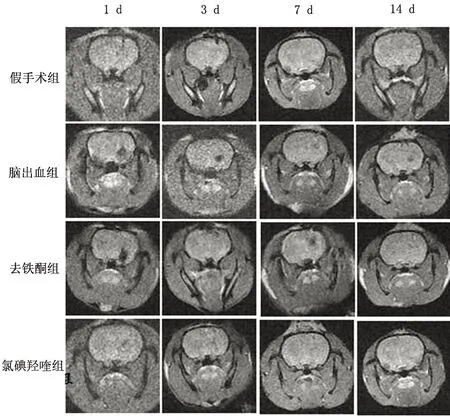
在T2*加权上1 d血肿表现为低信号,而3~7 d图像表现为相对低信号,内部混杂少许高信号,14 d呈低信号
图1T2*WI序列显示各组大鼠相应时点脑血肿及其演变
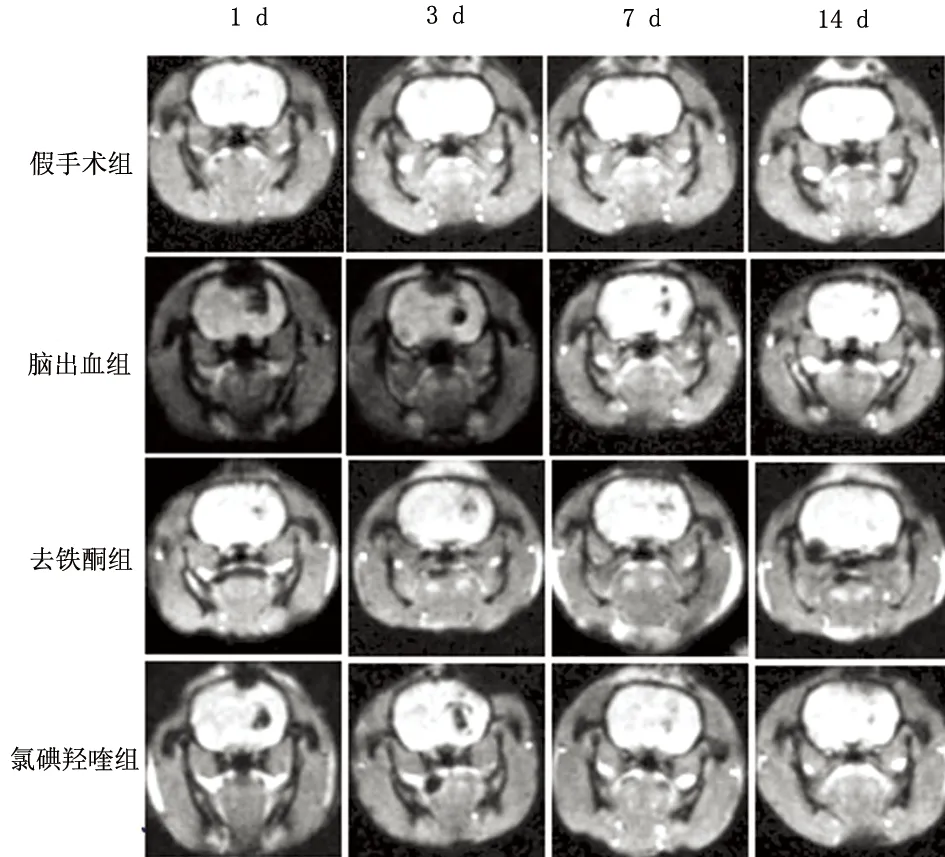
该图对血肿成像较T2*WI清晰,测量图中血肿区感兴趣区可得到幅度值可评估血肿周围脑铁沉积。结果显示铁沉积逐渐增多,术后3~7 d最明显,14 d达峰值。干预组较对照组铁沉积明显较少,以3~7 d减少最明显
图3ESWAN序列的幅度图显示各组大鼠相应时点脑血肿及其演变

1 d以低信号血肿为主,伴周边少量高信号水肿区,3 d、7 d图像表现为中心高信号或混杂信号伴周围低信号环,14 d表现为等信号或混杂信号,伴周围低信号铁环,周围水肿效应消失
图2T2WI序列显示各组大鼠相应时点脑组组织影像学表现
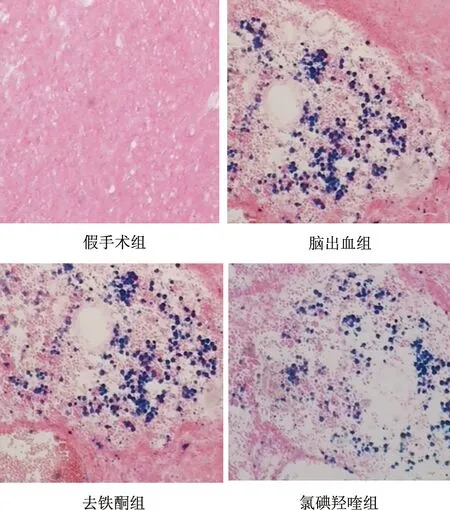
图4 14 d大鼠血肿周围脑组织铁离子沉积(×400)
3 讨 论
血肿通过继发凝血级联(特别是凝血酶生成),血红蛋白分解产物和炎症反应在ICH诱导的损伤中发挥重要作用,通过血脑屏障损害、脑水肿、氧化损伤、病灶周围多细胞参与的炎症反应、微循环障碍等多中间环节参与,导致神经元细胞损伤和神经功能障碍[11]。其中,脑出血后血红蛋白(Hb)在血红素加氧酶1等作用下降解为铁离子等代谢产物,铁蛋白未螯合的不稳定铁通过Fenton反应引发一系列级联反应产生大量活性氧簇,超过细胞自身抗氧化能力[2,3],引发DNA氧化损伤、脂质过氧化反应、Na+-K+-ATP酶损害等加重细胞损伤[1~3]。原代培养的大鼠小脑颗粒细胞在加入FeSO4的培养液中发生的损害证实了上述观点[12]。研究说明铁促进氧化应激产生活性氧在神经元损伤、组织水肿中起重要作用。
本次实验通过大鼠纹状体区内注射胶原酶Ⅳ、肝素建立脑出血模型并给予去铁酮、氯碘羟喹干预,通过核磁成像显示两种铁鳌合剂干预下脑铁含量、血肿体积、脑水肿的动态演变。脑出血后血红蛋白各阶段演变可在MRI产生不同的信号强度。脑出血急性期内,T1WI上呈高信号,T2WI上呈低信号与缺氧血红蛋白缩短T2相关。亚急性期 (3~14 d),早期红细胞内Hb氧化成正铁Hb由血肿外周向中心发展,故可将血肿区清楚地划分中心区、周围区[6]。在亚急性晚期,高铁血红蛋白沉积在细胞外,呈短 T1、长 T2,因此在 T1WI和 T2WI上均呈高信号。灶周水肿在 T1W I上呈低信号,在T2WI上呈高信号。我们动态观察脑出血后MRI信号特点显示脑出血后1 d 4组脑铁含量无明显差别;脑铁含量在对照组及干预组3 d、7 d、14 d较假手术组明显增高,且以7~14 d最高,之后缓慢下降。提示脑出血后3 d铁开始积累,7 d达高峰,之后仍维持在较高的水平。大多研究采用perls铁染色、分光光度分析法对ICH后脑组织样本或切片的非血红素铁即铁离子的测定也得到类似结果。Wu等[13]的研究显示在脑出血后1 d血肿周围区域即出现铁阳性细胞,红细胞裂解始于脑出血后1 d。铁积累时间晚于红细胞裂解,显示红细胞裂解速率快慢、脑组织内铁转运相关蛋白自身清除铁机制两者间的平衡与脑铁含量变化相关。我们发现氯碘羟喹可减少出血后3 d血肿周围水肿及3~7 d血肿周围脑组织铁含量,改善大鼠神经功能缺损,而去铁酮干预显著减轻脑出血后3~7 d铁含量,血肿周围水肿体积未见明显减少、神经功能缺损未见明显改善。两种铁螯合剂干预脑水肿效应差异提示二价铁在脑损害中可能起关键作用。对局部Fe2+的有效结合及转运可能阻断了Haber-Weiss反应进而减轻氧化应激损伤、保护神经细胞、改善脑水肿有关[14]。去铁酮、氯碘羟喹在年龄相关神经退行性疾病如阿尔茨海默病、帕金森病、亨廷顿病中改善大脑功能和延缓疾病的进展的作用差异与本实验结果类似[3],可能与其降低线粒体酶CLK-1的活性[15]、刺激肿瘤坏死因子的释放[16]等神经保护作用相关,尚需进一步研究证实。
氯碘羟喹治疗退行性疾病和癌症疗效显现[3,15,16],各方面研究成为热点,氯碘羟喹用于脑出血后治疗研究较少,其作用效果和具体的机制尚待进一步研究。
[1]Nakamura T,Keep RF,Hua Y,et al. Deferoxamine-induced attenuation of brain edema and neurological deficits in a rat model of intracerebral hemorrhage[J]. J Neurosurg,2004,100(4):672-678.
[2]Wang GQ,Hu WM,Tang QP,et al. Effect comparison of both iron chelators on outcomes,iron deposit,and iron transporters after intracerebral hemorrhage in rats[J]. Molecul Neurobiol,2015,6:1-10.
[3]赵瑞,王改青. 去铁酮对大鼠脑出血后铁超载、活性氧含量及神经功能的影响[J]. 中风与神经疾病杂志,2015,32(4):344-346.
[4]巩泉泉,刘萍,张雅楠,等. 去铁酮在大鼠体内的药代动力学与组织分布[J]. 中国药理学与毒理学杂志,2010,1:59-63.
[5]Lei P,Ayton S,Appukuttan AT,et al. Clioquinol rescues Parkinsonism and dementia phenotypes of the tau knockout mouse[J]. Neurobiol Dis,2015,81:168-175.
[6]Knight RA,Han Y,Nagaraja TN,et al. Temporal MRI assessment of intracerebral hemorrhage in rats[J]. Stroke,2008,39(9):2596-2602.
[7]Fan SJ,Lee FY,Cheung MM,et al. Bilateral substantia nigra and pyramidal tract changes following experimental intracerebral hemorrhage:an MR diffusion tensor imaging study[J]. NMR in Biomedicine,2013,26(9):1089-1095.
[8]Rosenberg GA,Mun-Bryce S,Wesley M,et al. Collagenase-induced intracerebral hemorrhage in rats[J]. Stroke,1990,21(5):801-807.
[9]Garcia JH,Wagner S,Liu KF,et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats Statistical validation[J]. Stroke,1995,26(4):627-635.
[10]Jack CR. MRI‐Based Hippocampal Volume Measurements in Epilepsy[J]. Epilepsia,1994,35(S6):S21-29.
[11]Xi G,Keep RF,Hoff JT. Mechanisms of brain injury after intracerebral haemorrhage[J]. Lancet Neurol,2006,5(1):53-63.
[12]Crichton RR,Wilmet S,Legssyer R,et al. Molecular and cellular mechanisms of iron homeostasis and toxicity in mammalian cells[J]. J Inorganic Biochem,2002,91(1):9-18.
[13]Wu J,Hua Y,Keep RF,et al. Iron and ironhandling proteins in the brain after intracerebral hemorrhage[J]. Stroke,2003,34:2964-2969.
[14]陈艳丽,王改青,尹永峰,等. 氯碘羟喹对实验性脑出血大鼠铜蓝蛋白表达的影响[J]. 疑难病杂志,2014,4:392-394,441.
[15]Wang Y,Branicky R,Stepanyan Z,et al. The Anti-neurodegeneration Drug Clioquinol Inhibits the Aging-associated Protein CLK-1[J]. J Biol Chemist,2009,284:314-323.
[16]Du T,Filiz G,Caragounis A,et al. Clioquinol promotes cancer cell toxicity through tumor necrosis factor alpha release from macrophages[J]. J Pharmacol Exper Therapeut,2008,324:360-367.
The effect evaluation of deferiprone,clioquinol on iron overload in intracerebral hemorrhage rats by MRI
HANJianpeng,WANGGaiqing,XUYi,etal.
(DepartmentofNeurology,ShanximedicalUniversitySecondHospital,Taiyuan030001,China)
ObjectiveTo compare the effect of deferiprone and clioquinol on brain edema and iron contents in intracerebral hemorrhage rats by MRI. Methods24 Wistar rats were randomly assigned to sham group,intracerebral hemorrhage group,deferiprone intervention group,clioquinol intervention group. The right striatum of rats were injected with collagenase IV 0.4 U,heparin 4 U to build intracerebral hemorrhage models. All gavages were administered intragastrically 6 h after ICH. Deferiprone intervention group was given deferiprone gavage(125 mg/kg/times,once every 12 h),clioquinol intervention group were given clioquinol (50mg/kg/times,once every 12 h),sham group and intracerebral hemorrhage group received the same amount of solvent. The neurological function scores were evaluated and magnetic resonance imaging was carried out. ESWAN was used for estimating intralesional iron contents,T2*WI for hematoma volumes,T2WI for edema volumes around the hematoma at 1 d,3 d,7 d,14 d after ICH. At day14 rats were sacrificed and the brain tissues collected were used for iron staining. ResultsNeurological deficits appeared on day 1 after cerebral hemorrhage and were most severe on day 1~3.There was no significant differences between intracerebral hemorrhage group and sham group at day 14.Similarly,MRI revealed that brain edema volumes around the hematoma peaked at 1~3 d. No significant differences exited compared with sham group at day 7~14. MRI also showed that cerebral iron contents increased most obviously at 7~14 d,and then gradually subsided. Clioquinol significantly improved nerurological function at day 3~7,reduced brain edema volumes at day 3 and cerebral iron contents around the hematoma at day 3~7 after surgery. However,deferiprone significantly reduced iron contents at day 3~7,without decreasing edema volumes around hematoma and alleviating nerurological deficits. ConclusionMRI showed edema volumes around the hematoma significantly increased at day 1~3 and iron contents at day 7~14 compared with intracerebral hemorrhage group after ICH. Deferiprone,clioquinol as iron chelators can both reduce iron contents,clioquinol can reduce edema volumes at 3 d and alleviate neurological deficits at 3~7 d;There were no significantly reduced brain water contents and no obviously improved neurological deficits observed in deferiprone intervention group.
Intracerebral hemorrhage;Deferiprone;Clioquinol;MRI;Brain edema;Iron contents
1003-2754(2016)05-0420-05
2016-01-20;
2016-04-07
山西省卫生厅科研课题(No. 201301010);山西省基础研究项目(No. 2014011041-5)
(1.山西医科大学第二医院神经内科,山西 太原 030001;2.山西医科大学第二医院影像科,山西 太原 030001)
王改青,E-mail:wanggq08@126.com
R743.34
A
