双抗夹心ELISA检测转Bar基因抗除草剂大豆
2016-11-11李小宇张春雨郭东全张淋淋董英山王永志李启云吉林省农业科学院植物保护研究所东北作物有害生物综合治理重点实验室吉林省农业微生物重点实验室吉林公主岭600东北农业大学植物保护学院黑龙江哈尔滨5000吉林农业大学农学院吉林长春08
李小宇,张春雨,郭东全,张淋淋,尤 晴,董英山,王永志,,李启云,(.吉林省农业科学院植物保护研究所,东北作物有害生物综合治理重点实验室,吉林省农业微生物重点实验室,吉林 公主岭 600;.东北农业大学植物保护学院,黑龙江 哈尔滨 5000;.吉林农业大学农学院,吉林 长春 08)
双抗夹心ELISA检测转Bar基因抗除草剂大豆
李小宇1,张春雨1,郭东全1,张淋淋2,尤 晴3,董英山1,王永志1,*,李启云1,*
(1.吉林省农业科学院植物保护研究所,东北作物有害生物综合治理重点实验室,吉林省农业微生物重点实验室,吉林 公主岭 136100;2.东北农业大学植物保护学院,黑龙江 哈尔滨 150030;3.吉林农业大学农学院,吉林 长春 130118)
为快捷有效地检测转Bar基因抗除草剂大豆,利用已制备的抗除草剂Bar基因编码蛋白,膦丝菌素乙酰转移酶(phosphinothricin acetyltransferase,PAT)单克隆抗体和多克隆抗体,建立PAT蛋白双抗夹心酶联免疫吸附检测方法,对转Bar基因抗除草剂大豆不同组织材料进行定量检测。结果显示,最佳检测条件为捕获抗体质量浓度0.125 μg/mL,包被酶标板,37 ℃孵育1 h后4 ℃静置过夜,检测样品37 ℃孵育1.5 h,检测抗体质量浓度6.25 μg/mL,37 ℃孵育1.5 h;PAT蛋白的最低检测限为0.04 ng/mL,大豆蛋白体系中为8 ng/mL;重复性变异系数小于3%。利用上述检测条件,对实验建立的转Bar基因抗除草剂大豆进行PAT蛋白定量检测,成功地在根、茎、花、叶、种子不同部位检测到该蛋白的表达。
Bar;双抗夹心酶联免疫吸附;大豆;检测
草丁膦是一种低毒除草剂,其有效成分为膦丝菌素(phosphinothricin,PPT),Bar基因为抗除草剂基因,编码膦丝菌素乙酰转移酶(phosphinothricin acetyltransferase,PAT)蛋白能够使除草剂的有效成分PPT自由基乙酰化,从而失去对植物的毒性[1-2]。目前,已经获得转Bar基因的农作物,并开始大面积应用[3-6]。我国对于转基因产品检测普遍采用聚合酶链式反应(polymerase chain reaction,PCR)和Southern印记杂交等实验室核酸检测方法[7-13],虽然PCR检测灵敏性高,但PCR检测重复性差,而Southern杂交耗时长、成本高、难以在基层推广。以检测外源蛋白为目的的试纸条法[14],适合初筛检验,但灵敏度相对较低。而基于免疫学的双抗夹心ELISA检测法具有耗时短、操作简单、重复性好、灵敏度高、可实现样品的高通量等特点。
本研究以已制备的PAT蛋白单克隆抗体和多克隆抗体为基础,建立了一套适用于转Bar基因抗除草剂大豆的双抗夹心酶联免疫吸附实验(enzymelinked immunosorbent assay,ELISA)检测方法。通过对捕获抗体工作条件、样品孵育条件和检测抗体工作条件的优化,提高了该检测方法的灵敏性和准确性,并适合于基层的推广应用。
1 材料与方法
1.1 材料与试剂
实验室已制备保存PAT蛋白的单克隆抗体和多克隆抗体[15];酶标抗体 美国Sigma公司;转Bar基因抗除草剂大豆样品。
1.2 仪器与设备
BioTek酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 双抗夹心ELISA方法的建立
捕获抗体包被96 孔酶标板,设阳性对照、阴性对照和空白对照,3 次重复,磷酸缓冲液(phosphate buffer solution with Tween-20,PBST)振荡清洗3 遍;5%脱脂奶封闭液37 ℃封闭1 h,PBST振荡清洗3 遍;检测样品37 ℃孵育,PBST振荡清洗3 遍;检测抗体37 ℃孵育,PBST振荡清洗3 遍;酶标抗体37 ℃孵育1 h,PBST振荡清洗6 遍,拍干;室温避光条件下邻苯二胺(o-phenylenediamine,OPD)显色,2 mol/L H2SO4溶液终止反应,酶标仪测定OD490nm值。根据公式OD490nm样品(P值)/OD490nm阴性(N值)>2.1为阳性判定检测结果。
1.3.2 双抗夹心ELISA方法的优化
对实验室保存的4 株PAT蛋白单克隆抗体,运用双抗夹心ELISA基本程序进行检测,3 次重复,选择P/N最大值对应的PAT蛋白单克隆抗体或组合为捕获抗体。检测抗体为实验室已制备保存的PAT蛋白兔源多克隆抗体,根据方阵滴度法确定捕获抗体和检测抗体最佳工作质量浓度[16-17]。优化捕获抗体包被时间、检测样品孵育时间和检测抗体孵育时间,确定最佳工作条件。
1.3.3 双抗夹心ELISA标准曲线的建立及灵敏度
按优化后的双抗夹心ELISA方法,取连续稀释度的PAT蛋白标准品溶液,每个不同质量浓度孔均取3 个平行。对所得数据进行回归分析,得出满足该方法的线性方程和标准曲线。根据实验结果计算出双抗夹心ELISA检测PAT蛋白的最低检测限。
提取非转基因大豆籽粒蛋白,将PAT蛋白梯度稀释,分别与大豆蛋白混合,按优化后的双抗夹心ELISA方法检测PAT蛋白,检验该方法在大豆籽粒蛋白环境下的灵敏度。
为验证所提模型的实用性,选取某市物流企业拟选ELV充电站址作为研究对象,对备选方案的实际指标数据进行综合评价。基础数据如表2所示。
1.3.4 重复性实验
板内重复性实验:优化后的双抗夹心ELISA方法分别检测8 份转Bar基因大豆阳性叶片和种子,每份检测材料3 孔平行,根据每份检测材料P/N值计算出板内标准差和变异系数。
换板重复该实验:根据测得的P/N值计算出板间每份检测材料的板间标准差和变异系数。
1.3.5 检测转Bar基因抗除草剂大豆
采集转Bar基因抗除草剂大豆不同组织,3 个重复,每个重复的小区内采集不同发育阶段的根、茎、叶、花和种子,每个部分取0.1~0.2 g,液氮研磨,PBS缓冲液1∶10倍稀释(100 mg‘100 μL),12 000 r/min离心20 min,上清液为待测样品液,优化后,采用双抗夹心ELISA方法定量检测PAT蛋白表达量。
2 结果与分析
2.1 PAT蛋白双抗体夹心ELISA检测方法的建立
根据OD490nm测定结果,以P/N最大值确定各个工作参数。如表1所示,单克隆抗体10C8 P/N值最大,定为捕获抗体;采用矩阵滴定法确定捕获抗体和检测抗体工作质量浓度,表2表明,当捕获抗体工作质量浓度为0.125 μg/mL,检测抗体工作质量浓度为6.25 μg/mL时,OD490nm值大于1.0,并且稀释度高,本底低。对捕获抗体包被时间、检测样品孵育时间和检测抗体孵育时间进行优化,如表2、图1和图2所示,捕获抗体孵育时间37 ℃、1 h后4 ℃静置过夜,检测样品孵育时间1.5 h,检测抗体孵育时间1.5 h时,P/N值最大。说明采用优化后的工作参数,PAT蛋白双抗夹心ELISA检测反应最佳。
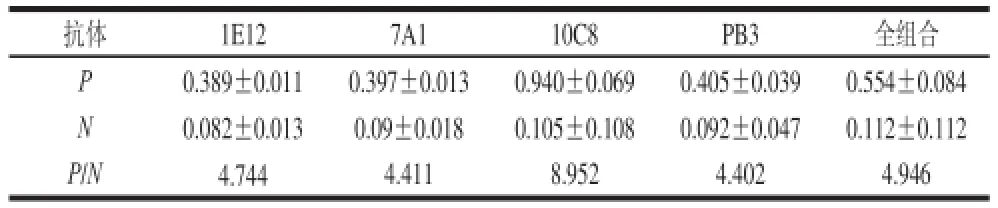
表1 捕获抗体的确定(OD490 nm值)Table 1 Determination of optimal working concentration of capture antibody (OD490 nm)

表2 矩阵滴定实验结果(OD490 nm值)Table 2 The results of matrix titration experiments (OD490 nm)
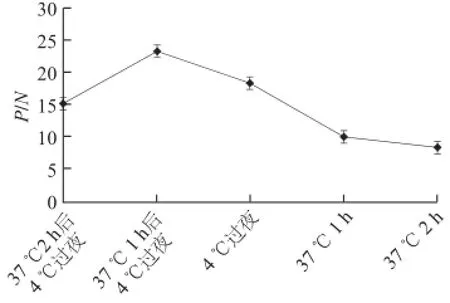
图1 捕获抗体孵育时间对检测结果的影响Fig.1 Effect of capture antibody incubation time on the results of detection
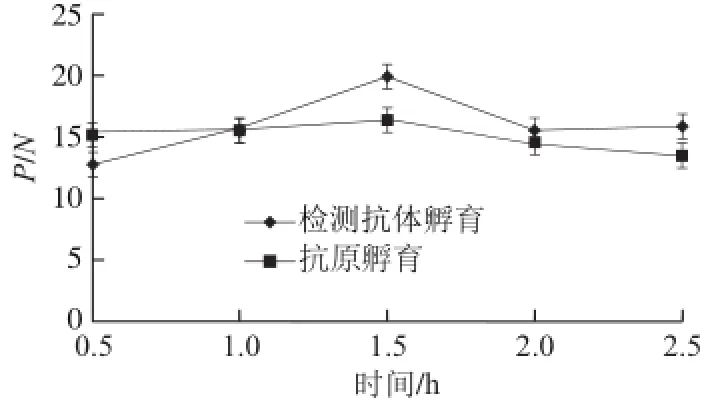
图2 抗原孵育时间和检测抗体孵育时间对检测结果的影响Fig.2 Effect of antigen incubation time on the results of detection
2.2 标准曲线的确定

图3 灵敏度检测Fig.3 Sensitivity of the detection method
如图4所示,在大豆蛋白环境中,PAT蛋白质量浓度从8 μg/mL开始做10 倍稀释梯度,当PAT质量浓度为8 ng/mL,P/N值>2.1,说明在大豆蛋白环境中,各种蛋白酶的作用下,PAT蛋白的最低检测限高于PAT蛋白体外最低检测限。
2.3 重复实验结果
对8 份检测材料进行板内和板间重复性实验检测,表3表明,板内变异系数为0.5%~2.2%,板间变异系数为0.3%~2.0%,变异系数均小于3%,表明建立的双抗夹心ELISA检测方法的重复性良好。
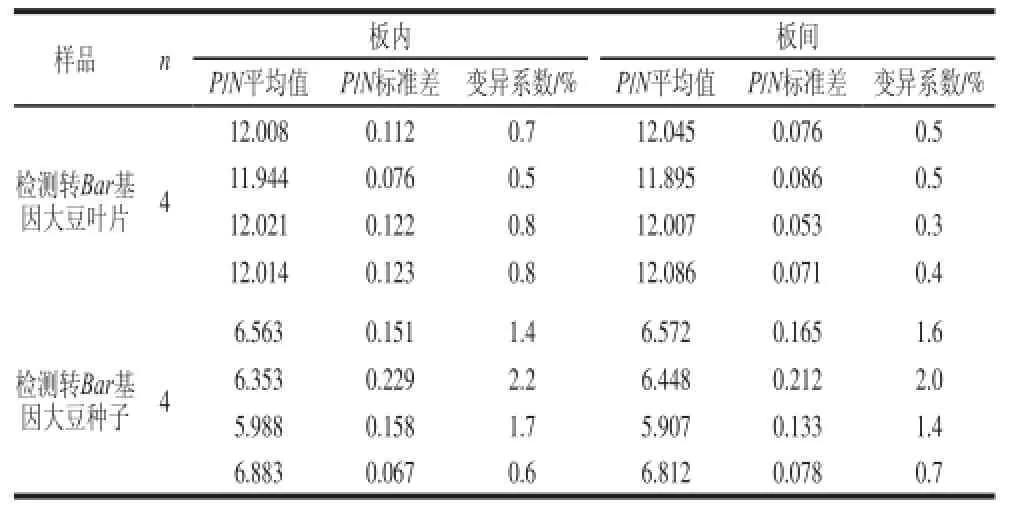
表3 板内和板间重复实验结果Table 3 Results of repetitive experiments
2.4 检测转Bar基因抗除草剂大豆
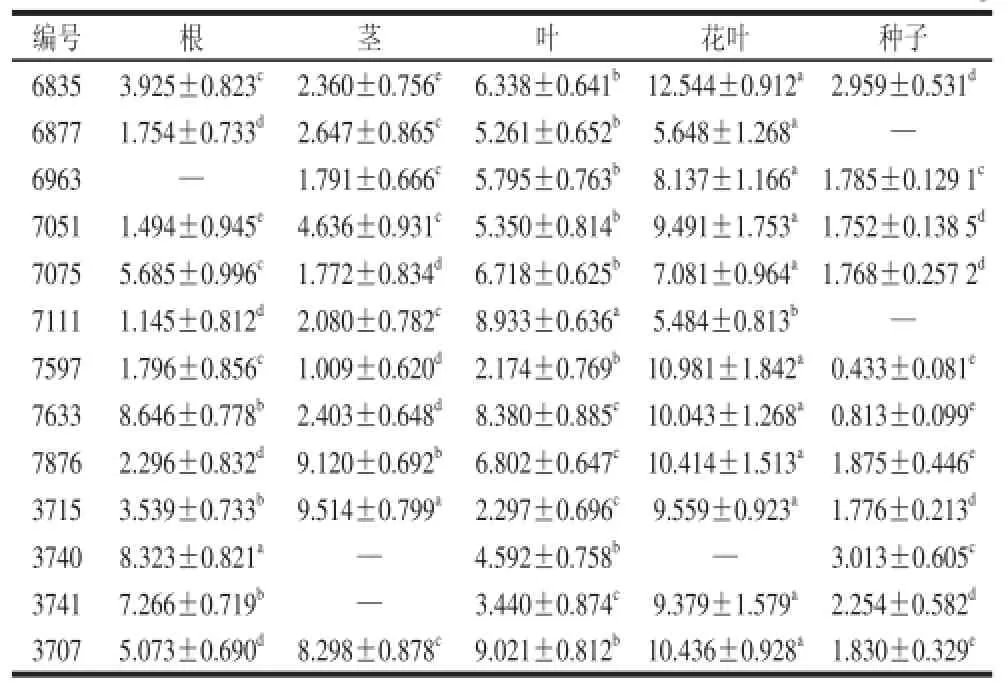
表4 不同组织中PAT蛋白表达量Fig.4 The expression levels of PAT protein in different tissues μg/g
对转Bar基因抗除草剂大豆材料进行检测,表4表明,PAT蛋白在大豆全株都有表达,可以很好地控制除草剂的危害。不同生长期PAT蛋白表达量有较大的差异,除7111号植株外,其他检测植株花叶含量最高,根、茎、叶及种子中的PAT蛋白含量均极显著低于花叶,且各个组织中PAT蛋白表达量差异也极显著(P<0.01)。
3 讨 论
ELISA检测技术是一种快速、简便的检测方法,其反应条件是影响检测结果的重要因素。对微孔封闭是双抗夹心ELISA检测法中非常重要的一步,它可以减少抗原蛋白非特异性吸附,从而使检测结果更加精确。在检测中,由于材料中目的蛋白量较少,为了增加检出几率,可以选择不进行封闭[18-19],虽然可以增加抗原结合量,但也会使检测抗体发生非特性吸附,从而产生假阳性。本研究采用了5%脱脂奶封闭液对微孔进行了彻底的封闭,从而增加了检测法的准确性。
ELISA实验中酶标抗体标记酶的选择至关重要,使用辣根过氧化物酶(horseradish peroxidase,HRP)作为中间催化酶的酶免疫实验测定放大系统的建立,很大程度上提高了酶免疫实验的检测敏感性[20]。另外,常用的作用底物OPD在灵敏度方面优于5-氨基水杨酸和邻联苯甲胺。所以,本实验中使用了OPD作为HRP的底物。
国内有研究以多克隆抗体作为捕获抗体,单克隆抗体作为检测抗体[21-23],由于单克隆抗体识别的抗原表位有可能与多克隆抗体识别的抗原表位重叠,形成竞争关系,这样影响检测抗体与检测样品的结合,降低检测灵敏度;多克隆抗体对抗原表位的亲和力不同,容易造成后期洗涤中结合物的脱落;而以单抗作为捕获抗体,多抗作为检测抗体,可以在保证检测方法特异性的前提下,最大程度提高检测灵敏度。另外,本研究建立双抗夹心ELISA方法与间接ELISA方法[24]比较,具有富集作用,特异性更强,能够高效、准确地检测待测样品。
我国是大豆的原产地,也是最大的进口国,由于国内大豆需求量逐渐升高,我国每年都需要从美国、巴西和阿根廷等地进口大量转基因大豆[25],同时我国研究学者也在积极推进转基因农作物的研究与推广。本研究建立PAT蛋白双抗夹心ELISA检测方法,可以快速有效地定量检测转Bar基因抗除草剂大豆,为转基因大豆及其相关产品的检测提供参考。
[1] 刘洪艳, 弭晓菊, 崔继哲. Bar基因、PAT蛋白和草丁膦的特性与安全性[J]. 生态学杂志, 2007, 26(6): 938-942. DOI:10.3321/ j.issn:1000-4890.2007.06.029.
[2] HEROUET C, ESDAILE D J, MALLYON B A, et al. Safety evaluation of the phosphinothricin acetyltransferase proteins encoded by the pat and bar sequences that confer tolerance to glufosinateammonium herbicide in transgenic plants[J]. Regul Toxicol Pharmacol, 2005, 41(2): 134-149. DOI:0.1016/j.yrtph.2004.11.002.
[3] KNAPP S, LARONDELLE Y, ROSSBEG M, et al. Transgenic tomato lines containing Ds elements at defined genomic positions as tools for targeted transposon tagging[J]. Molecular and General Genetics, 1994, 243(6): 666-673. DOI:10.1007/BF00279576.
[4] PALMER K E, THOMSON J A, RYBIEKI E P. Generation of maize cell lines containing autonomously replicating maize streak virusbased gene vectors[J]. Archives of Virology, 1999, 144(7): 1345-1360.
[5] CHO M J, WONG J H, MARX C. Overexpression of thioredoxin h leads enhanced activity of starch debranching enzyme (Pullulanase) in barly grain[J]. Proceedings of the National Academy of Sciences USA, 1999, 96(25): 14641-14646.
[6] VINOGRADOVA S V, KAMIONSKAYA A M, ZINOVKIN R A, et al. Expression of beet yellows virus coat protein cDNA to create transgenic resistance in plants[J]. Doklady Biochemistry Biophysics, 2012, 443: 68-70. DOI:10.1134/S160767291202007X.
[7] COSTA J, MAFRA I, AMARAL J S, et al. Monitoring genetically modified soybean along the industrial soybean oil extraction and refining processes by polymerase chain reaction techniques[J]. Food Research International, 2010, 43: 301-306. DOI:10.1016/ j.foodres.2009.10.003.
[8] AO J X, LI Q Z, GAO X J, et al. A multiplex nested PCR assay for the simultaneous detection of genetically modified soybean, maize and rice in highly processed products[J]. Food Control, 2011, 22: 1617-1623. DOI:10.1016/j.foodcont.2011.03.018.
[9] 岳运锋, 吴刚, 武玉花, 等. 转基因植物中标记基因定性PCR检测方法研究[J]. 中国油料作物学报, 2011, 33(3): 280-289.
[10] 孙红伟, 路兴波, 杨崇良, 等. 9 种大豆制品中转基因成分定性PCR检测[J]. 食品科学, 2008, 29(2): 234-237. DOI:10.3321/ j.issn:1002-6630.2008.02.046.
[11] 王小花, 李建祥, 王国卿, 等. SYBR Green实时荧光定量PCR检测大豆转基因成分[J]. 食品科学, 2009, 30(8): 171-176. DOI:10.3321/ j.issn:1002-6630.2009.08.035.
[12] 陈彦, 潘见, 王亚, 等. 大豆DNA提取方法及降落PCR检测转基因成分的研究[J]. 食品科学, 2009, 30(24): 355-358. DOI:10.3321/ j.issn:1002-6630.2009.24.079.
[13] 陈笑芸, 汪小福, 周育, 等. 转基因大豆深加工食品DNA鉴定技术研究[J]. 中国食品学报, 2013, 13(4): 156-162.
[14] MARC V B, ADINDA D S, DANIELE D B, et al. Detection of genetically modified plant products by protein strip testing: an evaluation of real-life samples[J]. European Food Research and Technology, 2007, 225: 49-57. DOI:10.1007/s00217-006-0381-2.
[15] 高旭东, 王永志, 时圣凤, 等. 膦丝菌素乙酰转移酶的表达及单克隆抗体制备[J]. 细胞与分子免疫学杂志, 2013, 29(5): 500-503.
[16] HE Q G, DU Q Y, LAU S, et al. Charact erizat ion of monoclonal antibody against SARS coronavirus nucleocapsid antigen and development of an antigen capture ELISA[J]. Journal of Virological Methods, 2005, 129: 46-53.
[17] 李萍, 马亚茹, 陆俭, 等. Pfs25蛋白单克隆抗体的制备及双抗体夹心ELISA的建立[J]. 细胞与分子免疫学杂志, 2011, 27(12): 1330-1334.
[18] ALSHAMAHY H A, WRIGHT S G. Enzyme-linked immunosorbent assay for brucella antigen detection in human sera[J]. Journal of Medical Microbiology, 1998, 47: 169-172. DOI:10.1099/00 222615-47-2-169.
[19] 王育才, 张殿忠, 何立宏, 等. 检测肌糖蛋白C夹心ELISA方法的建立及初步应用[J]. 细胞与分子免疫学杂志, 2011, 27(6): 694-696.
[20] 孙伟, 焦奎, 张书圣. 酶联免疫分析法研究进展[J]. 青岛化工学院学报, 2001, 22(3): 209-214.
[21] 王敏, 张亮, 张威, 等. 转基因作物pat蛋白的双抗夹心酶联免疫检测方法研究[J]. 分析化学, 2013(10): 1555-1560.
[22] 王新桐, 孙佳芝, 高丽丽, 等. 转基因棉花中新霉素磷酸转移酶(NPTⅡ)双抗体夹心ELISA定量检测方法的建立[J]. 农业生物技术学报, 2014, 22(3): 372-379. DOI:10.3969/j.issn.1674-7968.2014.03.013.
[23] 龙丽坤, 李葱葱, 张明, 等. bar基因表达蛋白单克隆抗体制备及ELISA检测方法的建立[J]. 生物技术通报, 2014(10): 71-75.
[24] XU W T, HUANG K L, DENG A K, et al. Enzyme linked immunosorbent assay for PAT protein detection in genetically modifed rape[J]. Joumal of Agricultural Biotechnology, 2006, 14(2): 250-254.
[25] 叶增民, 潘洁. 转基因大豆及其制品的安全性研究现状[J]. 生物技术通报, 2009(2): 26-28.
Double-Antibody Sandwich ELISA for the Detection of Transgenic Bar Gene Herbicide-Tolerant Soybeans
LI Xiaoyu1, ZHANG Chunyu1, GUO Dongquan1, ZHANG Linlin2, YOU Qing3, DONG Yingshan1, WANG Yongzhi1,*, LI Qiyun1,*
(1. Jilin Key Laboratory of Agricultural Microbiology, Key Laboratory of Integrated Pest Management on Crops in Northeast, Institute of Plant Protection, Jilin Academy of Agricultural Sciences, Gongzhuling 136100, China; 2. College of Plant Protection, Northeast Agricultural University, Harbin 150030, China; 3. College of Agronomy, Jilin Agricultural University, Changchun 130118, China)
To rapidly and efficiently detect transgenic Bar herbicide-tolerant soybeans, we produced a monoclonal antibody and a polyclonal antibody against phosphinothricin acetyltransferase (PAT) protein encoded by the Bar gene and then utilized them to established a double-antibody sandwich ELISA system for the detection of PAT protein, which could quantify PAT in different tissues and materials from transgenic Bar herbicide-tolerant soybeans. Reaction conditions were optimized as follows: 0.125 μg/mL capture antibody was coated onto the microtiter plates at 4 ℃ overnight after incubation at 37 ℃ for 1 h, the antigen was incubated at 37 ℃ for 1.5 h, and the detection antibody at 6.25 μg/mL was incubated at 37 ℃ for 1.5 h. The detection sensitivity was 0.04 ng/mL for purified PAT and 8 ng/mL for crude soybean protein. The coefficient of variation of reproducibility was less than 3%. This method has been successfully applied to detect the expression of PAT in the root, stem, leaf, flower and seed of transgenic soybean.
Bar; double-antibody sandwich ELISA; soybeans; detection
10.7506/spkx1002-6630-201604040
Q788
A
1002-6630(2016)04-0222-04
李小宇, 张春雨, 郭东全, 等. 双抗夹心ELISA检测转Bar基因抗除草剂大豆[J]. 食品科学, 2016, 37(4): 222-225.
DOI:10.7506/spkx1002-6630-201604040. http://www.spkx.net.cn
LI Xiaoyu, ZHANG Chunyu, GUO Dongquan, et al. Double-antibody sandwich ELISA for the detection of transgenic Bar gene herbicide-tolerant soybeans[J]. Food Science, 2016, 37(4): 222-225. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201604040. http://www.spkx.net.cn
2015-03-26
吉林省自然科学基金项目(20130101089JC);吉林省中青年科技领军人才及优秀创新团队项目(20121812);
国家转基因生物新品种培育重大专项(2014ZX08004)
李小宇(1981—),男,助理研究员,硕士,研究方向为植物病毒与生物反应器。E-mail:lxyzsx@163.com
*通信作者:王永志(1978—),男,副研究员,博士,研究方向为植物病毒与生物反应器。E-mail:yzwang@126.com
李启云(1974—),男,研究员,博士,研究方向为植物保护。E-mail:qyli1225@126.com
