叶黄素及其顺式异构体的快速检测
2016-11-11李大婧刘春菊肖亚冬庞慧丽刘春泉江苏省农业科学院农产品加工研究所江苏南京2004国家蔬菜加工技术研发专业分中心江苏南京2004
李大婧,刘春菊,肖亚冬,庞慧丽,刘春泉,(.江苏省农业科学院农产品加工研究所,江苏 南京 2004;2.国家蔬菜加工技术研发专业分中心,江苏 南京 2004)
叶黄素及其顺式异构体的快速检测
李大婧1,2,刘春菊1,2,肖亚冬1,庞慧丽1,刘春泉1,2,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.国家蔬菜加工技术研发专业分中心,江苏 南京 210014)
为了建立分离度好、分离效率高的叶黄素顺、反异构体检测方法。通过对检测波长、流动相、流动相比例和流速等色谱条件的摸索和优化,确定最佳色谱条件,并采用光谱、高效液相色谱、质谱等方法对叶黄素顺、反异构体进行定性定量分析。结果表明:该方法流动相为二氯甲烷-乙腈-甲醇(20∶30∶50,V/V),流速为1.0 mL/min,叶黄素热异构化样品中各物质在12 min内达到有效分离,无拖尾现象,峰形较好;在叶黄素热异构化样品中鉴定出15-顺式、13/13′-顺式和9/9′-顺式叶黄素顺式异构体及全反式叶黄素,全反式叶黄素在4~260 ng范围内峰面积与进样量呈良好线形性关系,回收率在95%以上,精密度和稳定性相对标准偏差均小于2%。该方法分离度好、准确性高、重现性好。
叶黄素;顺、反异构体;检测方法
叶黄素具有抗氧化、抗癌、抗心脑血管疾病等生理功能,尤其是对眼部疾病有很好的防治作用,受到人们的日益关注,是国际公认具有防病、抗病生理功能的重要活性物质[1-2]。叶黄素作为食品添加剂和营养增补剂被广泛应用于食品、保健品、医药、化妆品、烟草和畜禽类饲料等多个领域。
叶黄素分子结构中含有多个共轭双键结构,在自然界以多种异构体形式存在[3]。在叶黄素制剂化或食品加工过程中,叶黄素会不可避免地受到加热、空气等影响,发生异构化反应,甚至裂解为环氧化物、含醛基或酮基的衍生物等[4]。目前很少有人监测在叶黄素提取、制剂过程中顺式异构体的变化,产品的质量难以保障,因此建立叶黄素高效、可行的检测方法对叶黄素异构体的研究和应用具有重要的意义。
高效液相色谱(h i g h p e r f o r m a n c e l i q u i d chromatography,HPLC)方法能够很好地分离样品中的天然色素,具有分离效果好、检测灵敏度高、分离效率高等优点,现在已经成为应用于类胡萝卜素分析中非常活跃的技术之一,也是叶黄素定性定量检测的主要技术。Rodriguez等[5]运用HPLC结合二级阵列质谱和低场核磁(HPLC-diode array detection-mass spectrometernuclear magnetic resonance,HPLC-DAD-MS-NMR)方法分离和鉴定出叶黄素和玉米黄质异构体;Dachtler等[6]通过HPLC-MS、HPLC-NMR技术分析了菠菜和肠胃中叶黄素和玉米黄质的立体异构体;陈万勤等[3]采用冷皂化-HPLC方法测定乳制品中的叶黄素的顺反异构体;李秀霞等[7]使用反相液谱结合二级阵列和大气压化学电离质谱(HPLC-DAD-atmospheric pressure chemical ionization-MS,HPLC-DAD-APCI-MS)技术对玉米蛋白粉中叶黄素、玉米黄质和隐黄质及其主要顺式异构体进行了分离和鉴定。这些检测方法都存在着检测耗时长、分离效果较差等问题,是限制HPLC技术实现快速检测的瓶颈。因此,建立一种快速、分离度高、准确度高的叶黄素检测方法成为当今亟需解决的问题。
本实验通过对色谱条件的多次优化和筛选,并通过MS、光谱、HPLC等方法对叶黄素顺、反异构体进行定性定量分析,旨在建立一种对叶黄素行之有效的HPLC检测方法,为更好地控制叶黄素产品的质量提供参考。
1 材料与方法
1.1 材料与试剂
反式叶黄素标准品(97%) 美国Fluka公司;棕榈油 泰国巴吞油厂有限公司;甲醇、乙腈二氯甲烷(分析纯) 美国天地公司;正己烷(分析纯)国药集团化学试剂有限公司;丙酮(分析纯) 南京宁试化学试剂有限公司;氮气(纯度99.99%) 南京文达特种气体有限公司。
1.2 仪器与设备
85-2A数显测速恒温磁力搅拌器 江苏金坛市金华仪器厂;D10氮气吹扫仪 杭州奥盛仪器有限公司;数控超声波清洗器 昆山市超声仪器有限公司;BS224S电子分析天平 北京赛多利斯科学仪器公司;1200 HPLC仪(主要包括在线真空脱气机、四元梯度洗脱泵、柱温箱、DAD)、色谱柱YMC-C30、6530精确质量数四极杆-飞行时间质谱仪(APCI源) 美国Agilent公司。
1.3 方法
1.3.1 叶黄素顺式异构体的制备
吸取棕榈油4.6 mL于具塞刻度试管中,在170 ℃条件下,于恒温油浴锅中避光加热。称取10 mg全反式叶黄素晶体于另一支试管中并加入400 μL正己烷,超声溶解30 s,频率为40 kHz。将正己烷-叶黄素溶液注入相应油脂中,制成工作溶液,这一过程需在1 min内完成。热处理2 h时,移取200 μL样品于小试管中,与2 mL丙酮混合均匀后,迅速置于-20 ℃冰箱保存24 h,使油脂中的三酰甘油酯结晶。通过0.45 μm膜过滤于样品瓶中,进行HPLC-MS分析,整个实验过程中,试管敞口不密封,所有操作均在避光条件下完成。
1.3.2 HPLC方法的建立
[8-9]方法进行。
HPLC条件:色谱柱为C30(4.6 mm×250 mm,5 μm);柱温25 ℃;进样量20 μL;DAD光谱收集范围250~600 nm。
MS条件:离子源为APCI+,毛细管电压2 500 V,电晕电流4 μA,干燥气体5 L,气化温度350 ℃,蒸汽温度400 ℃,雾化气体20 psi。
1.3.3 叶黄素标准曲线的绘制
准确称取1 mg全反式叶黄素标准品,用丙酮溶解并定容至25 mL,混匀,制成质量浓度为40 μg/mL的标准溶液。分别取一定量标准液置于5 mL容量瓶中,用丙酮定容并混匀,制成质量浓度为0.2、1、3、5、7、9、11、13 μg/mL的系列标准溶液,采用所建的C30-HPLC方法检测,每个系列质量浓度重复进样3 次,根据吸收峰面积对相应进样量进行线性回归分析,绘制全反式叶黄素的标准曲线。
1.3.4 回收率的测定
首先采用HPLC方法对样品溶液进行检测,然后精密移取6 份已测的样品溶液2 mL,分别加入相同体积的1、3、9 μg/mL叶黄素标准液,制备加标溶液,溶液中叶黄素含量在4~260 ng,之后进行HPLC检测,将测得的峰面积代入标准曲线方程得到样品液中的叶黄素含量,按下式计算加标回收率。
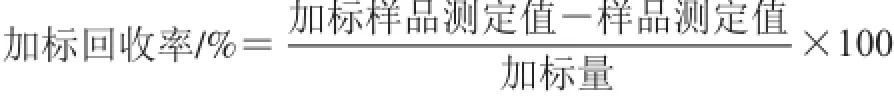
1.3.5 精密度的测定
精确移取2 份叶黄素样品溶液,样液中叶黄素含量在4~260 ng之间,按照上述HPLC条件各重复进样6 次,根据峰面积计算样品中相应的叶黄素含量,最终得到叶黄素含量相对标准偏差(relative standard deviation,RSD)。
1.3.6 稳定性实验
取一份样品液于-18 ℃条件下密封避光保存0、4、8、10 h,根据峰面积计算样品中相应的反式叶黄素含量,进而得到10 h内供试样品中叶黄素含量变化情况。
1.4 数据分析
实验数据结果均采用Origin 9.0软件处理。
2 结果与分析
2.1 HPLC法流动相的选择
目前,国内外用于叶黄素分析的HPLC流动相主要为水、甲基叔丁基醚、甲醇、乙腈、二氯甲烷。如张艳[10]、Rodriguez[5]等应用含乙腈、甲醇的流动相分别分离鉴定出叶黄素类化合物、β-胡萝卜素类化合物,Qiu Dan[11]、Chen[12]等采用含二氯甲烷、甲醇的流动相建立了对β-胡萝卜素异构体有效可行的色谱方法,Lee等[13]则应用二氯甲烷、乙腈参与的流动相分离检测出番茄红素及其异构体。在另外文献报道[14-15]中,研究者分别使用水-甲醇、水-乙腈为流动相对叶黄素顺、反异构体进行分离,但这两种方法所用时间都较长,分别为70 min和45 min,效率较低。
分析所查阅的国内外分离叶黄素的HPLC法后,首先对文献[6]报道的HPLC法进行了尝试,HPLC分析条件为:柱温25 ℃,流速0.8 mL/min,检测波长450 nm,流动相A为水,流动相B为甲基叔丁基醚,流动相C为甲醇,线性梯度洗脱,A的比例始终为5%,B在8 min内由25%增至47%,之后在19 min内持续增至85%,最终在1 min内由85%降至30%,测定结果见图1a。可知,此方法分离效果很不好,主峰之前的多种物质未达到基线分离。之后多次调整了线性洗脱过程中流动相的配比,但分离效果仍然很不好,与开始图谱相差无几。
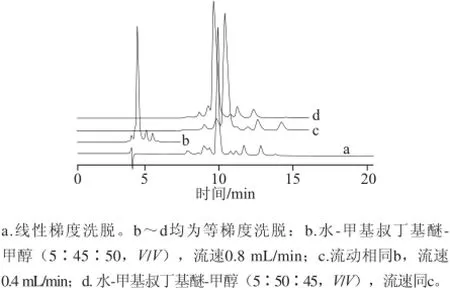
图1 不同条件下叶黄素的色谱图Fig.1 Chromatograms of all-(E)-lutein under different separation conditions
在以上实验的基础上,将线性梯度洗脱调整为等梯度洗脱,流动相水-甲基叔丁基醚-甲醇配比为5∶45∶50(V/V),其他条件不变,分离效果如图1b所示,可看出所用的时间明显缩短,但在主峰上仍存在肩峰。之后将流速由0.8 mL/min调整为0.4 mL/min,检测结果见图1c,与图1b相比,各组分出峰时间延迟,分离效果稍好,但仍未达到基线分离,色谱峰峰形也亟需改善。在流速为0.4 mL/min的基础上,将流动相配比调整为5∶50∶45(V/V),结果如图1d所示,由图1d可知,主峰与前一种物质没有完全分离,而且主峰存在拖尾现象。经过上述调整得出的谱图可知,此方法不能使叶黄素类物质达到基线分离。为使这些物质达到良好的分离度,参照Lakshminarayana等[8]建立的色谱方法,选取二氯甲烷、乙腈、甲醇为流动相,通过调整流动相比例、温度、流速、洗脱时间等来增加分离度,进而达到最佳分离效果。
2.2 HPLC法流动相比例的调整
遴选出流动相A二氯甲烷、流动相B乙腈、流动相C甲醇后,参照文献[5]中的色谱方法,考察以下流动相配比对样品测定的影响。A-B-C配比(V/V):a. 20∶60∶20;b. 20∶50∶30;c. 20∶40∶40;d. 20∶30∶50;e. 20∶20∶60,检测结果见图2。由图2可知,在由流动相a逐渐调整至流动相e的过程中,样品中各物质全部洗脱所用的时间是逐渐缩短的,其中流动相a、b未使样品中各组分较好分离,流动相c、e得到的色谱峰对称性稍差,峰形欠满意,流动相d使样品中各物质达到有效分离,拖尾现象有明显改善,峰形较好。
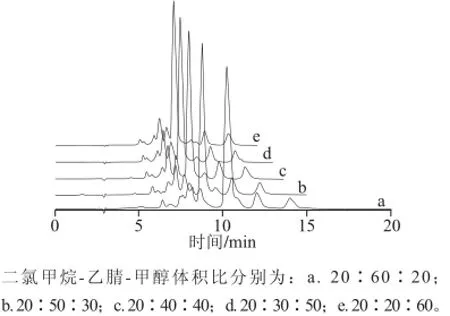
图2 不同流动相配比条件下叶黄素的色谱图Fig.2 Chromatograms of all-(E)-lutein using different mobile phase compositions
2.3 流速的选择
实验比较了0.6、0.8、1.0 mL/min 3 种流速条件下样品中叶黄素的分离情况,结果发现,流速为1.0 mL/min时,样品中不同组分可达到有效分离,而流速为0.6、0.8 mL/min时,各组分出峰时间延后,效率较低,检测成本增加。
2.4 叶黄素热异构化产物结构的鉴定
改进后的H P L C条件:色谱柱C30(4.6 mm×250 mm,5 μm);柱温25 ℃;检测波长450 nm;时间13 min;流速1.0 mL/min;进样量20 μL;DAD光谱收集范围250~600 nm;流动相为二氯甲烷-乙腈-甲醇(20∶30∶50,V/V)。
分别对叶黄素标准品和叶黄素顺式异构体样品进行检测,C30-HPLC色谱图分别见图3~5。根据色谱图只能鉴定峰4为全反式叶黄素,为确定色谱图中其他峰的归属,对样品进行MS分析。分析可知图中峰1、2、3、5、6的质谱图与峰4的质谱图类似,它们具有共同的特分子离子峰:[M+H+-H2O](m/z 551),从而可以判断峰1、2、3、5、6皆为叶黄素异构体。此外,各物质峰的m/z在大于570范围内还含有较多的离子碎片,这可能是由于在制取的叶黄素样品溶液中含有少量的棕榈油。
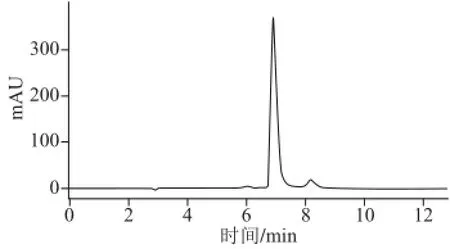
图3 全反式叶黄素的色谱图Fig.3 Chromatogram of all-(E)-lutein

图4 在170 ℃棕榈油中加热120 min后叶黄素的色谱图Fig.4 Chromatogram of lutein in palm oil heated at 170 ℃ for 120 min

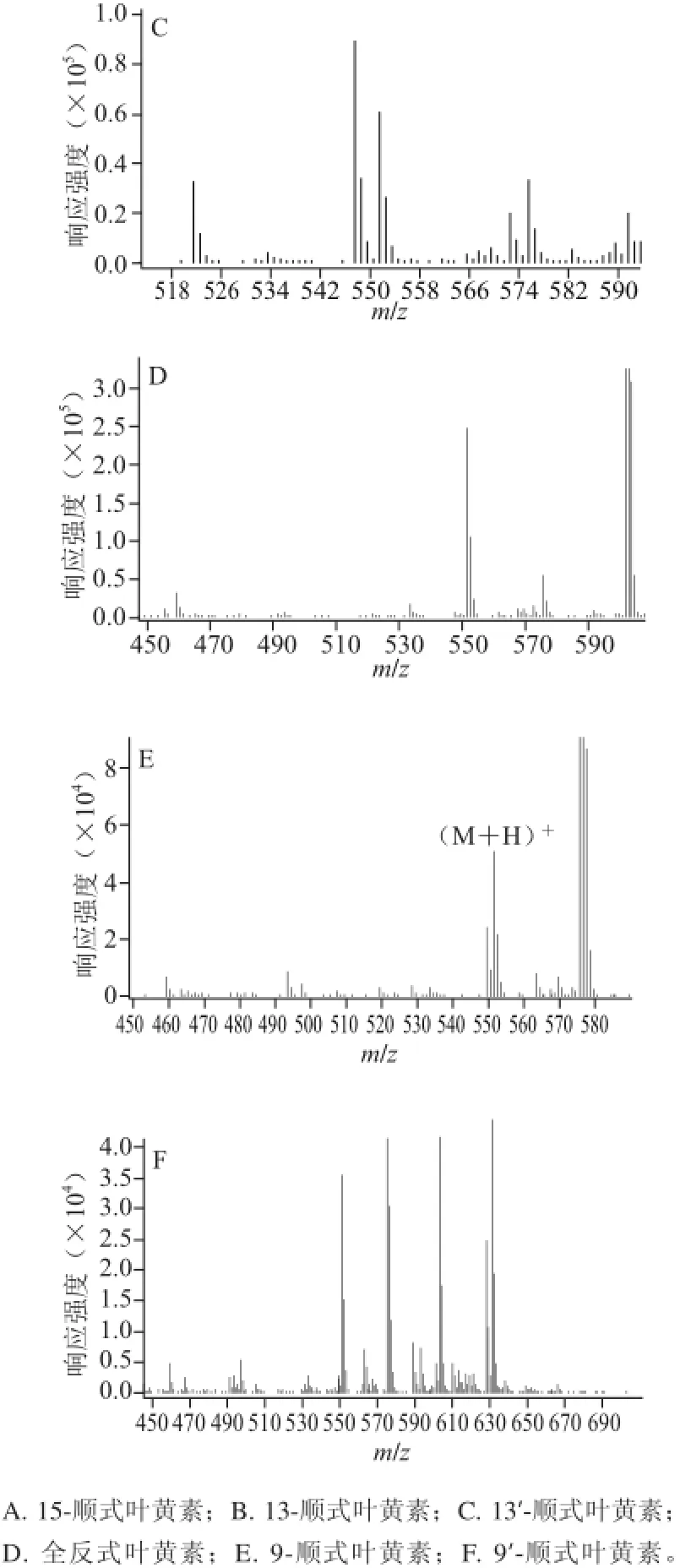
图5 全反式叶黄素及其顺式异构体质谱图Fig.5 Mass spectra of all-(E)-lutein and its (Z)-isomers
仅通过质谱图不能鉴定叶黄素异构体的种类,还需要结合这些化合物的紫外-可见光谱特性(图6)、Q值、Ⅲ/Ⅱ等参数及相应的文献值对其进行一一鉴定。
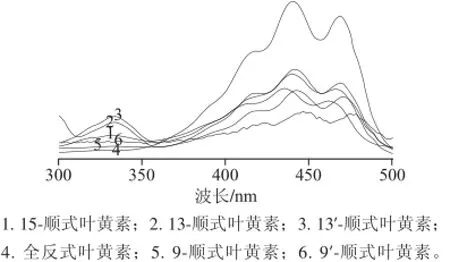
图6 高温异构化得到的全反式叶黄素及其顺式异构体的的光谱图Fig.6 Spectra of all-(E)-lutein and (Z)-isomers
从图3、4及峰4的光谱特性可确定,峰4为全反式叶黄素。通过以下程序对其顺式异构体进行初步的鉴定:首先,与全反式叶黄素相比,单顺式异构体的最大吸收波长通常有4~6 nm的蓝移,双顺式异构体则有8~12 nm的蓝移[16];其次,单顺式异构体在330~340 nm间有顺式吸收,且顺式双键越靠近分子的中心,其顺式吸收越大(通常用Q值来表示顺式吸收峰的强度);最后,叶黄素和β-胡萝卜素均为类胡萝卜素,都具有共同的异戊二烯结构,故它们相应位置异构体的洗脱顺序具有一致性。据此,根据图6和表1中物质的光谱特性初步鉴定峰1、2、3、5、6为单顺式异构体。
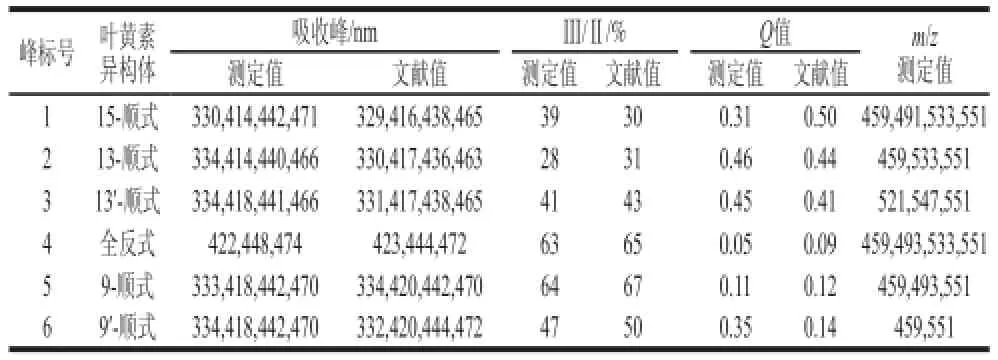
表1 样品中叶黄素异构体的鉴定Table 1 Identification of all-( )-lutein and its ( )-isomers
为进一步确定各个峰的归属,计算整理了各物质的最大吸收波长、Ⅲ/Ⅱ和Q值,并与相关报道进行对照。Koyama等[17]在分离全反式β-胡萝卜素及其顺式异构体时发现:1)它们最大吸收波长的大小顺序依次为全反式β-胡萝卜素>15-顺式-β-胡萝卜素>13-顺式-β-胡萝卜素;2)顺式吸收峰强度依次为15-顺式-β-胡萝卜素>13-顺式-β-胡萝卜素>全反式β-胡萝卜素。Aman等[18]采用DAD-HPLC-APCI-MS和NMR技术对13-顺式、13’-顺式、9-顺式和9’-顺式叶黄素进行鉴定。Bialek-Bylka等[19]分离鉴定了全反式叶黄素及其顺式异构体,发现它们最大吸收波长的变化规律为全反式叶黄素>9-顺式/9’-顺式叶黄素>13-顺式/13’-顺式叶黄素,而顺式峰吸收强度则呈现相反的顺序。将得出的数据与上述文献报道比较后发现结果具有高度的一致性,故可以确定峰1、2、3、5、6分别为15-顺式叶黄素、13-顺式叶黄素、13’-顺式叶黄素、9-顺式叶黄素和9’-顺式叶黄素,它们的结构图见图7。
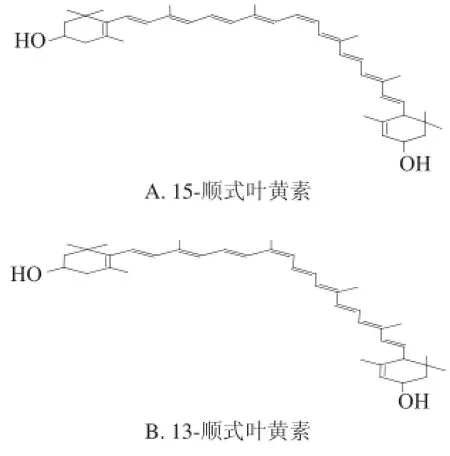
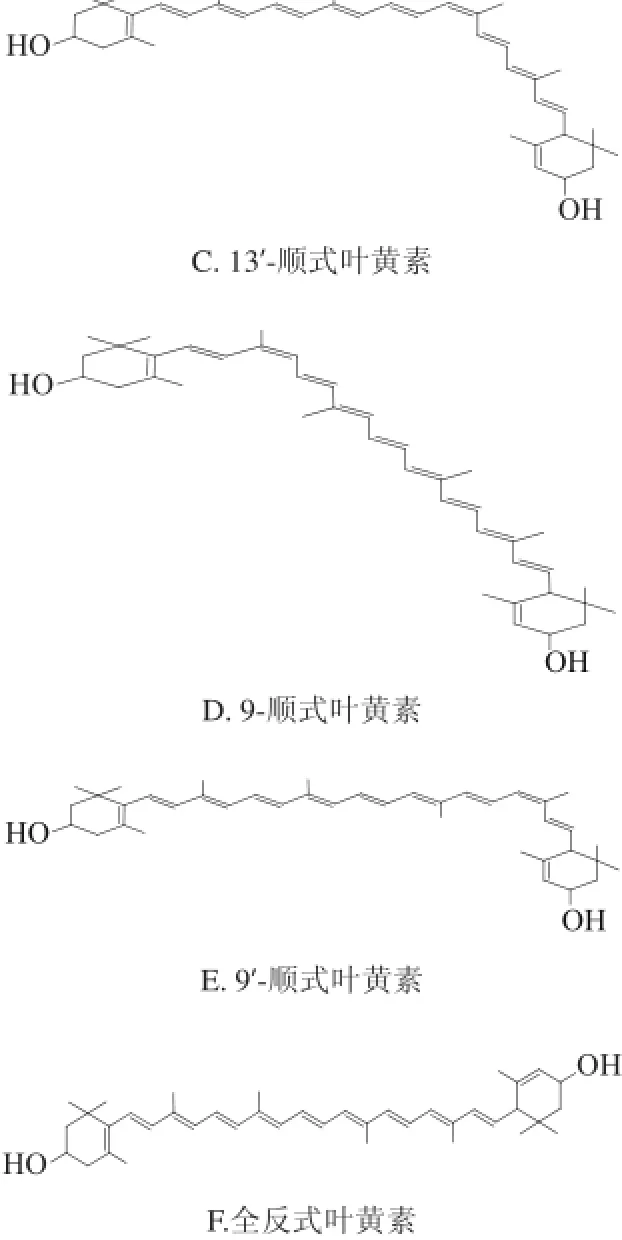
图7 鉴定出的全反式叶黄素及其异构体的化学结构Fig.7 Chemical structures of all-(E)-lutein and its isomers identified from sample
2.5 反式叶黄素的定量分析
分别取质量浓度为0.2、1、3、5、7、9、11、13 μg/mL的反式叶黄素标准液,采用建立的HPLC法检测,每个系列质量浓度进样3次,以进样量(ng)为横坐标、相应的吸收峰面积为纵坐标进行线性回归分析,得到反式叶黄素的标准曲线回归方程为Y=9.420 7X-10.127 7(R2=0.999 7)。反式叶黄素溶液质量浓度在0.2~13 μg/mL范围内(即含量在4~260 ng之间),其峰面积和进样量呈良好的线性关系。在3倍信噪比的条件下,使用二极管阵列检测器的最低检出限为2.4 ng。
2.6 加标回收率及精密度
计算得到的加标回收率良好,均在95%以上,其RSD小于3.1%,结果如表2所示。
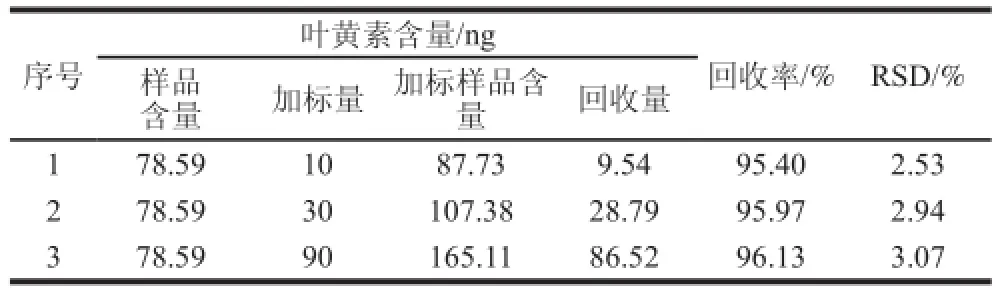
表2 加标回收率和RSD( =6)Table 2 Recoveries and relative standard deviations ( = 6) from spiked sample
叶黄素样品溶液中叶黄素含量RSD分别为0.94%、1.05%和0.57%,均小于2%,结果表明此方法的精密度很高。
2.7 稳定性
在-18 ℃条件下密封避光保存10 h内样品溶液中叶黄素含量RSD为1.39%,小于2%,结果表明在此条件下保存10 h内样品溶液稳定性良好。
3 结 论
建立了C30-HPLC-DAD-APCI-MS高效、快速检测叶黄素异构体方法,叶黄素热异构化样品中各物质在12 min内达到有效分离;准确地对全反式叶黄素及其异构体进行定性定量分析,确定出5 种叶黄素类化合物:15-顺式、13-顺式、13’-顺式、9-顺式、9’-顺式;绘制出全反式叶黄素的标准曲线Y=9.420 7X-10.127 7(R2=0.999 7),全反式叶黄素溶液质量浓度在0.2 ~13 μg/mL范围内(即含量在4~260 ng之间)峰面积和进样量呈良好的线性关系。该方法操作简单、灵敏度高,可用于监测加工、贮藏过程中叶黄素的顺、反异构化反应进程。
参考文献:
[1] 梁敏慧, 崔亚娟, 何梅, 等. 叶黄素分析检测方法研究进展[J]. 食品工业科技, 2015, 36(8): 390-394. DOI:10.13386/j.issn1002-0306.2015.08.073.
[2] 徐丽萍. 红蜜南瓜中叶黄素的超临界CO2流体萃取分离方法研究[J]. 中国食品学报, 2007, 7(3): 94-97. DOI:10.3969/ j.issn.1009-7848.2007.03.016.
[3] 陈万勤, 刘柱, 郑国钢, 等. 冷皂化-高效液相色谱法测定乳制品中叶黄素的5 种顺反式异构体[J]. 分析化学, 2015, 43(3): 404-408. DOI:10.11895/j.issn.0253-3820.140931.
[4] 樊继鹏, 徐振东, 余文静, 等. 乳粉中叶黄素的测定方法及稳定性的影响[J]. 包装与食品机械, 2014, 32(4): 20-23. DOI:10.3969/ j.issn.1005-1295.2014.04.005.
[5] RODRIGUEZ E B, RODRIGUEZ-AMAYA D B. Formation of apocarotenals and epoxycarotenoids from β-carotene by chemical reactions and by autoxidation in model ystems and processed foods[J]. Food Chemistry, 2007, 101: 563-572. DOI:10.1016/ j.foodchem.2006.02.015.
[6] DACHTLER M, GLASER T, KOHLER K, et al. Combined HPLC-MS and HPLC-NMR on-line coupling for the separation and determination of lutein and zeaxanthin stereoisomers in spinach and in retina[J]. Analytical Chemistry, 2001, 73(3): 667-674. DOI:10.1021/ac000635g.
[7] 李秀霞, 韩鲁佳. 玉米蛋白粉中反式叶黄素及主要顺式异构体的分离鉴定[J]. 中国农业大学学报, 2007, 12(4): 61-66. DOI:10.3321/ j.issn:1007-4333.2007.04.012.
[8] LAKSHMINARAVANA R, ARUNA G, SANGEETHA R, et al. Possible degradation/biotransformation of lutein in vitro and in vivo: isolation and structural elucidation of lutein metabolites by HPLC and LC-MS (atmospheric pressure chemical ionization)[J]. Free Radical Biology and Medicine, 2008, 45: 982-983. DOI:10.1016/ j.freeradbiomed.2008.06.011.
[9] MARX M, SCHIEBER A, CARLE R. Quantitative determination of carotene stereoisomers in carrot juices and vitamin supplemented (ATBC) Drinks[J]. Food Chemistry, 2000, 70: 403-408. DOI:10.1016/ S0308-8146(00)00096-0.
[10] 张艳, 惠伯棣, 裴凌鹏, 等. C30柱分离万寿菊花中的叶黄素类化合物初探[J]. 食品科学, 2006, 27(11): 424-428.
[11] QIU Dan, CHEN Zhirong, LI Haoran. Effect of heating on solid β-carotene[J]. Food Chemistry, 2009, 112(2): 344-349. DOI:10.1016/ j.foodchem.2008.05.071.
[12] CHEN B H, HUANG J H. Degradation and isomerization of chlorophyll a and β-carotene as affected by various heating and illumination treatments[J]. Food Chemistry, 1998, 62(3): 299-307. DOI:10.1016/S0308-8146(97)00201-X.
[13] LEE M T, CHEN B H. Stability of lycopene during heating and illumination in a model system[J]. Food Chemistry, 2002, 78: 425-432.
[14] 李大婧, 王闯, 徐爱琴, 等. 高效液相色谱法测定叶黄素顺、反异构体[J]. 食品科学, 2012, 33(22): 186-190.
[15] BENEVIDES C M J, VELOSO M C C, PAULA PEREIRA P A, et al. A chemical study of β-carotene oxidation by ozone in an organic model system and the identification of the resulting products[J]. Food Chemistry, 2011, 126(3): 927-934. DOI:10.1016/ j.foodchem.2010.11.082.
[16] REZANKA T, OLSOVSKA J, SOBOTKA M, et al. The use of APCIMS with HPLC and other separation techniques for identifi cation of carotenoids and related compounds[J]. Current Analytical Chemistry, 2009, 5(1): 1-25.
[17] KOYAMA Y, KITO M, TAKII T, et al. Confi guration of the carotenoid in the reaction centers of photosynthetic bacteria. Comparison of the resonance Raman spectrum of the reaction center of Rhodopseudomonas sphaeroides G1C with those of cis-trans isomers of β-carotene[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1982, 680(2): 109-118. DOI:10.1016/0005-2728(82)90001-9.
[18] AMAN R, BIEHL J, CARLE R, et al. Application of HPLC coupled with DAD, APcI-MS and NMR to the analysis of lutein and zeaxanthin stereoisomers in thermally processed vegetables[J]. Food Chemistry, 2005, 92(4): 753-763. DOI:10.1016/j.foodchem.2004.10.031.
[19] BIALEK-BYLKA G E, SAKANO Y, MIZOGUCHI T, et al. Centralcis isomers of lutein found in the major light-harvesting complex of photosystem Ⅱ(LHC IIb) of higher plants[J]. Photosynthesis Research, 1998, 56(3): 255-264. DOI:10.1023/A:1006090210001.
[20] KHACHIK F, BERNSTEIN P S, GARLAND D L. Identification of lutein and zeaxanthin oxidation products in human and monkey retinas[J]. Investigative Ophthalmology and Visual Science, 1998, 38(9): 1802-1811. DOI:10.1155/2015/430741.
[21] LEE H S, CASTLE W S, COATES G A. High-performance liquid chromatography for the characterization of carotenoids in the new sweet orange (early gold) grown in florida, USA[J]. Journal of Chromatography A, 2001, 913: 371-377. DOI:10.1016/S0021-9673(00)01029-3.
[22] MELENDEZ-MARTINEZ A J, STINCO C M, LIU C, et al. A simple HPLC method for the comprehensive analysis of cis/ trans (Z/E) geometrical isomers of carotenoids for nutritional studies[J]. Food Chemistry, 2013, 138(2): 1341-1350. DOI:10.1016/ j.foodchem.2012.10.067.
[23] ZEPKA L Q, MERCADANTE A Z. Degradation compounds of carotenoids formed during heating of a simulated cashew apple juice[J]. Food Chemistry, 2009, 117(1): 28-34. DOI:10.1016/ j.foodchem.2009.03.071.
[24] CRUPI P, MILELLA R A, ANTONACCI D. Simultaneous HPLCDAD-MS (ESI+) determination of structural and geometrica isomers of carotenoids in mature grapes[J]. Journal of Mass Spectrometry, 2010, 45: 971-980. DOI:10.1002/jms.1794.
A Method for Rapid Determination of Lutein and Its Stereoisomers
LI Dajing1,2, LIU Chunju1,2, XIAO Yadong1, PANG Huili1, LIU Chunquan1,2,*
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. National Vegetable Processing Technology R&D Sub-centers, Nanjing 210014, China)
This study aimed to establish a rapid method for the determination of lutein stereoisomers by high performance liquid chromatography-diode array detection (HPLC-DAD) combined with atmospheric pressure chemical ionization mass spectrometry (APCI-MS). Using a mobile phase composed of dichloromethane, acetonitrile and carbinol (20:30:50, V/V) at a fl ow rate of 1.0 mL/min, lutein and its stereoisomers were separated effectively with good shape and without tailing phenomenon. Lutein generated 15-, 13,13’- and 9,9’-mono-cis-lutein during thermal isomerization as identifi ed based on the maximum absorption wavelength, Q value, mass spectral characteristics and relevant literature data. Peak area and injection amount of lutein showed a good linear relationship in the range of 4–260 ng. The recovery rate was higher than 95%, and the relative standard deviations (RSDs) of both precision and stability were lower than 2%. The method has the advantage of good separation, high accuracy and repeatability.
lutein; stereoisomers; measurement
10.7506/spkx1002-6630-201604037
TS201.2
A
1002-6630(2016)04-0206-06
李大婧, 刘春菊, 肖亚冬, 等. 叶黄素及其顺式异构体的快速检测[J]. 食品科学, 2016, 37(4): 206-211. DOI:10.7506/ spkx1002-6630-201604037. http://www.spkx.net.cn
LI Dajing, LIU Chunju, XIAO Yadong, et al. A method for rapid determination of lutein and its stereoisomers[J]. Food Science, 2016, 37(4): 206-211. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604037. http://www.spkx.net.cn
2015-06-04
江苏省农业科学院基本科研业务专项(ZX(15)1008)
李大婧(1976—),女,研究员,博士,主要从事果蔬加工与综合利用研究。E-mail:lidajing@163.com
*通信作者:刘春泉(1959—),男,研究员,硕士,主要从事农产品精深加工与产业化开发研究。E-mail:liuchunquan2009@163.com
