T细胞因子4在胃癌细胞增殖凋亡中的作用研究
2016-11-11林明政沈国栋徐佳慧徐婷娟胡世莲
林明政,沈国栋,沈 干,徐佳慧,程 民,徐婷娟,胡世莲
T细胞因子4在胃癌细胞增殖凋亡中的作用研究
林明政1,沈国栋2,沈 干2,徐佳慧2,程 民2,徐婷娟2,胡世莲2
目的 研究T细胞因子4(TCF4)在胃癌细胞中的表达以及对胃癌细胞增殖及衰老、凋亡中的作用。方法 培养人胃癌细胞株MGC803、SGC7901、HSC44-PE、44As3、MKN45、NCI-N87以及人永生化胃黏膜上皮细胞株GES-1,使用Western blot法比较TCF4在各细胞之间的表达差异。选择其中TCF4表达高与低的细胞株,分别通过稳定转染TCF4表达质粒及dominant negative TCF4(dnTCF4)的方法上调与下调细胞TCF4表达,采用体外细胞增殖实验及实时无标记细胞检测分析(RTCA)等技术检测TCF4对胃癌细胞增殖与凋亡的影响。建立胃癌细胞裸鼠移植瘤模型,观察TCF4蛋白对胃癌移植瘤生长的影响。结果 TCF4在胃癌细胞中的表达高于对照GES-1细胞。胃癌细胞株按TCF4的表达量从高到低排列依次为NCI-N87、44As3、HSC44-PE、MGC803、MKN45、SGC7901。TCF4的表达与胃癌细胞的增殖能力呈正相关性,而与胃癌细胞的衰老、凋亡呈负相关性。结论 TCF4在胃癌细胞中呈高表达,其能促进胃癌细胞的增殖、抑制胃癌细胞的衰老及凋亡。
胃癌;TCF4;增殖;凋亡
胃癌是我国最常见的恶性肿瘤之一,其发生率和死亡率分别位居第二位和第三位[1-2]。Wnt信号通路是调控动物胚胎发育、细胞生长增殖的重要信号通路。既往研究[3-4]显示,Wnt信号通路的异常激活与肠癌等多种肿瘤的发生密切相关,但其在胃癌发生、发展中的作用仍不清楚。T细胞因子4(T cell factor 4,TCF4)是TCF家族的一员,其基因是TCF7L2(transcription factor 7-like 2),是Wnt信号通路中重要的信号分子[5-6]。该研究以TCF4为研究对象,探索其在胃癌细胞中的表达以及在增殖与衰老、凋亡中的作用。
1 材料与方法
1.1 材料
1.1.1 实验细胞 人永生化胃黏膜上皮细胞株GES-1、人胃腺癌细胞株MGC803、SGC7901、MKN45购自中科院上海细胞生物学研究所;人胃腺癌细胞NCI-N87购自中国医学科学院北京肿瘤细胞研究所;人胃癌细胞株44As3及HSC44-PE由日本名古屋大学武井佳史教授赠送。
1.1.2 质粒及菌株 pspax2、pMD2G质粒、DH-5α感受态E.coli由中国科技大学钟永军博士赠送;表达EF1alpha-dnhTcf4/SV40-PuroR质粒的EdTP菌种购自美国Addgene公司;TCF4全长序列表达质粒购自美国Origene公司。
1.1.3 实验动物 裸鼠(BALB/c-nu)购自北京维通利华实验动物技术有限公司,SPF级,22只,雌性,6~8周龄,饲养于安徽医科大学附属省立医院SPF级动物房中。
1.1.4 主要试剂 RPMI 1640培养基、胎牛血清(FBS)购自美国HyClone公司;胰酶消化液、RIPA裂解液、5×蛋白上样缓冲液、细胞衰老β-半乳糖苷酶染色试剂盒购自上海碧云天公司;蛋白酶抑制剂、蛋白磷酸酶抑制剂购自瑞士Roche公司;DMEM培养基、BCA试剂盒、化学发光显影液购自美国Thermo公司;β-actin、TCF4兔抗人单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG购自美国Cell Signaling Technology公司;Axyprep质粒DNA小量试剂盒购自美国Axygen公司;转染试剂LipofectamineTM2000购自美国Invitrogen公司。
1.2 方法
1.2.1 细胞培养 以上细胞解冻复苏后,培养于含10%FBS的RPMI 1640培养基中,置于37℃、5% CO2细胞培养箱内培养。
1.2.2 Western blot法检测 提取正常生长的GES-1、MGC803、SGC7901、NCI-N87、44As3、MKN45及HSC44-PE细胞总蛋白,BCA法测定各组蛋白浓度并用PBS调平,加入蛋白上样缓冲液煮沸5 min,经SDS-PAGE电泳分离后半干转至PVDF膜上,用5%脱脂牛奶室温条件下封闭1 h。一抗以兔抗人β-actin为内参,兔抗人TCF4为目的蛋白,4℃孵育过夜。以HRP标记的羊抗兔IgG作为二抗,使用化学发光凝胶成像系统成像检测各组细胞TCF4的差异表达。
1.2.3 质粒的扩增及提取 将待扩增的pspax2、pMD2G质粒分别转入DH-5α感受态E.coli中,按照质粒使用说明使用含有适量Ampicillin的LB固体培养基筛选菌株,在LB固体培养基中挑取单克隆菌落接种到LB液体培养基中,置于气浴摇床中37℃、200 r/min摇菌12~18 h。质粒的提取步骤如下:取10 ml转入质粒的菌液加入离心管中,10 000 r/min离心1 min,弃上清液;加入500 μl Buffer S1重悬细菌,再加入500 μl Buffer S2,温和并充分地上下翻转4~6次,使菌体充分裂解,室温放置5 min,直至溶液变得透亮黏稠;加入700 μl Buffer S3,上下翻转6~8次见形成白色絮状沉淀,10 000 r/ min离心10 min,吸取上清液加入到制备管中并将制备管置于收集管中,10 000 r/min离心1 min,弃滤液;将制备管放回收集管中,加入500 μl Buffer W1,10 000 r/min离心1 min,弃滤液;将制备管放回收集管中,加入700 μl Buffer W2,10 000 r/min离心1 min,弃滤液,重复上一步骤1次;将制备管放回收集管中,10 000 r/min离心1 min,取出制备管置于超净台中室温干燥30 min后,移入新的1.5 ml EP管中,加入60~80 μl Eluent或去离子水,室温静置1 min,10 000 r/min离心1 min收集扩增的质粒;分光光度计测定质粒浓度。
1.2.4 慢病毒包装及感染 包装慢病毒前1 d,在3.5 cm培养皿中接种适量密度的293T细胞,每个样品需要1×106个293T细胞。包装步骤如下:取1.5 ml灭菌EP管,加入2 μg EdTP、3 μg pspax2、1 μg pPD2G质粒以及250 μl的无血清培养基,轻柔混匀,室温孵育5 min;取1.5 ml灭菌EP管,取9 μl脂质体LP2000溶于250 μl无血清培养基中,轻柔混匀,室温孵育5 min;将DNA溶液和脂质体溶液轻柔混匀,室温孵育20 min;用胰酶消化并记数293T细胞并用含血清的培养基重悬细胞;在6孔板中每孔加入1 ml含血清的生长培养基,再加入DNA-脂质体复合物;将1 ml重悬的293T细胞(1×106个细胞/ml)加入到平板中,37℃、5%CO2细胞培养箱中孵育过夜;移除含有DNA-脂质体复合物的培养基,代之以DMEM培养基;转染后48~72 h取上清液,3 000 r/min离心20 min,取上清液即为病毒悬液。感染24 h前,分别在3.5 cm培养皿中接种适量密度的44As3、NCI-N87细胞(约2×105/ml),待细胞生长面积达50%~80%时即可用于慢病毒感染。取2 ml新鲜培养基替换原培养基,加入适量的慢病毒悬液,置于37℃、5%CO2细胞培养箱中培养24 h;更换新鲜培养基继续培养48~72 h后,加入purocymin进行筛选获得konck-down TCF4的44As3/dnTCF4、N87/dnTCF4细胞。
1.2.5 质粒转染 转染24 h前,在3.5 cm培养皿中接种适量密度的SGC7901细胞(约2×105/ml),待细胞生长面积达50%~80%时即可用于转染。配制溶液1:240 μl无血清培养基+10 μl LP2000,室温孵育5 min;溶液2:250 μl无血清培养基+2 μg TCF4表达质粒,室温孵育5 min;将溶液1与溶液2混合,室温下放置20 min;将6孔板中的细胞用无血清培养基冲洗细胞2遍后,加入2 ml无血清培养基;将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀;置于在37℃、5%CO2细胞培养箱中保温4~6 h;更换含有血清的全培养基,置于37℃、5%CO2细胞培养箱中培养24 h,按照1∶10接种到新的培养皿中继续培养,根据质粒使用说明书加入适量purocymin进行筛选获得knock-in TCF4的SGC/TCF4细胞。
1.2.6 细胞增殖实验 取对数期生长的SGC7901、SGC/TCF4、NCI-N87以及N87/dnTCF4细胞株,PBS清洗2遍,胰酶消化,细胞计数,按每个3.5 cm培养皿接种105个细胞,重复3次,分别在24、48、72 h时观察细胞生长状态并消化、计数,比较SGC/TCF4与对照SGC7901细胞,NCI-N87与对照N87/dnTCF4细胞的增殖能力。
1.2.7 实时无标记细胞检测技术(RTCA) RTCA是基于微电子传感技术,通过实时监测阻抗的变化来进行细胞增殖、转移、耐药等实时细胞分析[7]。在配套的E16孔板中每孔接种2×104个细胞,观察、比较SGC7901与SGC/TCF4以及NCI-N87与N87/dnTCF4的增殖情况。
1.2.8 细胞衰老检测 取对数期生长的SGC7901、SGC/TCF4、NCI-N87以及N87/dnTCF4细胞株,PBS清洗2遍,胰酶消化,细胞计数,按每个3.5 cm培养皿接种5×103个细胞,48 h后参考文献[8]使用细胞衰老β-半乳糖苷酶染色试剂盒染色,选择3个不同视野统计阳性细胞。
1.2.9 裸鼠成瘤实验 裸鼠经适应性饲养1周后进行试验。取预先培养呈对数期生长的胃癌细胞消化,1 000 r/min离心,PBS重悬使细胞密度达到1× 107/ml,裸鼠胁部皮下接种0.1 ml,每种胃癌细胞接种6只裸鼠,待细胞成瘤后用游标卡尺每周测量2次肿瘤体积,比较上调TCF4表达的SGC/TCF4与对照组SGC7901、下调TCF4表达的44As3/dnTCF4与对照组44As3的肿瘤生长情况。
1.3 统计学处理 采用SPSS 16.0软件进行分析,多组样本均数的比较采用单因素方差分析,方差齐者采用LSD-t检验,方差不齐者采用Games-Howell检验。
2 结果
2.1 TCF4在胃癌细胞中表达 TCF4在胃癌细胞中的表达要高于对照GES-1细胞,胃癌细胞按TCF4表达量从高到低表达排列依次为NCI-N87、44As3、HSC44-PE、MGC803、MKN45、SGC7901(图1A)。
2.2 TCF4促进胃癌细胞增殖 通过质粒转染等手段,建立knock-in TCF4的SGC/TCF4及knockdown TCF4的N87/dnTCF4细胞系,Western blot法证实TCF4在SGC/TCF4表达升高、在N87/dn TCF4表达降低(图1B、1C)。细胞增殖实验结果显示TCF4调高组细胞SGC/TCF4相较于SGC7901细胞,其增殖能力明显提高(图2A),而TCF4调低组细胞N87/dnTCF4相较于NCI-N87细胞,其增殖能力明显降低(图2B);这一结果也在RTCA实验中得到进一步证实(图2C、2D)。

图1 TCF4在胃癌细胞中表达

图2 TCF4促进细胞增殖
2.3 TCF4抑制胃癌细胞衰老与凋亡 细胞培养过程显示,相较于NCI-N87细胞,N87/dnTCF4细胞出现更多的凋亡细胞;而在SGC7901与SGC/TCF4对照中,SGC/TCF4细胞出现更多的多伪足状细胞,提示其有更高的活力及迁移能力(图3)。为了证实TCF4是否能抑制胃癌细胞的衰老和凋亡,选用细胞衰老β-半乳糖苷酶染色试剂盒进行染色,结果提示N87/dnTCF4细胞染色阳性率明显高于NCI-N87细胞,SGC/TCF4细胞染色阳性率明显低于SGC7901细胞(P<0.05)(图4)。
2.4 TCF4促进胃癌裸鼠移植瘤生长 按照实验方法1.2.9建立裸鼠移植瘤模型,10 d后结果显示所有接种点均成瘤,生长14 d肿瘤体积测量结果显SGC/TCF4细胞移植瘤体积显著大于对照SGC7901移植瘤,而44As3/dnTCF4移植瘤体积显著小于44As3移植瘤(图5),从而证明TCF4能促进胃癌细胞裸鼠移植瘤的生长。

图3 胃癌细胞在含20%FBS的培养基中培养10 d后细胞形态学改变 ×100

图4 衰老细胞β-半乳糖苷酶染色 ×200
3 讨论
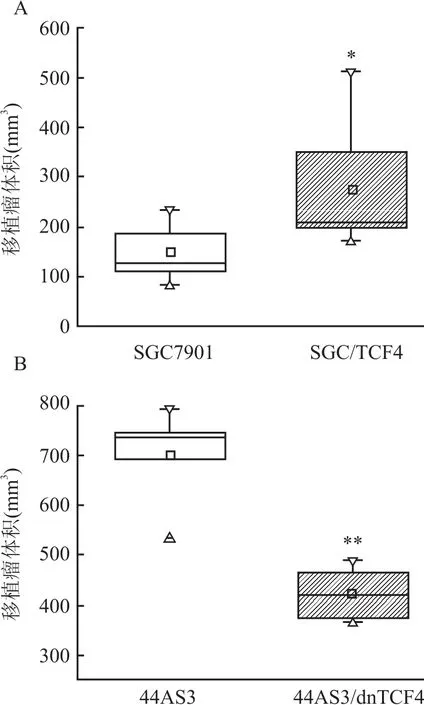
图5 胃癌细胞裸鼠移植瘤14 d生长情况
胃癌是严重危害人类身心健康的恶性肿瘤,然而由于其早期临床症状表现不明显,且缺乏特异有效的生物标志物,目前仅有少数患者能得到早期诊断及治疗[9-10]。因此,深入研究胃癌的发生、发展机制,对胃癌的早期诊断及治疗具有重要意义。Wnt信号通路是一条在进化上高度保守的信号通路,其活性受多种蛋白调节,而其中TCF4蛋白是Wnt信号通路的关键调节因素之一,表现为当Wnt蛋白与细胞膜表面的Frizzled家族跨膜蛋白(FZ)受体以及低密度脂蛋白受体相关蛋白结合时,可引起β-catenin在细胞质内大量聚集并进入细胞核,入核的β-catenin与TCF4结合形成β-catenin-TCF4复合物,激活Wnt信号通路下游诸如原癌基因c-Myc、细胞周期蛋白D1(cyclin D1)等在内的一系列靶基因[3,5-6]。既往的研究已经证实Wnt信号通路的异常激活与肠癌等多种肿瘤的发生密切相关,而这其中TCF4的异常表达在这一过程中发挥着重要作用,Chen et al[11]报道TCF4能直接与LIN28B基因的内含子结合并促进LIN28B基因的表达,增强人乳腺癌、肺癌细胞的干细胞潜能,促进人乳腺癌、肺癌的生长与转移;研究[12]表明分化诱导因子-1能通过降低TCF4表达抑制人乳腺癌与宫颈癌裸鼠移植瘤的生长。
本实验以Wnt信号通路的关键蛋白TCF4为研究对象,结果显示TCF4在胃癌细胞中的表达量明显高于胃黏膜上皮细胞,这与课题组在临床标本中的检测结果一致。选取TCF4表达最高NCI-N87、44As3细胞及表达最低的SGC7901细胞,通过慢病毒包装及质粒转染手段分别获得TCF4调高组细胞SGC/TCF4及调低组细胞N87/dnTCF4、44As3/ dnTCF4,体外细胞增殖实验及RTCA实验结果显示SGC/TCF4细胞增殖能力明显高于SGC7901细胞,N87/dnTCF4细胞增殖能力明显低于N87细胞,差异有统计学意义;镜下形态学观察及细胞衰老染色显示N87/dnTCF4细胞染色阳性率高于NCI-N87细胞,SGC/TCF4细胞染色阳性率明显低于SGC7901细胞;之后通过建立裸鼠荷瘤模型,观察比较胃癌细胞在体内生长情况,14 d结果显示SGC/TCF4组肿瘤体积明显大于SGC7901组,44As3/dnTCF4组肿瘤体积明显小于44As3组。
[1] Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3] Klaus A,Birchmeier W.Wnt signalling and its impact on development andcancer[J].Nat Rev Cancer,2008,8(5):387-98.
[4] Mao J,Fan S,Ma W,et al.Roles of Wnt/β-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment[J].Cell Death Dis,2014,5:e1039.
[5] MacDonald B T,Tamai K,He X,et al.Wnt/β-Catenin signaling:components,mechanisms,and diseases[J].Dev Cell,2009,17(1):9-26.
[6] Daniels D L,Weis W I.Beta-catenin directly displaces Groucho/ TLE repressors from Tcf/Lef in Wnt-mediated transcription activation[J].Nat Struct Mol Biol,2005,12(4):364-71.
[7] Kho D,MacDonald C,Johnson R,et al.Application of xCELLigence RTCA biosensor technology for revealing the profile and window of drug responsiveness in real time[J].Biosensors(Basel),2015,5(2):199-222.
[8] He Q,Gao Q,Ge S,et al.Axitinib alone or in combination with chemotherapeutic drugs exerts potent antitumor activity against human gastric cancercells in vitro and in vivo[J].J Cancer Res Clin Oncol,2014,140(9):1575-83.
[9] Society A C.Global cancer facts and figures,2nd edition[R]. Atlanta:American Cancer Society,2011.
[10]Foo M,Crosby T,Rackley T,et al.Role of(chemo)-radiotherapy in resectable gastric cancer[J].Clin Oncol,2014,26(9):541-50.
[11]Chen C,Cao F,Bai L,et al.IKKβ enforces a LIN28B TCF7L2 positive feedback loop that promotes cancer cell stemness and metastasis[J].Cancer Res,2015,75(8):1725-35.
[12]Takahashi-Yanaga F,Yoshihara T,Jingushi K,et al.DIF-1 inhibits tumor growth in vivo reducing phosphorylation of GSK-3β and expressions of cyclin D1 and TCF7L2 in cancer model mice[J]. Biochem Pharmacol,2014,89(3):340-8.
Effects of T cell factor 4(TCF4)on the proliferation and apoptosis in gastric cancer cells
Lin Mingzheng1,Shen Guodong2,Shen Gan2,et al
(1Dept of Geriatrics,Anhui Provincial Hospital Affiliated to Anhui Medical University,
2Anhui Provincial Key Laboratory of Tumor Immunotherapy and Nutrition Therapy,Hefei 230001)
Objective To research the expression of T cell factor 4(TCF4)and the function of proliferation,senescence and apoptosis in gastric cancer cells.Methods Human gastric cancer cell lines MGC803,SGC7901,HSC44-PE,44As3,MKN45,NCI-N87 and immortalized human gastric epithelial cell line GES-1 were cultured and the differential expressions of TCF4 among them were detected by Western blot analysis,then TCF4 expression and dominant negative TCF4 plasmid were transfected into the lowest and highest one respectively.The influence of TCF4 in vitro cells was tested by cell proliferation assay and RTCA.Meanwhile,the model of nude mice bearing tumor was established to detect the effect in vivo.Results The expression of TCF4 in gastric cancer cells was higher than the control GES-1,the highest one was NCI-N87,followed by 44As3,HSC44-PE,MGC803,MKN45 and SGC7901.TCF4 was positively correlated with proliferation,and negatively associated with senescence,apoptosis in gastric cancer cells.Conclusion TCF4 is overexpressed in gastric cancer cells.It could promote the proliferation,inhibit the senescence and apoptosis of gastric cancer cells.
gastric cancer;TCF4;proliferation;apoptosis
R 730.2;R 735.2
A
1000-1492(2016)08-1092-05
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.008.html
2016-04-15 接收
国家自然科学基金(编号:81071808);安徽省自然科学基金(编号:1408085MH167);安徽省科技计划项目(编号:1301042094)
1安徽医科大学附属省立医院老年病科,老年医学研究所,合肥 230001
2肿瘤免疫与营养治疗安徽省重点实验室,合肥 230001作者简介:林明政,男,硕士研究生;
胡世莲,女,教授,博士生导师,责任作者,E-mail:hushilian @126.com
