四乙基双三嗪吡啶与二酰胺荚醚在硝酸介质中对Am(Ⅲ)/Eu(Ⅲ)的协同萃取
2016-11-11曹石巍谈存敏
曹石巍,谈存敏,3,张 鑫,3,秦 芝
1.中国科学院 近代物理研究所,甘肃 兰州 730000;2.中国科学院大学,北京 100049;3.兰州大学 核科学与技术学院,甘肃 兰州 730000
四乙基双三嗪吡啶与二酰胺荚醚在硝酸介质中对Am(Ⅲ)/Eu(Ⅲ)的协同萃取
曹石巍1,2,谈存敏1,2,3,张鑫1,2,3,秦芝1,*
1.中国科学院 近代物理研究所,甘肃 兰州730000;2.中国科学院大学,北京100049;3.兰州大学 核科学与技术学院,甘肃 兰州730000
以四乙基双三嗪吡啶(C2-BTP)和四种不同链长的N,N,N′,N′-四烷基-3-氧-戊二酰胺(酰胺荚醚:DGA)作为萃取剂、1,2-二氯乙烷作为稀释剂,在硝酸体系中研究了对Am(Ⅲ)和Eu(Ⅲ)的协同萃取行为。结果表明,长链DGA与C2-BTP具有良好的协萃效应,在水相酸度为1.0 mol/L、盐析剂浓度为1.0 mol/L时,C2-BTP与六个碳链DGA(C6-DGA)的混合萃取剂摩尔比为3∶1时, Am(Ⅲ)和Eu(Ⅲ) 的分配比(D)比单独使用C2-BTP提高一倍以上, Am(Ⅲ)与Eu(Ⅲ)的分离因子(SF)最高值约为21。利用斜率法分别确定了各个DGA作为单一萃取剂萃取Am(Ⅲ)和Eu(Ⅲ)的平均配位数约为1.5,表明氯代溶剂可能与DGA的配位氧原子发生了相互作用,影响了DGA对Am(Ⅲ)和Eu(Ⅲ)的配位性能。
溶剂萃取;镧锕分离;三嗪吡啶;酰胺荚醚;协同萃取
核燃料后处理中产生了大量的高放废液,高放废液放射性强、毒性大,它的处理处置是影响核能可持续发展的关键因素,而分离嬗变技术是解决高放废液处理处置最有前景的技术之一。该技术首先通过分离技术将高放废液中长寿命放射性核素分离出来,再通过嬗变技术将长寿命放射性核素转化为短寿命或稳定核素,从而解决高放废液的处理处置问题。加速器驱动的次临界系统(accelerator driven sub-critical system, ADS)是以加速器产生的高能强流质子束轰击靶核产生散裂中子作为外源中子,驱动和维持次临界堆芯中的核嬗变反应,能够将长寿命放射性核素嬗变成短寿命核素或稳定核素,被认为是目前最有效的嬗变技术途径之一[1-2]。通过ADS技术可以将从高放废液中分离出来的次锕系元素(MAs)如Am、Np、Cm等转变成短寿命或稳定的核素,从而达到嬗变的目的。然而,高放废液中镧系元素的中子吸收截面很高,其含量远大于锕系元素,因此在嬗变之前必须进行锕系元素和镧系元素的分离[3],提高嬗变的效率。
近年来,用于三价镧系和锕系元素分离的萃取剂主要集中在含有S或N的软配体类化合物上。在较高酸度的硝酸(>1 mol/L)体系中,众多含N配体的萃取剂都被证明对三价镧系和锕系元素有分离效果。其中具有代表性的是Case等[4]率先报道的双三嗪吡啶(BTP)类化合物。其中,四乙基双三嗪吡啶(C2-BTP)作为典型代表,对三价镧系及锕系元素具有较好的分离效果。然而,C2-BTP在一些有机溶剂中的溶解性不高,萃取容量低,且稳定性和耐酸性较弱[4],这些缺点降低了C2-BTP的实用价值。
二酰胺荚醚(N,N,N′,N′-四烷基-3-氧-戊二酰胺,DGA)类化合物最早由德国的Stephan[5]首先报道并用于金属离子的萃取,并在随后的研究中被作为萃取分离镧系和锕系元素的萃取剂。该类化合物对三价镧系和锕系具有较强的萃取能力,耐酸性强,在有机溶剂中溶解性好,合成简单,无毒,但选择性差,不易反萃,且在某些体系中易形成三相[6]。
与单一萃取剂的萃取相比,协同萃取是一种更为有效的方法,它具有萃取效率高、动力学快、萃合物结构稳定等优点[7]。如果考虑将C2-BTP和DGA结合进行协同萃取,发挥各自的优点,有可能同时解决上述问题。有关C2-BTP与DGA协同萃取的研究目前未见报道。本工作拟基于现有文献的基础上合成C2-BTP[4]及四种具有不同碳链长度的对称二酰胺荚醚(N,N,N′,N′-四正丁基-3-氧-戊二酰胺,TBDGA,简称C4-DGA;N,N,N′,N′-四正己基-3-氧-戊二酰胺,THDGA,简称C6-DGA;N,N,N′,N′-四正辛基-3-氧-戊二酰胺,TODGA,简称C8-DGA;N,N,N′,N′-四正癸基-3-氧-戊二酰胺,TDDGA,简称C10-DGA)[2,5-6],在硝酸介质中研究C2-BTP与DGA的混合萃取剂对三价Am(Ⅲ)和Eu(Ⅲ)的协萃性能。
1 实验部分
1.1材料与仪器
2,2′-氧化二乙酰氯,纯度为95%,美国Sigma-Aldrich公司;二正己胺,纯度为98%,萨恩化学技术(上海)有限公司;1,2-二氯乙烷,纯度大于95.0%,东京化成工业株式会社;241Am+152Eu示踪剂原液由中国科学院近代物理研究所提供,示踪剂浓度约为10-6mol/L。其余试剂均为分析纯。
GEM-30200-P HPGe-γ高纯锗探测器,探测效率约30%,DSPEC-502TM数字化γ谱仪,在1 332.5 keV能量分辨率(FWHM)为1.70 keV,EG&G Ortec公司;TS-R0-10L/H型反渗透超纯水机,东莞奇泉水处理设备有限公司;THZ-300C型恒温培养摇床,上海一恒科学仪器有限公司;XiangYi L600型低速自动平衡离心机,长沙湘仪离心机仪器有限公司;Advance Ⅲ 400 MHz 核磁共振谱仪、VERTEX 70型傅立叶变换红外光谱仪、ESI-四级杆-飞行时间质谱仪,Bruker公司。
1.2萃取剂的合成
C2-BTP依照文献[8]的方法合成,合成路线示于图1。
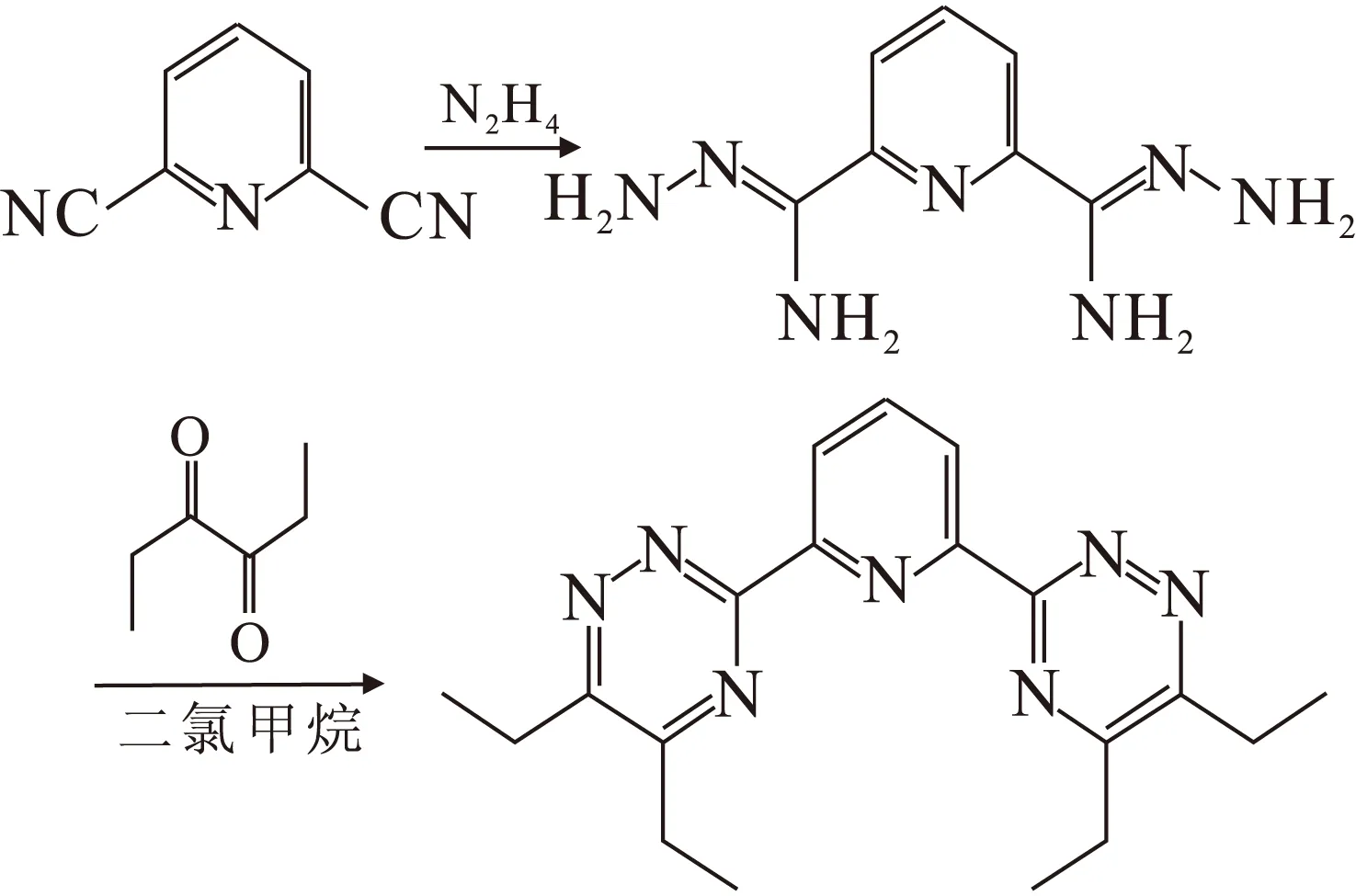
图1 C2-BTP的合成路线Fig.1 Synthetic route of C2-BTP
DGA依照文献[9]的一步合成法合成,合成路线示于图2。
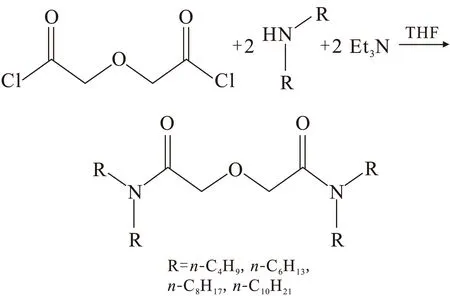
图2 DGA的合成路线Fig.2 Synthetic route of DGA
在DGA的众多合成方法中,该方法操作简便,产率高(>90%),反应时间短,且少量杂质可以使用简单方法完全除去[9]。采用红外(IR)、核磁(NMR)和质谱(MS)对上述合成产品进行了表征。1H NMR和ESI-MS的结果如下。
C4-DGA(δ):0.982(12H,t,—CH3),1.328(8H,m,—CH2—CH3),1.515(8H,m,—N—CH2—CH2—),3.00~3.40(8H,t,—N—CH2—),4.20~4.30(4H,s,—CH2—O—)。ESI-MS(m/z):357.3(M+H+)。
C6-DGA(δ):0.882(12H,t,—CH3),1.287(24H,m,—CH2—(CH2)3—CH3),1.523(8H,m,—N—CH2—CH2—),3.00~3.40(8H,t,N—CH2—),4.307(4H,s,—CH2—O—)。ESI-MS(m/z):469.3(M+H+)。
C8-DGA(δ):0.885(12H,t,—CH3),1.273(40H,m,—N—CH2—CH2—(CH2)5—CH3),1.578(8H,m,—N—CH2—CH2—(CH2)5—CH3),3.00~3.40(8H,t,—N—CH2—),4.20~4.30(4H,s,—CH2—O—)。ESI-MS(m/z):581.6(M+H+),603.5(M+Na+)。
C10-DGA(δ):0.882(12H,t,—CH3),1.287(56H,m,—N—CH2—CH2—(CH2)7—CH3),1.523(8H,m,—N—CH2—CH2—(CH2)7—CH3),3.00~3.40(8H,t,—N—CH2—CH2—(CH2)7—CH3),4.20~4.30(4H,s,—CH2—O—)。ESI-MS(m/z):693.7(M+H+)。
C2-BTP(δ):8.76~8.78(2H,d),8.10~8.14(1H,t),3.10~3.16(4H,m),3.00~3.05(4H,m),1.45~1.49(12H,m)。ESI-MS(m/z):350.3(M+H+)。
由NMR及ESI-MS表征数据可知,所合成各化合物纯度达到99%,满足萃取实验要求。
1.3萃取实验
分别称取一定质量的C2-BTP及DGA,用选定的稀释剂稀释定容,配成0.1 mol/L的溶液。取一定量溶液稀释至所需浓度作为有机相。另取一定量的HNO3、NaNO3溶液,加入含有241Am+152Eu示踪剂的原液,用去离子水稀释至所需浓度作为水相。分别取600 μL水相和600 μL有机相于一次性塑料离心试管,置于恒温振荡器中,在(293±1) K下以57 r/min振荡60 min至平衡,3 000 r/min离心分相后,取有机相与水相分别置于HPGe-γ探头前进行测量,在得到的γ能谱图中,分别对241Am、152Eu在59.5、121.7 keV处的特征峰进行高斯拟合,得到有机相和水相对应的峰面积Ao及Aw,以扣去本底Ab的峰面积作为两种核素的定量依据。由公式(1)计算分配比(D)。
(1)
Am与Eu的分离因子SF由二者D值之比得出。
协萃系数R为协萃的分配比与单独萃取的分配比加和(Ds)的比值[10],即:
(2)
其中:D(DGA)为只有DGA时的分配比;D(BTP)为只有BTP时的分配比;x(DGA)为DGA在混合萃取剂总浓度中的摩尔百分比。R>1表示协同效应,R<1表示反协同效应,R=1表示无协同效应。
2 结果与讨论
2.1稀释剂的选择
选择了几种常见的稀释剂进行溶解性试验,并列出了Kamlet-Taft所给出的溶剂极性参数π*[11-12],结果列入表1。其中,π*是一个衡量溶剂的极性和极化度的参数,其值越大,说明分子间的偶极-偶极相互作用越强,溶剂的溶解能力也越强[13]。由表1可知,C2-BTP在极性参数较大的1,2-二氯乙烷(π*= 0.807)和硝基苯(π*= 1.029)中溶解性较好,在正辛醇中溶解度较低,在极性参数小的正己烷(π*=-0.081)、环己烷(π*=0)中不溶;而DGA在几种溶剂里均能很好的溶解,溶解度能够满足萃取实验的要求。本工作选用对两种萃取剂溶解性好的1,2-二氯乙烷作为后续实验的稀释剂。
2.2C2-BTP和DGA的协萃效应
对于该协萃体系,在相同条件下,保持萃取剂总浓度不变,改变DGA的摩尔分数,以lgD对x(DGA)作协萃图[10],结果示于图3。为了便于对图3中各个萃取体系进行比较,最好利用协萃系数R进行归一化。由图3中得到的各个浓度Am(Ⅲ)和Eu(Ⅲ)的D值计算得到相应的协萃系数R,结果示于图4。
表1不同稀释剂中萃取剂的极性参数与溶解性
Table 1Polarity parameters and solubilities of the extractants in different diluents

溶剂极性参数π*[11-12]C2-BTP饱和浓度/(mol·L-1)DGA饱和浓度/(mol·L-1)正辛醇-≈0.01均大于0.1硝基苯1.029≈0.1正己烷-0.081<0.001环己烷0<0.0011,2-二氯乙烷0.807>0.1
从图4可以看出,C2-BTP/C4-DGA在1.0 mol/L HNO3及1.0 mol/L NaNO3介质中萃取Am(Ⅲ)和Eu(Ⅲ)时,对二者均有明显的反协同效应(R<1),而C2-BTP/C8-DGA对二者具有明显的协同效应(R>1)。 C2-BTP/C6-DGA和C2-BTP/C10-DGA两种体系对Am(Ⅲ)而言,在低DGA浓度下具有协同效应,在高DGA浓度具有反协同效应;对Eu(Ⅲ)而言,C2-BTP/C6-DGA在低浓度下无明显协同效应,在高浓度下有强协同效应;C2-BTP/C10-DGA则具有弱协同效应。
由于C2-BTP的D(Am)>D(Eu),DGA的D(Am)≈D(Eu),在进行分离实验时,C2-BTP对分离起主要作用,故选择对Am(Ⅲ)的R值较高,同时对Eu(Ⅲ)的R值较低的体系及相应的萃取剂浓度,才能在提高D值的同时保持良好的选择性。
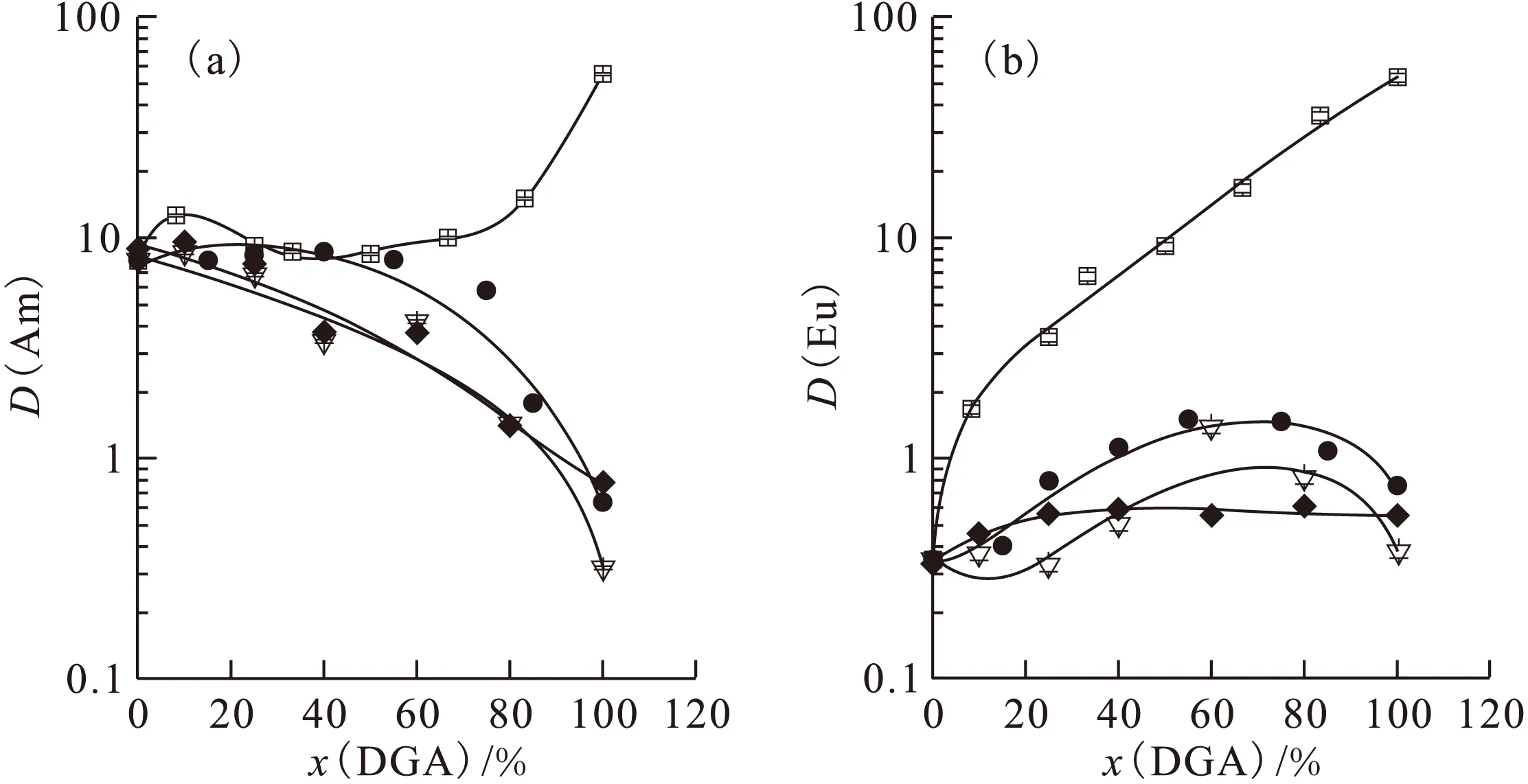
水相:1.0 mol/L HNO3+1.0 mol/L NaNO3+241Am(Ⅲ)+152Eu(Ⅲ),293 K□——C4-DGA,▽——C6-DGA,●——C8-DGA,◆——C10-DGA图3 C2-BTP/DGA萃取剂组成对D(Am)(a)和D(Eu)(b)的影响Fig.3 Effect of composition on D(Am)(a) and D(Eu)(b) in C2-BTP/DGA system
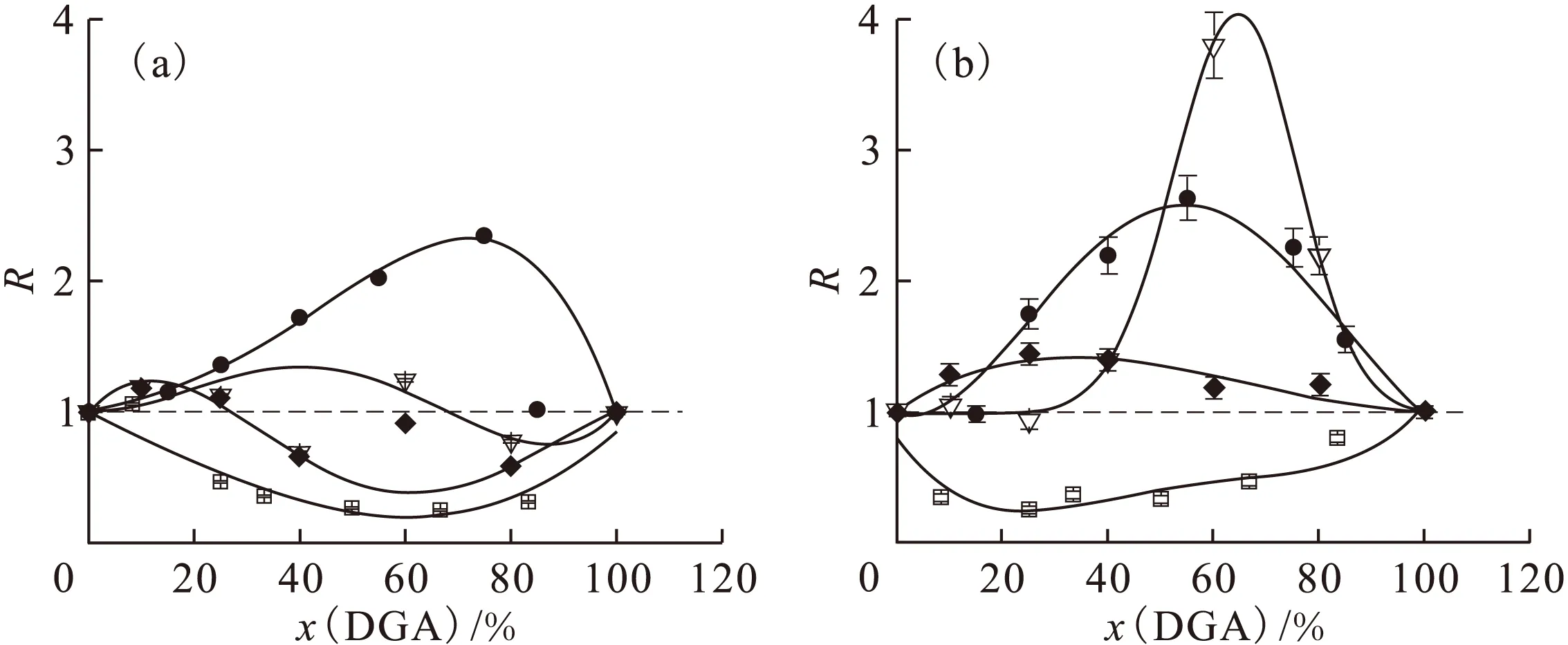
□——C4-DGA,▽——C6-DGA,●——C8-DGA,◆——C10-DGA图4 萃取剂组成对Am(Ⅲ)(a)和Eu(Ⅲ)(b)的协萃系数R的影响Fig.4 Effect of composition on the synergistic coefficients(R) of Am(Ⅲ)(a) and Eu(Ⅲ)(b)
表2给出了在c(HNO3) = 1.0 mol/L,c(NaNO3)=1.0 mol/L条件下,两种萃取剂单独及混合使用时的D值及SF值。通过比较可以看出,以C2-BTP作为萃取剂,C6-DGA作为协萃剂,两者摩尔比为3∶1时,D(Am)和D(Eu)值均比单独使用C2-BTP时提高一倍以上,同时保持了C2-BTP的高选择性,表明该体系对Am(Ⅲ)和Eu(Ⅲ)的萃取分离效果最佳。因此,加入特定的链长及较低浓度的DGA,有助于改善C2-BTP的萃取性能,同时保持良好的选择性;加入较高浓度长链DGA,可以使分配比适当降低。选择合适碳链长度和合适浓度的DGA,不仅可以保证对锕系元素的萃取率,也可以改善负载有机相中三价镧系和锕系的反萃效果[14]。
表2加入不同萃取剂后Am(Ⅲ)与Eu(Ⅲ)的D值及SF值对比
Table 2Distribution ratios and SF values of Am(Ⅲ) and Eu(Ⅲ) with different extractants
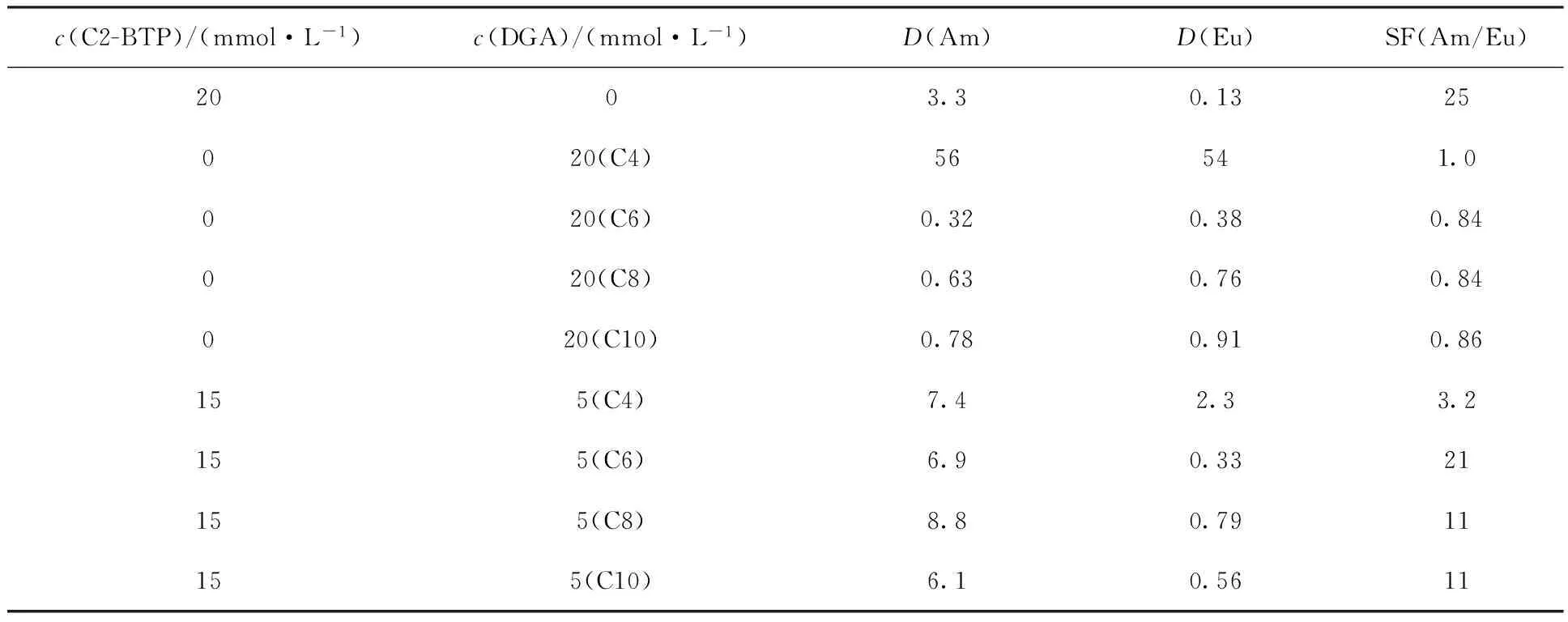
c(C2-BTP)/(mmol·L-1)c(DGA)/(mmol·L-1)D(Am)D(Eu)SF(Am/Eu)2003.30.1325020(C4)56541.0020(C6)0.320.380.84020(C8)0.630.760.84020(C10)0.780.910.86155(C4)7.42.33.2155(C6)6.90.3321155(C8)8.80.7911155(C10)6.10.5611
注:水相:1.0 mol/L HNO3+1.0 mol/L NaNO3+241Am(Ⅲ)+152Eu(Ⅲ), 293 K
2.3水相初始酸度对分配比的影响
在恒温(293±1) K条件下,考察了不同体系下酸度对Am(Ⅲ)和Eu(Ⅲ)分配比的影响。结果示于图5。由图5可知,C2-BTP/C4-DGA表现出与其它三种体系不同的行为:在相同条件下,该体系对两种金属离子的萃取能力高于其他三种长链萃取剂,且随着酸浓度的增大,其对Am(Ⅲ)和Eu(Ⅲ)的D值均在酸度为2.0 mol/L附近达到峰值,而后呈现非常缓慢下降的趋势。C6-DGA、 C8-DGA和C10-DGA分别和C2-BTP对Am(Ⅲ)及Eu(Ⅲ)的萃取能力随硝酸浓度的变化趋势相似:其中Am(Ⅲ)分配比随着硝酸浓度的增加先表现出增大的趋势,三种体系分别在酸度为1.0、1.5、2.0 mol/L附近达到峰值,随后出现明显下降,下降原因可能是C2-BTP发生不同程度的酸解,造成自由C2-BTP配体浓度降低所致[8];对Eu(Ⅲ)而言,由于酸度的增加导致C2-BTP的酸解程度增加,DGA对Eu(Ⅲ)的萃取效果逐渐增强,三种体系最高D值对应的酸浓度分别出现在2.5、2.0、1.5 mol/L附近。从分离因子来看,四种体系的SF值均随着酸度的增加而减小,其中C2-BTP/C4-DGA的SF值明显小于其它体系,而另外三个体系中,随着链长的增加,萃取Am(Ⅲ)的最佳酸度得到提高,而萃取Eu(Ⅲ)的最佳酸度降低。

有机相:0.005 mol/L DGA+0.015 mol/L C2-BTP + C2H4Cl2;水相:HNO3+1.0 mol/L NaNO3+241Am(Ⅲ)+152Eu(Ⅲ),293 K□——C4-DGA,▽——C6-DGA,●——C8-DGA,◆——C10-DGA图5 水相初始酸度对C2-BTP/DGA体系D(Am)(a)、D(Eu)(b)及SF(c)的影响Fig.5 Effect of initial nitric acid concentration on the distribution ratios of Am(a), Eu(b) and the separation factor(SF)(c) in C2-BTP/DGA system
此外,受空间位阻效应的影响,仅有DGA存在时,金属离子的D值随着DGA碳链长度的增加而逐渐减小[9];而从实验现象来看,协萃体系中C4-DGA对应的D值明显大于其它三者,碳链长度为6、8、10的DGA对应协萃体系对这一规律并非严格符合,C8-DGA对应的D值略高于另外二者,并且Am(Ⅲ)的D值大小次序随着酸度的增加而出现交叉,说明DGA链长不仅影响与金属离子的配位,还影响其与C2-BTP之间的相互作用,如两种萃取剂之间在不同条件(酸度、金属离子浓度等)下的协同与竞争效应,以及两种萃取剂加合物和三元萃合物的生成及稳定性[15]。
综上所述,短链的C4-DGA的加入有助于Am(Ⅲ)与Eu(Ⅲ)的共萃取,但会降低选择性;长链DGA的加入则有助于提高C2-BTP对Am(Ⅲ)和Eu(Ⅲ)的分配比,同时能够有效地将二者分离。
2.4盐析剂浓度对分配比的影响

2.5DGA在1,2-二氯乙烷/HNO3体系中单独萃取Am(Ⅲ)和Eu(Ⅲ)的机制
DGA萃取Am(Ⅲ)及三价镧系元素的反应为[14]:
(3)
式中:M=Am,Eu;L=DGA;a,水相;o,有机相。
萃取反应的平衡常数Kex计算如式(4)。
(4)
分配比D可表示为式(5)、(6)。
(5)
(6)
根据式(6),在给定条件下,由lgD与lgco(L)的关系可拟合得到DGA与M3+的萃合比x。在仅有DGA存在时,考察了Am(Ⅲ)和Eu(Ⅲ)的D值随着萃取剂浓度变化关系,结果示于图7。由图7可知,随着DGA浓度的增加,Am(Ⅲ)和Eu(Ⅲ)的D值均增加,lgD与lgc(DGA)呈线性关系,直线斜率均约为1.5,表明在1,2-二氯乙烷体系中,DGA与Am(Ⅲ)及Eu(Ⅲ)并不是简单的单分子三齿配位。
文献[14]报道了以正十二烷为稀释剂时C8-DGA从硝酸介质中萃取Am(Ⅲ)和三价镧系元素的萃合比均为3。文献[11]报道了正十二烷及苯作为稀释剂时,C8-DGA从1.0 ~ 5.0 mol/L HNO3中萃取Am(Ⅲ)及Eu(Ⅲ)的萃合比在2.9~3.9之间。文献[17]报道了C8-DGA在不同稀释剂中lgD(Am)对lgc(C8-DGA)的直线斜率随着不同稀释剂介电常数的增大而减小,并指出在氯代和芳香类稀释剂(如1,2-二氯乙烷,甲苯)中,稀释剂会与DGA的配位氧原子发生相互作用,导致自由配体的浓度降低,相应萃合比从3.68下降至1.76,且D(Am)也有所下降。本实验结果与文献[17]的结果符合较好。

有机相:0.005 mol/L DGA+0.015 mol/L C2-BTP+C2H4Cl2;水相:1.0 mol/L HNO3+NaNO3+241Am(Ⅲ)+152Eu(Ⅲ),293 K□——C4-DGA,▽——C6-DGA,●——C8-DGA,◆——C10-DGA图6 水相盐析剂浓度对C2-BTP/DGA体系D(Am)(a)和D(Eu)(b)的影响Fig.6 Effect of salting-out agent concentration on the distribution ratios of Am(a) and Eu(b) with C2-BTP/DGA
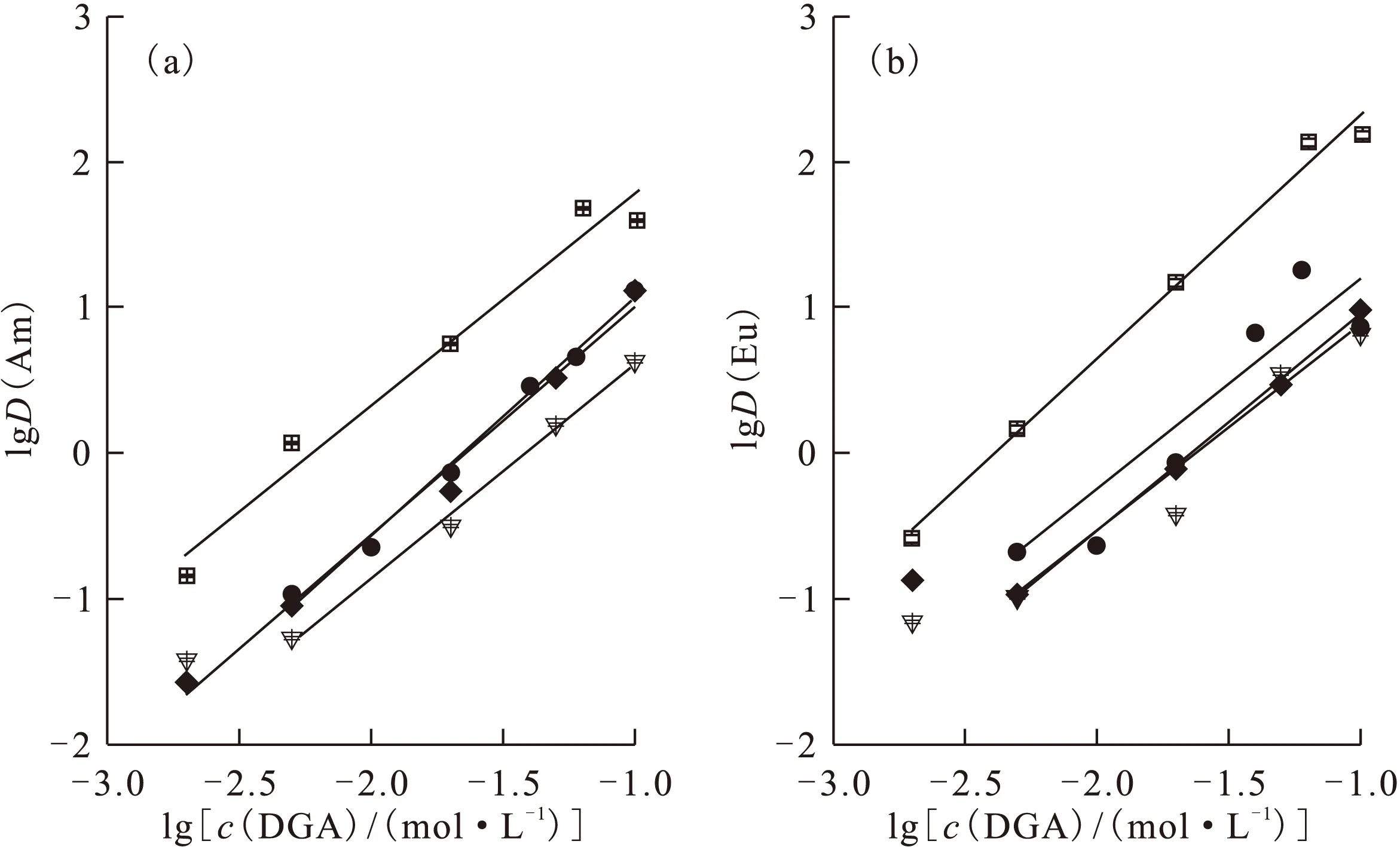
有机相:DGA + C2H4Cl2;水相:1.0 mol/L HNO3 + 1.0 mol/L NaNO3+ 241Am(Ⅲ) + 152Eu(Ⅲ),293 K(a):□——C4-DGA,y=(1.46±0.14)x+(3.24±0.27),r2=0.962 1;▽——C6-DGA,y=(1.48±0.68)x+(2.09±0.11),r2=0.993 7;●——C8-DGA,y=(1.63±0.07)x+(2.70±0.12),r2=0.990 6;◆——C10-DGA,y=(1.56±0.09)x+(2.57±0.18),r2=0.986 3;(b):□——C4-DGA,y=(1.68±0.09)x+(4.00±0.16),r2=0.989 6;▽——C6-DGA,y=(1.42±0.12)x+(2.30±0.20),r2=0.985 4;●——C8-DGA,y=(1.45±0.34)x+(2.65±0.55),r2=0.808 1;◆——C10-DGA,y=(1.49±0.37)x+(2.44±0.06),r2=0.998 1图7 DGA浓度对D(Am)(a)和D(Eu)(b)的影响Fig.7 Dependence of the distribution ratios of Am(a) and Eu(b) on DGA concentration
在使用斜率法进一步研究协萃机理和萃合物组成时发现,DGA和C2-BTP两种萃取剂同时使用时,固定其中一种萃取剂浓度c(A),改变另外一种萃取剂浓度c(B),得到的lgD对lgc(B)的关系并非简单直线,这表明协萃过程中不仅生成了两种萃取剂各自的配合物,而且产生了含两种萃取剂的加合物以及它们和金属离子形成的三元配合物[15],同时两种萃取剂之间还可能存在相互作用[10]。协萃剂的加入增加了萃取体系的复杂性,有关该协萃体系萃合物结构及萃取机理方面,还需深入的研究。
3 结 论
研究了四种不同链长的DGA与C2-BTP在以1,2-二氯乙烷作为稀释剂时,从硝酸体系中协萃分离Am(Ⅲ)和Eu(Ⅲ)的性能。得到以下结论:
(1) 不同碳链长度的DGA对C2-BTP萃取Am(Ⅲ)和Eu(Ⅲ)会产生协同效应和反协同效应;
(2) 选取C2-BTP作为萃取剂,C6-DGA作为协萃剂组成的协萃体系具有最佳正协同效应,可以提高C2-BTP对Am(Ⅲ)和Eu(Ⅲ)的萃取能力,保持C2-BTP对Am(Ⅲ)和Eu(Ⅲ)的分离效果,还可改善负载有机相中三价镧系和锕系的反萃性能;
(3) 1,2-二氯乙烷作为稀释剂时,由于存在稀释剂与萃取剂氧原子的相互作用,影响了DGA与Am(Ⅲ)及Eu(Ⅲ)的配位性能。
[1]詹文龙,徐瑚珊.未来先进核裂变能:ADS嬗变系统[J].中国科学院院刊,2012,27(3):375-381.
[2]田国新.高放废液中锕系离子分离研究进展Ⅰ:双酰胺荚醚与锕系离子的配位化学[J].核化学与放射化学,2015,37(5):276-285.
[3]Maria T M, Amparo G E, Jorge S Q, et al. Synthesis of pre-organized bisdiglycolamides (BisDGA) and study of their extraction properties for actinides(Ⅲ) and lanthanides(Ⅲ)[J]. Solvent Extr Ion Exch, 2009, 27(2): 107-131.
[4]Case F H. The preparation of 2,4- and 2,6-bis-triazinyl and triazolinyl derivatives of pyridine[J]. Journal of Heterocyclic Chemistry, 1971, 8(6): 1043-1046.
[5]Stephan H, Gloe K, Beger J, et al. Liquid-liquid extraction of metal ions with amido podands[J]. Solvent Extr Ion Exch, 1991, 9(3): 459-469.
[6]Sasaki Y, Sugo Y, Suzuki S, et al. The novel extractants, diglycolamides, for the extraction of lanthanides and actinides in HNO3-n-dodecane system[J]. Solvent Extr Ion Exch, 2001, 19(1): 91-103.
[7]张灿.盐酸介质下酸性磷(膦)类萃取剂对稀土元素的协同萃取机理研究[D].北京:北京有色金属研究总院,2014.
[8]张鑫.离子液体中C2-BTP对Am(Ⅲ)和Eu(Ⅲ)的萃取分离研究[D].北京:中国科学院大学,2015.
[9]Ansari S A, Pathak P, Mohapatra P K, et al. Chemistry of diglycolamides: promising extractants for actinide partitioning[J]. Chemical Reviews, 2011, 112(3): 1751-1772.
[10]徐光宪,王文清,吴瑾光,等.核燃料萃取的化学(Ⅰ):螯合与中性络合协同萃取[J].原子能科学技术,1963,5(7):487-508.
[11]Mowafy E A, Aly H F. Synthesis of someN,N,N′,N′-tetraalkyl-3-oxa-pentane-1,5-diamide and their applications in solvent extraction[J]. Solvent Extr Ion Exch, 2007, 25(2): 205-224.
[12]Kamlet M J, Abboud J L, Taft R W. The solvatochromic comparison method 6: the. pi.* scale of solvent polarities[J]. J Am Chem Soc, 1977, 99(18): 6027-6038.
[13]Nakamura T, Miyake C. Extraction of lanthanide(Ⅲ) and uranyl(Ⅵ) from nitric acid solution byN,N′-dimethyl-N,N′-dibutylmalonamide[J]. Solvent Extr Ion Exch, 1995, 13(13): 253-273.
[14]朱文彬,叶国安,李峰峰.TODGA-DHOA体系萃取金属离子Ⅲ:对Am(Ⅲ)和三价镧系离子的萃取[J].核化学与放射化学,2014,36(1):24-33.
[15]Muller J M, Berthon C, Couston L, et al. Extraction of lanthanides(Ⅲ) by a mixture of a malonamide and a dialkyl phosphoric acid[J]. Solvent Extr Ion Exch, 2016, 34(2): 141-160.
[16]胡佩卓.酰胺类萃取剂和氮杂冠醚对U(Ⅵ),Th(Ⅳ)和Sr(Ⅱ)的萃取性能研究[D].兰州:兰州大学,2013.
[17]Ansari S A, Pathak P N, Manchanda V K, et al.N,N,N′,N′-tetraoctyl diglycolamide (TODGA): a promising extractant for actinide-partitioning from high-level waste (HLW)[J]. Solvent Extr Ion Exch, 2005, 23(4): 463-479.
Synergistic Extraction of Am(Ⅲ) and Eu(Ⅲ) by Mixture of 2,6-Bis(5,6-Diethyl-1,2,4-Triazin-3-yl)Pyridine and Diglycolamides in Nitric Acid Media
CAO Shi-wei1,2, TAN Cun-min1,2,3, ZHANG Xin1,2,3, QIN Zhi1,*
1.Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China;2.University of Chinese Academy of Sciences, Beijing 100049, China;3.The School of Nuclear Science and Technology, Lanzhou University, Lanzhou 730000, China
In the present paper, the synergistic extraction characteristics of 2,6-bis(5,6-diethyl-1,2,4-triazin-3-yl)pyridine(C2-BTP) and diglycolamides(DGA) in 1,2-dichloroethane, for the separation of Am(Ⅲ) and Eu(Ⅲ) from nitric acid media were studied. The results indicate that DGA with long alkyl chains increases the ability of synergistic extraction with C2-BTP. The distribution ratio(D) values with mixed extractants are more than twice that with C2-BTP alone, when the molar ratio of C2-BTP to C6-DGA is 3∶1 in 1.0 mol/L HNO3and 1.0 mol/L NaNO3. The highest separation factor(SF) value of Am(Ⅲ) over Eu(Ⅲ) is around 21 under given conditions. Slope analyses indicate that the average coordination numbers of Am(Ⅲ) as well as Eu(Ⅲ) extracted with DGA alone are determined to be around 1.5, indicating that the donor oxygen of diglycolamide probably interacts with the polar halogenated diluents, which affects the complexing ability for Am(Ⅲ) and Eu(Ⅲ).
solvent extraction; separation of lanthanides and actinides; triazin-3-yl pyridine; diglycolamides; synergistic extraction
2016-02-26;
2016-05-03
*通信联系人:秦芝(1966—),男,甘肃会宁人,研究员,核化学与放射化学方向,E-mail: qinzhi@impcas.ac.cn
O652.62
A
0253-9950(2016)05-0274-08
10.7538/hhx.2016.38.05.0274
