凡纳滨对虾输入蛋白α1基因的克隆与表达分析
2016-11-11董晓慧杨奇慧迟淑艳刘泓宇谭北平
章 双,黎 铭,董晓慧,杨奇慧,迟淑艳,刘泓宇,谭北平
(1.广东海洋大学水产学院,广东 湛江 524088;2.南海生物资源开发与利用协同创新中心,广东 珠海 519082;3.广西水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
凡纳滨对虾输入蛋白α1基因的克隆与表达分析
章 双1,2,黎 铭3,董晓慧1,2,杨奇慧1,2,迟淑艳1,2,刘泓宇1,2,谭北平1,2
(1.广东海洋大学水产学院,广东 湛江 524088;2.南海生物资源开发与利用协同创新中心,广东 珠海 519082;3.广西水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
输入蛋白α(importin α)是核转运蛋白家族的重要成员,可通过帮助具有核定位信号(Nuclear location signal,NLS)蛋白入核而参与免疫过程。克隆并鉴定凡纳滨对虾(Litopenaeus vannamei)的importin α1基因,命名为 LvIMα1,基因全长 cDNA 为 2 181 bp,包括1 575 bp 的开放阅读框,编码525个氨基酸,5′ 非编码区长 110 bp,3′ 非编码区长496 bp。Smart分析显示,LvIMα1蛋白包含一个N端的输入蛋白β结合域和一个包含8个串联重复序列的NLS中央结合结构域。同源性分析发现,LvIMα1与原鸡(Gallus gallus)IMα1的相似度最高,为 73%;与水蚤(Daphnia magna)IMα1相似度最低,为61%。系统进化分析显示,LvIMα1和多种无脊椎动物 IMα1聚为一类。实时荧光定量PCR(QRT-PCR)分析表明,LvIMα1在所测试组织中均有表达,在神经组织中表达量最高。白斑综合征病毒感染后,凡纳滨对虾血液中LvIMα1基因的表达量呈先下降后上升趋势,除感染后 4 h外,其余时间点的表达量均低于对照组(P < 0.05),12 h最低,为对照组的 0.22 倍,随后逐渐升高。副溶血弧菌(V.parahaemolyticus)感染后,凡纳滨对虾血细胞中LvIMα1基因表达量低于对照组,在感染后4、24、48、72 h尤为显著,24 h时最低,为对照组的 0.38倍。LvIMα1基因可能参与凡纳滨对虾抗病免疫应答途径。
凡纳滨对虾;输入蛋白α1;基因;克隆;表达
核转运蛋白家族是一个保守的受体家族,可转移目标蛋白,介导大分子在核膜的双向转运[1-2],包括输入蛋白和输出蛋白。输入蛋白参与细胞分化、发育、凋亡等一系列通路[3],分为输入蛋白α和β两类,其中输入蛋白α在带有核定位信号(Nuclear location signal,NLS)的蛋白质入核中起纽带作用,其一端连接被运载的带有NLS结构域的靶蛋白,另一端通过输入蛋白β结合(Importin-β-binding,IBB)结构域与输入蛋白β或者其同系物连接,帮助靶蛋白通过核孔复合体(Nuclear pore complex,NPC) 来实现物质的入核[4]。越来越多的细胞或者病毒组分依靠特异的输入蛋白α亚型的转运进入细胞核[5]。迄今,哺乳动物和节肢动物中已发现大量输入蛋白α,并对其功能有一定了解,但在甲壳纲尚未发现。
凡纳滨对虾(Litopenaeus vannamei)是重要的养殖对象,但一直饱受由细菌和病毒引起病害的困扰,导致大量减产,经济损失极大,其中由白斑综合症病毒(White spot syndrome virus,WSSV)引起的白斑综合症和副溶血弧菌(Vibrio parahaemolyticus)引起的肝胰腺坏死症危害最大[6]。虾类无获得性免疫,主要以Toll、IMD、JAK-STAT等先天免疫通路应对外界刺激[7]。输入蛋白α可通过协助先天免疫通路的效应因子入核定位而间接参与生长、分化及免疫过程[8-9]。迄今尚无凡纳滨对虾输入蛋白α相关报道,本研究克隆鉴定凡纳滨对虾输入蛋白α1(LvIMα1),对其进行序列和生物信息学分析,并使用实时荧光定量 PCR(QRT-PCR)进一步分析该基因的组织表达特征和应答WSSV和副溶血弧菌感染的表达变化模式,有利于了解对虾抗病免疫机制,为对虾病害防治提供理论参考。
1 材料与方法
1.1 材料
凡纳滨对虾(体质量8~10 g)购于湛江腾飞实业有限公司,实验前在水族箱循环系统中暂养7 d,使其适应实验室养殖环境。病死凡纳滨对虾收集于广东省湛江市各养殖场,采用PCR方法鉴定为WSSV阳性,具体鉴定方法参照文献[10]。副溶血弧菌菌株由广东海洋大学水产营养与饲料实验室保存。RNeasy Mini Kit购自德国Qiagen公司,SMARTerTMRACE cDNA Amplification Kit购自美国Clontech公司,PrimerScriptTM1st Strand cDNA Synthesis Kit、LaTaq酶、pMD19-T载体、DH5α感受态细胞、PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR®Premix Ex Taq™II(Tli RNaseH Plus)购自日本TAKARA公司,胶回收试剂盒及DNA marker购于广州东盛生物科技有限公司,实验所用引物由英潍捷基(上海)贸易有限公司合成。其他试剂均为国产分析纯。
1.2 样品采集
取健康凡纳滨对虾10尾,暂养1周后取其血液、肝胰腺、鳃、肌肉、心、胃、肠、后盲囊、表皮、神经索和眼柄,用于基因cDNA克隆和组织分布实验。免疫刺激实验分为对照组、WSSV感染实验组和副溶血弧菌感染实验组,每组健康凡纳滨对虾80尾。WSSV悬液的制备参照Melena等[11],副溶血弧菌的培养及浓度测定参照Balcázar等[12]。WSSV感染实验组按106拷贝/g注射WSSV粗提液,副溶血弧菌感染实验组按5.5×106CFU/g注射副溶血弧菌,对照组注射磷酸缓冲液(PBS),于注射后0、4、8、12、24、48 和 72 h取凡纳滨对虾血细胞,每3尾虾的血细胞为一个混合样品,每组同一时间点取3个平行。
1.3 凡纳滨对虾IMα1基因cDNA全长的克隆
基于凡纳滨对虾转录组数据[13],获得IMα1基因的表达序列标签(EST)序列,用特异性引物(表1)通过DNA末端快速扩增(Rapid amplification cDNA ends,RACE)法得到IMα1全长。具体方法如下。
用RNeasy Mini Kit提取凡纳滨对虾神经、皮、鳃、肠、肌肉等组织的总RNA,用凝胶电泳检测总RNA完整性和纯度,用超微量分光光度计(NanoDrop2000)测定 RNA浓度,混合后备用。RACE-PCR 模板用 SMARTerTMRACE cDNA Amplification Kit制备。5′ RACE引物为5′ RACE1 + UPM,按照Takara公司产品说明书构建50 μL体系,采用降落式PCR扩增程序进行5′ 端第1次扩增。以第1次扩增产物稀释50倍为模板,以5′ RACE2 + NUP为引物进行5′ 端第2次扩增。反应程序:94℃3 min;94℃ 30 s,62~57℃(每循环递减0.5℃)30 s,72℃ 2 min,10个循环;94℃ 30 s,57℃ 30 s,72℃ 2 min,28个循环;72℃ 10 min 。3′ RACE 分别以3′ RACE1 + UPM、3′ RACE2+NUP为引物进行第1次和第2次扩增,扩增体系与程序同5′ RACE。
RACE扩增产物经12 mg/mL 琼脂糖凝胶电泳检测,用胶回收试剂盒回收目的片段,与PMD19-T载体连接,转化入DH5α 感受态细胞,阳性克隆经菌落PCR 鉴定后(所用引物为M13-F 和M13-R),送往英潍捷基(上海)贸易有限公司测序。

表1 PCR引物Table 1 PCR primers
1.4 序列分析
利用软件SeqMan对测序结果进行载体序列的去除和拼接,将所得序列进行比对(http://www.ncbi.nlm.nih.gov/blast/),利用软件EditSeq预测开放阅读框(ORF)和氨基酸序列,http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1网站在线分析蛋白质功能结构域信息[14]。在NCBI的Protein Blast数据库中搜寻有较高同源性的IMα1蛋白质序列,利用软件ClustalX和MEGA 5.0进行多序列比对和聚类分析,用邻接法构建系统发生树。
1.5 QRT-PCR
将各组织 RNA 逆转录成 cDNA,用PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real Time) 合成cDNA第1链。采用SYBR法进行PCR反应,每个样品重复3次,具体操作按照 SYBR®Premix Ex Taq™ II(Tli RNaseH Plus)试剂盒说明进行,以延伸因子1α(Elongation factor 1α,EF1α,GenBank序列号GU136229)基因为内参基因,引物序列见表1。反应程序:95℃ 30 s; 94℃ 5 s,57℃ 30 s,78℃ 5 s,40个循环。采用2-△△Ct方法分析QRT-PCR检测结果。
2 结 果
2.1 凡纳滨对虾 IMα1基因cDNA全长及序列分析
凡纳滨对虾IMα1(LvIMα1,GenBank序列号KX058564)基因cDNA全长2 181 bp,包括1 575 bp的ORF、110 bp的5′ 非编码区(UTR)和496 bp的带A尾的3′ UTR。预测LvIMα1具有525个氨基酸(图1),理论分子质量约57.3 ku,等电点(pI)约4.98。SMART分析显示,LvIMα1氨基酸序列包含一个N端的IBB域和一个包含8个串联重复序列(Armadillo,ARM)的NLS中央结合结构域(图2)。
2.2 LvⅠMα1的多重序列比对分析
用Clustal X 2.0和GeneDoc等软件分析不同物种间 IMα1蛋白之间的相似度,结果显示,LvIMα1与多个物种IMα1的相似度为61%~73%(图3),其中与原鸡(Gallus gallus)的相似度最高(73%),与水蚤(Daphnia magna)的相似度最低(61%)。系统进化分析显示,IMα1聚为脊椎动物和无脊椎动物两区,与进化相符。其中LvIMα1与多种节肢动物的IMα1聚为一类(图4)。

图1 凡纳滨对虾IMα1基因的核苷酸序列及预测氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of IMα1 gene from Litopenaeus vannamei
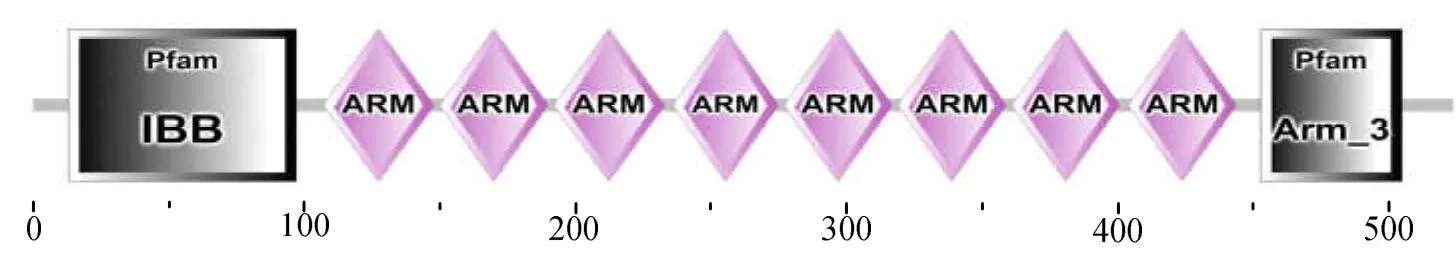
图2 LvIMα1蛋白结构Fig.2 Schematic description of the domain topologies of LvIMα1

续图3(Continued)
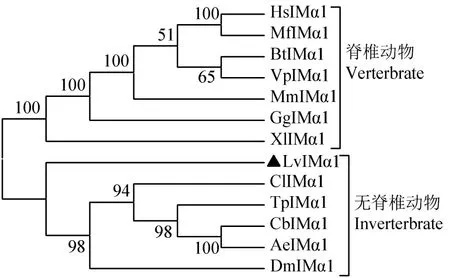
图4 IMα1蛋白进化树分析Fig.4 Phylogenetic analysis of IMα1 proteins
2.3 凡纳滨对虾LvIMα1基因的组织分布
图5表明,LvIMα1基因在各组织中均有表达,神经中LvIMα1 mRNA表达量最高,其次为胃、肝胰腺、肠、血、心脏、鳃,在肌肉、表皮、眼柄和后盲囊中的表达量较少。
2.4 LvⅠMα1基因应答WSSV及副溶血弧菌感染的表达特征
鉴于血细胞在对虾类免疫应答中的重要地位,选取血细胞来检测WSSV和副溶血弧菌感染后LvIMα1 mRNA表达量的变化。结果显示:WSSV感染后,凡纳滨对虾血液中LvIMα1基因的表达量呈先降后升趋势(图6)。在感染后8 h时,表达量低于对照组(P < 0.05),于12 h时降至最低,为对照组的0.22 倍,随后逐渐升高,但低于对照组(P < 0.01)。副溶血弧菌感染后4 h,凡纳滨对虾血液中LvIMα1表达量低于对照组(P < 0.05);感染后8、12 h时,表达量与对照组差异无统计学意义(P > 0.05);感染24 h后,LvIMα1表达量均低于对照组(P < 0.01),24 h时最低,为对照组的0.38倍(图7)。
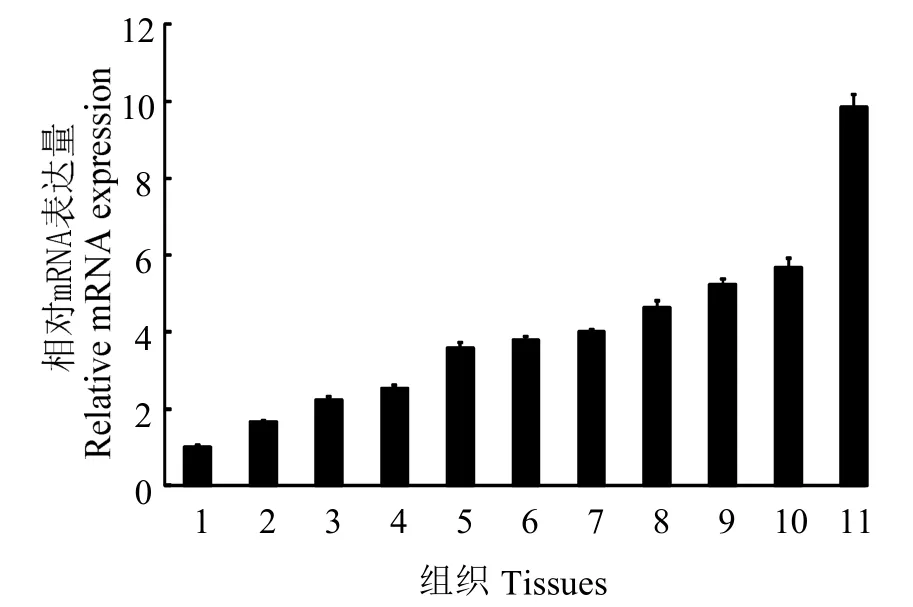
图5 LvIMα1基因在不同组织中的表达分布Fig.5 Distribution of LvIMα1 gene expression in different tissues L.vannamei
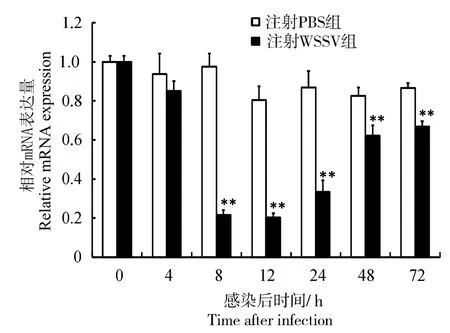
图6 WSSV感染后凡纳滨对虾血细胞中LvⅠMα1基因表达Fig.6 Expression of LvIMα1 gene in hemocytes of L.vannamei after WSSV challenge
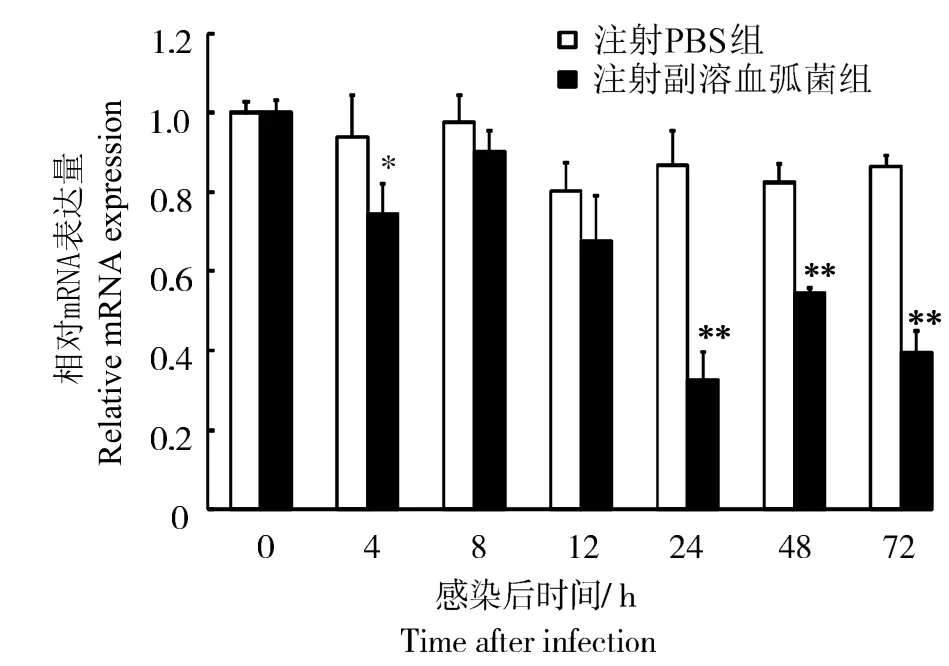
图7 副溶血弧菌感染后凡纳滨对虾血细胞中LvIMα1基因表达Fig.7 Expression of LvIMα1 gene in hemocytes of L.vannamei after V.parahaemolyticus challenge
3 讨 论
输入蛋白α有重要的生理作用。在小鼠中,已有输入蛋白α1、α2、α3、α4、α6等5个输入蛋白α亚族成员被鉴定出来,然而在对虾中至今未发现输入蛋白家族的成员[15]。本研究首次克隆得凡纳滨对虾中第1个输入蛋白家族成员LvIMα1。
本研究表明,LvIMα1氨基酸序列包括一个IBB结构域和由8个ARM构成的超螺旋NLS中央结合结构域,与其他物种输入蛋白α的组成特征相符[16]。高等哺乳动物中,输入蛋白α一般具有1个在N端的IBB结构域和1个NLS结构域,但是NLS中一般包括10个ARM,这种差异可能是由因进化程度不同而导致的蛋白功能特异性低造成的。
Perry等[17]研究表明,输入蛋白家族对神经元的各项活动有关键性影响,输入蛋白α参与神经元的分化及局部轴突的合成,输入蛋白β协调对轴突损伤的信号复合体,并管理来自信号末端的信号分子。本研究发现,LvIMα1在神经中的表达量最高,提示IMα1可能也参与了凡纳滨对虾神经系统的生长与分化。
作为低等的无脊椎动物,对虾的血液循环是开放式的,仅具备非特异性的先天性防御系统,其非特异性免疫主要通过血细胞吞噬、包囊和形成结节等完成,免疫信号通路发挥了极为重要的作用[18]。对虾类动物血细胞因其重要的免疫功能而被格外关注,因而分析病原感染后LvIMα1在凡纳滨对虾血细胞中的表达水平较有代表性。已证实,对虾中NF-κB通路在应对病原入侵时起重要作用[7],转录因子从细胞质到细胞核的过程在NF-κB信号转导通路中极为重要。作为的靶蛋白之一,NF-κB转录因子的入核过程与输入蛋白α紧密相关[19]。在凡纳滨对虾遭受WSSV或副溶血弧菌刺激时,LvIMα1的表达水平与对照组相比均产生显著变化,可能是由于LvIMα1参与了NF-κB等免疫相关的转录因子的入核运输,但相关作用机制还有待深入研究。
综上所述,本研究系统分析LvIMα1基因的结构特点、组织表达特征以及病毒和细菌感染后该基因的表达量变化模式,研究结果为深入了解细菌和病毒对凡纳滨对虾的侵染机制,进而防治凡纳滨对虾病害打下良好的基础。
[1]FRIED H,KUTAY U.Nucleocytoplasmic transport:taking an inventory[J].Cellular and Molecular Life Sciences,2003,60(8):1659-1688.
[2]MACARA I G.Transport into and out of the nucleus[J].Microbiology and Molecular Biology Reviews,2001,65(4):570-594.
[3]ZAZA G,RASCIO F,PONTRELLI P,et al.Karyopherins:potential biological elements involved in the delayed graft function in renal transplant recipients[J]/OL.BMC Medical Genomics,2014,7:14.http://link.springer.com/article/10.1186/1755-8794-7-14
[4]STEWART M.Molecular mechanism of the nuclear protein import cycle[J].Nature Reviews Molecular CellBiology,2007,8(3):195-208.
[5]PUMROY R A,CINGOLANI G.Diversification of importin-α isoforms in cellular trafficking and disease states[J].Biochemical Journal,2015,466(1):13-28.
[6]LI F H,XIANG J H.Recent advances in researches on the innate immunity of shrimp in China[J].Developmental & Comparative Immunology,2013,39(1):11-26.
[7]LI F H,XIANG J H.Signaling pathways regulating innate immune responses in shrimp[J].Fish & Shellfish Immunology,2013,34(4):973-980.
[8]ZAZA G,RASCIO F,PONTRELLI P,et al.Karyopherins:potential biological elements involved in the delayed graft function in renal transplant recipients[J].BMC Medical Genomics,2014,7(1):1.
[9]YE W,LIN W,TARTAKOFF A M,et al.Karyopherins in nuclear transport of homeodomain proteins during development[J].Biochimica et Biophysica Acta(BBA)—Molecular Cell Research,2011,1813(9):1654-1662.
[10]何建国,谢数涛.套式 PCR 检测斑节对虾白斑症病毒(WSSV)[J].青岛海洋大学学报(自然科学版),2001,31(2):220-224.
[11]MELENA J,ECHEVERRÍA F,PANCHANA F,et al.Delayed mortality of juvenile shrimp Penaeus vannamei challenged to White spot syndrome virus(WSSV)previously exposed to Infectious hypodermal and haematopoietic necrosis virus(IHHNV) or inactivated WSSV [J].Brazilian Journal of Veterinary Pathology,2015,8(2):51-57.
[12]BALCÁZAR J L,ROJAS-LUNA T,Cunningham D P.Effect of the addition of four potential probiotic strains on the survival of pacific white shrimp(Litopenaeus vannamei) following immersion challenge with Vibrio parahaemolyticus [J].Journal of Invertebrate Pathology,2007,96(2):147-150.
[13]LI C Z,WENG S P,CHEN Y X,et al.Analysis of Litopenaeus vannamei transcriptome using the next-generation DNA sequencing technique[J]/OL.PLoS One,2012,7(10):e47442.http://dx.doi.org/10.1371/journal.pone.0047442.
[14]LETUNIC I,DOERKS T,BORK P.SMART:recent updates,new developments and status in 2015[J].Nucleic Acids Research,2015,43(D1):D257-D260.
[15]HOSOKAWA K,NISHI M,SAKAMOTO H,et al.Regional distribution of importin subtype mRNA expression in the nervous system:study of early postnatal and adult mouse[J].Neuroscience,2008,157(4):864-877.
[16]郭建林,徐存拴.Importin的结构与功能研究进展[J].中国细胞生物学学报,2015(7):1013-1020.
[17]PERRY R B T,FAINZILBER M.Nuclear transport factors in neuronal function[J].Seminars in Cell & Developmental Biology,2009,20(5):600-606.
[18]ARALA-CHAVES M,SEQUEIRA T.Is there any kind of adaptive immunity in invertebrates?[J].Aquaculture,2000,191(1):247-258.
[19]FAGERLUND R,KINNUNEN L,KÖHLER M,et al.NF-κB is transported into the nucleus by importin α3 and importin α4[J].Journal of Biological Chemistry,2005,280(16):15942-15951.
(责任编辑:刘庆颖)
Cloning and Expression of the Ⅰmportin α1 Gene from Litopenaeus vannamei
ZHANG Shuang1,2,Li Ming3,YANG Qi-hui1,2,DONG Xiao-hui1,2,CHI Shu-yan1,2,LIU Hong-yu1,2,TAN Bei-ping1,2
(1.College of Fisheries,Guangdong Ocean University,Zhanjiang 524088,China; 2.South China Sea Resource Exploitation and Protection Collaborative Innovation Center(SCS-REPIC),Zhuhai 519082,China; 3.Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture,Guangxi Academy of Fishery Sciences,Nanning 530021,China)
Importin α,an essential member of karyopherins family,function as a receptor protein which plays important role in the transport of proteins with nuclear location signal(NLS) into the nucleus through the nuclear pore complex.An importin gene in L.vannamei designated as LvIMα1 is cloned and identified.The full-length cDNA of LvIMα1 is 2181 bp with 5' UTR of 110 bp,3' UTR of 496 bp and an open reading frame of 1 575 bp,which encod a putative protein of 525 amino acids including aimportin-β-binding(IBB) domain at the N-terminal and a highly structured domain comprised of eight tandem armadillo(ARM) repeats.Multiple alignment analysis shows that LvIMα1 shares highest amino acid identity with Gallus gallus(73%) while the lowest with Daphnia magna(61%).Phylogenetic analysis shows that LvIMα1 is clustered into invertebrates group.QRT-PCR analysis shows that LvIMα1 is constitutively expressed in all the examined tissues with the highest expression in nerve.Upon WSSV challenge,the expression of LvIMα1 is significantly lower than the control at all the detected time points except 4 hour past infection(hpi).At 12 hpi,the level of LvIMα1 expression reduced into the lowest,which is 0.22-fold of the control.By V.parahaemolyticus challenging,the expression of LvIMα1 is lower than the control at all the detected time points,especially at 4 hpi,24 hpi,48 hpi and 72 hpi.At 24 hpi,the LvIMα1 expression reduces into the lowest level,which is 0.38-fold of the control.All the result suggests that LvIMα1 might take part in the innate immune response of L.vannamei triggered by pathogens.
Litopenaeus vannamei; importin α1; gene; clone; expression
Q78;Q959.223+.63
A
1673-9159(2016)03-0001-08
10.3969/j.issn.1673-9159.2016.03.001
2016-04-20
广东省自然科学基金-博士启动项目(2014A030310184);广东省自然科学基金-自由申请项目(2016);广东普通高校青年创新人才项目(2014KQNCX079);广东省高校珠江学者计划项目;广东海洋大学优秀青年骨干教师特别资助计划项目(HDYQ2015004);广东海洋大学自然科学基金
章双(1986-),女,讲师,主要从事水产动物营养与免疫研究。E-mail:18820436396@126.com
谭北平,教授,主要从事水产动物营养与饲料学研究。E-mail:bptan@126.com
