基于量子点荧光探针的高灵敏蛋白质检测方法
2016-11-11吴思敏贾春平刘莉芬郜晚蕾景奉香金庆辉张红锋赵建龙
吴思敏, 贾春平, 刘莉芬, 郜晚蕾, 景奉香,金庆辉, 张红锋, 赵建龙
(1.华东师范大学生命科学学院,上海 200241;2.中国科学院上海微系统与信息技术研究所传感技术联合国家重点实验室,上海 200050)
基于量子点荧光探针的高灵敏蛋白质检测方法
吴思敏1,2, 贾春平2, 刘莉芬2, 郜晚蕾2, 景奉香2,金庆辉2, 张红锋1, 赵建龙2
(1.华东师范大学生命科学学院,上海200241;2.中国科学院上海微系统与信息技术研究所传感技术联合国家重点实验室,上海200050)
通过制备量子点荧光检测探针,构建了一种基于量子点探针和免疫磁珠的蛋白质检测方法,实现了对蛋白肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)的高灵敏定量检测.在该检测体系中,若存在有靶标蛋白,其与量子点检测探针以及捕获探针之间会发生免疫反应形成三明治结构,利用磁力分离器对免疫复合物进行富集后,通过检测富集在磁珠表面的量子点荧光信号,可实现对靶标蛋白的定量.该方法的检测灵敏度为38 pg/mL,线性范围为0.39~50 ng/mL,临床质控样本检验结果表明,该方法准确度高,可重复性好,可应用于临床样本检测.该量子点探针检测体系具有灵敏度高、特异性好、样品消耗量低等优点,在疾病早期诊断方面具有广阔的应用前景.
量子点; 免疫荧光分析; 免疫磁珠; 肿瘤标志物
0 引 言
肿瘤标志物的高灵敏度检测对于癌症的早期预警及其监测具有十分重要的意义[1].研究表明,随着癌症的发生与发展,血清等体液中蛋白质等肿瘤标志物的含量会增加.通过分析正常个体与癌症患者之间存在差异的化学类物质的种类和含量,分子筛查能够较形态学方法更早地检测到肺癌的发生与发展[2-3].故而,发展准确简便的蛋白质定量方法应用于肿瘤早期检测对降低癌症死亡率具有重大意义.
量子点作为一种新颖的半导体纳米材料,所表现出来的独特光学特性、理化性质以及生物相容性,使其迅速成为一种备受瞩目的荧光标记物,被广泛应用在生物成像、核酸和蛋白质检测等方面[4-7].随着量子点合成、制备工艺的发展,目前可以获得量子产率高达90%的量子点,另外,量子点还具有大的摩尔消光系数(105~107mol-1·cm-1)[8],这使得其具有传统荧光染料难以比拟的强荧光性[9-10].除此之外,量子点还具有吸收谱宽、发射谱窄(半峰全宽约为25~35 nm)、斯托克斯位移宽、光稳定性好、抗光漂白能力以及抗化学试剂淬灭能力强等特点.这些性质都使得量子点成为优异的荧光示踪物,将其应用于免疫分析不仅能够实现检测灵敏度的大幅提高,而且由于量子点具有发射波长随尺寸可调的特性,因此还具备拓展到多通道、多指标同步检测的能力[11-12].
近年来,利用磁性微球作为固相载体设计免疫检测的方法倍受青睐,这主要归功于磁性微球独特的物理化学性质[13-15].首先,磁性微球具有高的体表比,丰富的表面活性基团以及良好的生物相容性,能够和DNA、酶及抗体等生物物质偶联,易于实现生物功能化;其次,磁性微球具有好的稳定性,能耐受一定酸碱度的溶液,这使其能够应用在多种反应中;再次磁性微球的悬浮稳定性好,能够均匀分散在液相溶液中,为免疫识别提供了优异的反应微环境,故而能够获得更优异的动力学表现;不仅如此,因其具备的超顺磁性,可以简便高效地实现与其他物质的分离与纯化.
本研究通过对磁性微球进行功能化制备成捕获探针,将量子点作为示踪物标记在检测抗体上形成检测探针,以癌胚抗原(Carcinoembryonic antigen,CEA)为靶标物质[6],构建了一种新型蛋白质荧光免疫分析方法.当靶标CEA存在时,会发生免疫识别反应形成免疫夹心结构磁珠—抗体—抗原—抗体—量子点,通过对被限制在磁性微球表面的量子点进行荧光成像分析,可实现对CEA的高灵敏的检测.该方法不仅特异性好、检测范围宽,而且操作简便、样品消耗量低、设备要求低,极具临床应用前景.
1 材料与方法
1.1材料
1.1.1试剂
牛血清蛋白(Bovine serum albumin,BSA)、2-吗啉乙磺酸(2-(N-morpholino)ethanesulfonic acid,MES)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylamino)-propyl-3-ethylcarbodiimide-hydrochloride,EDC)和 N-羟基琥珀酰亚胺(N-hydroxysulfosuccinimide,NHS)均购自Sigma-Aldrich公司;癌胚抗原(Carcinoembryonic antigen,CEA)相应的捕获及检测单克隆抗体对购自美国Fitzgerald公司;羧基修饰的磁珠(粒径6.5μm)购自美国Spherotech公司;量子点(QD-605)、琥珀酰亚胺-4-环已烷-1-碳酸酯(succinimidyl trans-4-(N-maleimidomethyl)cyclohexane-1-carboxylate,SMCC)、二硫苏糖醇(dithiothreitol,DTT)和β-巯基乙醇(β-mercaptoethanol)购自中国武汉珈源量子点公司.血清稀释液(serumdiluent)购自美国Immunochemistry公司.其他试剂均为分析纯,实验用水为超纯水(Millipore,Milli-Q).磁珠储存液(10 mmol/L PBS,pH 7.4,0.1%BSA,0.02%Tween 20),洗液(10 mmol/L PBS,pH 7.4,0.05%Tween 20).
1.1.2仪器
荧光显微镜(OLYMPLUS,BX51);高速离心机(Eppendorf,5804R);分子杂交仪(兴化市仪器分析厂,FYY-3).
1.2方法
1.2.1免疫磁珠捕获探针的制备与表征
EDC与羧基反应形成O-酰基异硫脲中间体,在NHS存在下,该中间体可以转变为具有氨基反应活性的活性酯,从而实现对羧基和氨基的共价偶联.按照磁珠说明书中的方法用癌胚抗原(Carcinoembryonic antigen,CEA)捕获抗体标记免疫磁珠.首先,吸取磁珠储存液后,依次用dH2O和磷酸二氢钠(100 mmol/L,pH 6.2)溶液对磁性微球进行清洗;依次加入10 μL的NHS(50 mg/mL)和EDC(50 mg/mL)溶液,室温下孵育20 min,进行活化;去上清后吸取250 μL MES(50 mmol/L,pH 5.0),清洗2遍后加入单克隆CEA捕获抗体,于25℃杂交仪中孵育1 h;随后用磁珠储存液清洗2遍后重悬,并储存于4℃备用.
免疫磁珠探针制备完成后,吸取4 μL和空白对照组同时与0.5 μL标记有绿色荧光的二抗(Alexa Fluor 488 donkey anti-mouse IgG;2 mg/mL)于37℃孵育1 h,结果如图1所示,表明磁珠上已标记上捕获抗体.
1.2.2量子点检测探针的制备
SMCC一端为NHS酯基团,另一端为马来酰亚胺基团,有NHS酯基团的一端可以与氨基量子点上的伯氨反应形成稳定的酰胺键,另外一端可以与经还原的抗体上的巯基发生特异性交联[16-17].按照武汉珈源量子点公司提供的操作说明进行如下操作:首先,取10 μL 10 mmol/L SMCC对100 μL的氨基量子点(CdSe)进行活化,25℃,60 min;随后采取脱盐柱的方法进行纯化;用20 mmol/L DTT对300 μL CEA抗体进行还原,25℃,30 min;待脱盐柱去除未反应的抗体和其他杂质后,将其与纯化后的活化量子点于杂交仪中孵育,25℃,1 h;加入10 μL β-巯基乙醇终止反应,分离纯化后保存于10 mmol/L PBS(pH 7.2)中,4℃备用.

图1 磁珠探针标记前后的荧光显微镜照片Fig.1 Fluorescence microscope photos of the labled immune magnetic beads
按照上述步骤制备好的量子点荧光探针利用琼脂糖凝胶电泳图进行表征.结果如图2所示:量子点荧光探针由于结合了抗体,分子量变大,其迁移速率变慢.这表明,量子点荧光探针制备成功.

图2 量子点荧光探针标记前后琼脂糖凝胶电泳图Fig.2 Photoimages of gel electrophoresis of IgG-QDs and SMCC-QDs
1.2.3免疫检测
用1%BSA封闭免疫磁珠探针15 min后(杂交仪,25℃,轻摇),加入2 μL CEA抗原及量子点检测探针,杂交仪37℃轻摇孵育1 h;基于免疫特异性识别,磁珠捕获探针、CEA、量子点检测探针形成免疫夹心结构;随后,用洗液清洗2遍,去除未结合的抗原以及量子点探针;磁珠重悬后吸取0.5 μL滴至清洁后载玻片上,选择5个以上视野进行荧光显微拍照,对所得图片进行灰度值分析.

图3 量子点探针检测蛋白原理图Fig.3 Schematic of the basic principles of the proposed assay
1.2.4荧光成像分析
所有荧光图像均用Gray Quantifier分析软件进行统计分析,统计磁珠(100<n<300)表面结合的量子点产生的荧光强度,分析结果用平均数(mean)±标准差(SD)表示.
2 结 果
2.1量子点探针加入量的优化
磁珠探针量确定后,量子点检测探针加入量的不同,会影响方法的分析效果[18].当量子点探针数目过少时,会造成检测范围受限,信号强度变低,易漏检;而过多,不仅背景信号或非特异性信号增强,信噪比下降,损耗最低检测限,而且还存在经济上的浪费.
实验结果如图4所示.磁珠个数为7 500颗,量子点探针的终浓度在0.312 5~5 nmol/L时,荧光强度呈增加趋势,在5 nmol/L时已获得最大荧光强度,即免疫反应程度已达最大化,此后再增加量子点探针的加入量,荧光强度变化平缓,进入饱和期.故而在接下来的实验中,磁珠数目为7 500时,选择5 nmol/L作为量子点探针的最适加入量.

图4 量子点探针加入量对荧光强度结果的影响Fig.4 Effect of QD probes quantity on the detection results
2.2免疫反应检测CEA
图5是基于2.1优化的实验条件下,用本方法检测不同浓度的CEA标准品获得的荧光图片,可以看出,随着CEA浓度的升高,单个磁珠上的平均荧光强度随之增强.将荧光图像用Gray Quantifier分析软件进行统计分析,绘得的标准曲线如图6所示,表明CEA浓度在0. 39~50 ng/mL范围进行线性拟合,方程为lgy=0.586 9lgx+3.572 23(R2=0.988),线性关系良好.将检测信号高于空白对照(不含CEA的缓冲液作为样品)信号的平均值加上其3倍标准差定义为检测限,算得该方法的检测限为38 pg/mL,远低于CEA的临床阈值(5 ng/ mL)[6],满足临床应用需求.
扫描电子显微镜(SEM)照片(见图7)可以看出,磁珠表面粗糙程度增加,表明磁珠上免疫反应进行顺利.
2.3特异性

图5 量子点探针检测CEA的荧光图像Fig.5 Fluorescence images for the detection of CEA
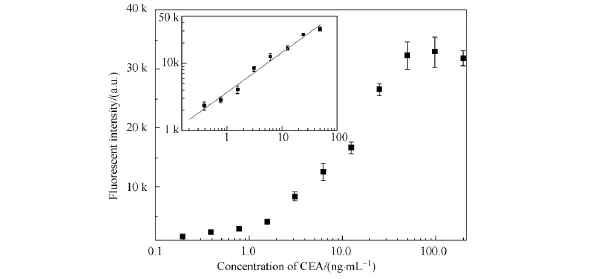
图6 量子点探针检测CEA的标准曲线Fig.6 Standard curve for the detection of CEA

图7 磁珠探针(a)标记前、(b)标记后及(c)反应完成后的扫描电镜图片Fig.7 SEM images of(a)the carboxylic magnetic beads(MBs),(b)MBs-Ab1,and(c)MBs-Ab1/CEA/Ab2-QDs
为了考察基于量子点检测探针的免疫方法对CEA检测的特异性,用这个方法同时检测了非特异性抗原细胞角蛋白19片段(cytokeratin-19 fragments,CYRFA 21-1)、神经元特异性烯醇化酶(neuron specific enolase,NSE)和牛血清蛋白(Bovine serum albumin,BSA).结果(见图8)表明,在没有靶标CEA的情形下,即使非特异性抗原浓度很高(62.5 ng/mL)也不能引起免疫夹心结构的形成,确定了该方法对靶标CEA检测的特异性[19].
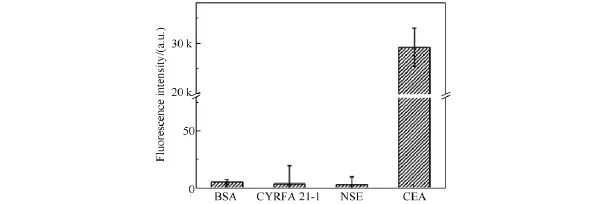
图8 CEA检测特异性Fig.8 Specificity analysis of the immunoassay
2.4准确度和可重复性的验证
取3份已知CEA浓度的质量控制血清用该方法进行检测,计算出相对误差与差异系数分别用以衡量检测方法的可重复性与准确度.每份样本检测3次,结果如表1所示,表明该方法具有稳定的可重复性和良好的准确度,具有临床应用价值[20].

表1 血清CEA含量检测Tab.1 Detection of CEA in human serum
3 讨 论
本方法通过综合利用量子点和磁性微球这两种材料,实现了对肿瘤标志物CEA特异性好、灵敏度高的检测.结果显示,检测灵敏度为38 pg/mL,而传统酶联免疫反应(ELISA)方法检测CEA的灵敏度为1.6 ng/mL[21],提高了约40倍.这主要是由于以下原因:①量子点优异的光学性质;②以免疫磁珠作为固相支持物能够获得更好的动力学表现,免疫反应更充分;③免疫反应发生在免疫磁珠表面,量子点信号被限制在一个小的区域,而且易于富集;④实验过程中一系列为降低非特异性吸附采取的措施.具体分析如下.
免疫分析的基本原理是通过监测由抗原、抗体之间的特异性识别引发的光学、电学、机械学以及磁性等信号的改变对靶标肿瘤标志物进行定性定量[22].因而标记物的信号强度及其检测手段与免疫分析的表现密切相关.作为一种新型荧光纳米材料,量子点具有传统荧光染料不可比拟的优势[23].首先,量子点具有更高的荧光强度且抗光淬灭能力强,能够得到更稳定、更强的光学信号,实现灵敏度更高的检测;其次,量子点具有宽的斯托克斯(Stocks)位移,激发光对发射光的干扰较小,能够提高检测的准确度.
另外,以磁性微球作为免疫反应的固相支持物对蛋白质检测方法也具有重要意义.因其具备的超顺磁性,无需复杂的设备(如离心机),仅借助磁铁,便可简便高效地实现与其他物质的分离与纯化,故而被广泛应用于免疫检测、细胞分离和生物大分子纯化等领域.不仅如此,磁性微球具有的高体表比,使其表面能结合大量抗体,伴随着轻微震荡,磁性微球能够均匀地分散在体系中,大大提高了抗原与抗体的结合效率,具有较以平板作为支持物更佳的动力学表现[13-14].
目前针对量子点信号的读取方式主要有两种,光谱分析和荧光图像分析.光谱分析主要是通过记录量子点发射峰的峰值来实现定量的目的,此方法对样本体积量要求大,导致量子点产生的荧光信号会被分散在一个较大的体积内(通常是0.1~1 mL),故而需要更多的量子点才能产生区别于背景信号的信号强度[24].而本方法是通过荧光成像分析方法对富集在磁珠表面的量子点荧光信号进行直接读取.量子点信号被富集在直径为6.5 μm的磁珠表面,灵敏度得到较大的提升.此外,量子点具有宽吸收窄发射、发射波长随尺寸可调性等优异光学特性,不同尺寸量子点在单一激发光源的激发下,能够发射出不同波长也即不同颜色的荧光,通过对荧光图像中诸如颜色、面积和强度等特征进行分析,可以同时实现对靶标物质的定性与定量的双重目的,从而实现对多种标志物的联合检测.
本方法通过综合利用量子点和磁性微球这两种材料,实现了对CEA特异性好、灵敏度高的检测.除此之外,在实验过程中选用特异性高的单克隆抗体对完成免疫识别,对进行磁珠探针表面未结合的位点进行封闭,用含有0.05%TWEEN 20的洗液对免疫复合物进行两遍清洗,这些操作都能有效降低非特异性吸附,提高信噪比,进而获得实验的检测灵敏度.
除灵敏度外,分析检测范围、特异性、准确度和可重复性也是衡量一个分析方法优劣的基本参数.实验结果表明,该方法的特异性优,准确度和可重复性表现好,这与筛选的单克隆抗体对具有高的特异性有关.而对于分析检测范围,本实验标准曲线的线性范围在0.39~50 ng/mL之间,满足肺癌早期预警的临床需求.当样本中CEA含量过高时,可通过稀释样本或者增多磁珠数目进行调节,反之,也可以通过减少磁珠的量或者增大样品体积进行调节.
4 结 论
本文介绍了一种基于量子点探针和磁性微球的蛋白质检测方法,该方法利用量子点作为荧光标记物,同时利用磁性微球作为固相支持物,实现了通过普通光学仪器对CEA特异性好、灵敏度高、样品消耗量少的定量检测.该方法操作步骤简单,所需仪器设备普及,对蛋白质检测具有普遍适用性,在疾病早期诊断领域具有广阔的前景.
[1]WAGNER M K,LI F,LI J,et al.Use of quantum dots in the development of assays for cancer biomarkers[J].Anal Bioanal Chem,2010,397(8):3213-3224.
[2]LI X,ASMITANANDA T,GAO L,et al.Biomarkers in the lung cancer diagnosis:A clinical perspective[J].Neoplasma,2012,59(5):500-507.
[3]SUNG H J,CHO J Y.Biomarkers for the lung cancer diagnosis and their advances in proteomics[J].BMB Rep,2008,41(9):615-625.
[4]SIEGEL R,MA J,ZOU Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[5]MITSUHASHI N,TAKAHASHI T,SAKURAI H,et al.Establishment and characterization of a new human lung poorly differentiated adenocarcinoma cell line,GLL-1,producing carcinoembryonic antigen(CEA)and CA19-9[J].Lung Cancer,1995,12(1/2):13-24.
[6]GRUNNET M,SORENSEN J B.Carcinoembryonic antigen(CEA)as tumor marker in lung cancer[J].Lung Cancer,2012,76(2):138-143.
[7]JIA C P,ZHONG X Q,HUA B,et al.Nano-ELISA for highly sensitive protein detection[J].Biosens Bioelectron,2009,24(9):2836-2841.
[8]XIANG D S,ZENG G P,HE Z K.Magnetic microparticle-based multiplexed DNA detection with biobarcoded quantum dot probes[J].Biosens Bioelectron,2011,26(11):4405-4410.
[9]PENG Z A,PENG X.Formation of high-quality CdTe,CdSe,and CdS nanocrystals using CdO as precursor[J].J Am Chem Soc,2001,123(1):183-184.
[10]PETRYAYEVA E,ALGAR W R,MEDINTZ I L.Quantum dots in bioanalysis:A review of applications across various platforms for fluorescence spectroscopy and imaging[J].Appl Spectrosc,2013,67(3):215-252.
[11]KLIMOV V I.Spectral and dynamical properties of multiexcitons in semiconductor nanocrystals[J].Annu Rev Phys Chem,2007,58:635-673.
[12]SMITH A M,NIE S.Semiconductor nanocrystals:Structure,properties,and band gap engineering[J].Acc Chem Res,2010,43(2):190-200.
[13]YU X,XIA H S,SUN Z D,et al.On-chip dual detection of cancer biomarkers directly in serum based on self-assembled magnetic bead patterns and quantum dots[J].Biosens Bioelectron,2013,41:129-136.
[14]PARK H,HWANG M P,LEE J W,et al.Harnessing immunomagnetic separation and quantum dot-based quantification capacities for the enumeration of absolute levels of biomarker[J].Nanotechnology,2013,24(28):285103.
[15]DUNBAR S A.Applications of Luminex xMAP technology for rapid,high-throughput multiplexed nucleic acid detection[J].Clin Chim Acta,2006,363(1-2):71-82.
[16]GOKARNA A,JIN L H,HWANG J S,et al.Quantum dot-based protein micro-and nanoarrays for detection of prostate cancer biomarkers[J].Proteomics,2008,8(9):1809-1818.
[17]CHENG X,PU X,JUN P,et al.Rapid and quantitative detection of C-reactive protein using quantum dots and immunochromatographic test strips[J].Int J Nanomedicine,2014(9):5619-5626.
[18]ZHU X,DUAN D,PUBLICOVER N G.Magnetic bead based assay for C-reactive protein using quantum-dot fluorescence labeling and immunoaffinity separation[J].Analyst,2010,135(2):381-389.
[19]ZHOU L,OU L J,CHU X,et al.Aptamer-based rolling circle amplification:A platform for electrochemical detection of protein[J].Anal Chem,2007,79(19):7492-7500.
[20]WHITEAKER J R,ZHAO L,ZHANG H Y,et al.Antibody-based enrichment of peptides on magnetic beads for massspectrometry-based quantification of serum biomarkers[J].Anal Biochem,2007,362(1):44-54.
[21]LIU M,JIA C,HUANG Y,et al.Highly sensitive protein detection using enzyme-labeled gold nanoparticle probes[J]. Analyst,2010,135(2):327-331.
[22]SWIERCZEWSKA M,LIU G,LEE S,et al.High-sensitivity nanosensors for biomarker detection[J].Chem Soc Rev,2012,41(7):2641-2655.
[23]ESTEVE-TURRILLAS F A,ABAD-FUENTES A.Applications of quantum dots as probes in immunosensing of small-sized analytes[J].Biosens Bioelectron,2013,41:12-29.
[24]WANG J,MOUNTZIARIS T J.Homogeneous immunoassays based on fluorescence emission intensity variations of zinc selenide quantum dot sensors[J].Biosens Bioelectron,2013,41:143-149.
(责任编辑:张晶)
Ultrasensitive detection of protein biomarker using fluorescent quantum dot probes
WU Si-min1,2, JIA Chun-ping2, LIU Li-fen2, GAO Wan-lei2, JING Feng-xiang2,JIN Qing-hui2, ZHANG Hong-feng1, ZHAO Jian-long2
(1.School of Life Sciences,East China Normal University,Shanghai200241,China;2.State Key Laboratory of Transducer Technology,Shanghai Institute of Microsystem and Information Technology,Chinese Academy of Sciences,Shanghai200050,China)
In this study,based on the unique properties of quantum dots(QDs)and immune magnetic beads,an fluorescent assay was built to detect low concentration carcinoembryonic antigen(CEA).The assay was carried out in a sandwich formation in which two antibodies simultaneously recognized two separate binding sites on the same target CEA.After enrichment with magnetic separator,the fluorescent intensities produced by the QDs,which were confined to the surface of the beads,could be read efficiently to quantify the concentration of the CEA.For this assay,the limit of detection was 38 pg/mL with the linear range was from 0.39 to 50 ng/mL,and it has been proved with high accuracy and repeatability in tumor marker control.With the high sensitivity,specificity and low sample consumption,this method takes a big step to the early diagnosis of diseases.
quantum dots; immunofluorescence assay; magnetic beads; tumor marker
N39;Q71;R730.45
A
10.3969/j.issn.1000-5641.2016.02.016
1000-5641(2016)02-0144-09
2015-03
国家重点基础发展计划(2012CB933303);国家自然科学基金(81101645,61271162,81472751,21405167);上海市科委项目(12nm0503702,11JC1414400,BRC2012002);东南大学生物电子学国家重点实验室开放研究项目
吴思敏,女,硕士研究生,研究方向为肿瘤生物学.E-mail:wusimin_mail@163.com.
张红锋,女,副教授,硕士研究生,研究方向为肿瘤生物学. E-mail:hfzhang@bio.ecnu.edu.cn.贾春平,女,副研究员,硕士生导师,研究方向为生物传感器.E-mail:jiachp@mail.sim.ac.cn.
