甘精胰岛素注射液对1型糖尿病模型大鼠的降血糖作用
2016-11-10宋紫辉张慧霞项宗尚范明源蔡永明张宗鹏
宋紫辉 张慧霞 项宗尚 范明源 蔡永明 张宗鹏
(天津药物研究院新药评价有限公司,天津 300301)
· 基础研究 ·
甘精胰岛素注射液对1型糖尿病模型大鼠的降血糖作用
宋紫辉△张慧霞△项宗尚范明源蔡永明张宗鹏*
(天津药物研究院新药评价有限公司,天津 300301)
目的采用链脲佐菌素(streptozotocin,STZ)诱导的大鼠1型糖尿病(insulin-dependent diabetes mellitus,IDDM)模型,评价甘精胰岛素注射液的降血糖作用。方法健康雄性SD大鼠,单次尾静脉注射2%(质量分数)STZ 58 mg/kg制备IDDM模型,采用随机数字表法将造模成功的动物(禁食血糖≥16.7 mmol/L)分为供试品甘精胰岛素注射液(glargine injection)低、中和高3个剂量组、参照药来得时(Lantus)中剂量组和模型对照组,每组15只;同时设正常对照组。各组动物分别皮下注射甘精胰岛素、来得时或等体积的溶媒,每天给药,连续给药9周。每周定时检测大鼠随机血糖、体质量、摄食量和饮水量;给药结束后,采用全自动生化分析仪检测血清中尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)、总胆固醇(total cholesterol, TC)和三酰甘油(triglyceride, TG);采用比色法定量检测糖化血红蛋白(glycosylated hemoglobin, GHb)。结果与模型对照组相比,甘精胰岛素注射液各剂量组大鼠:①体质量增加、摄食量减少;②给药后1 h血糖开始降低,2 h降至最低,8 h基本恢复到给药前,且具有剂量依赖性;③GHb不同程度地降低,具有明显的剂量-效应关系;④血清中BUN和TG降低。结论在4~8 IU/kg剂量范围内,每日皮下注射2次甘精胰岛素注射液,明显改善IDDM模型大鼠的高血糖症状,其作用效果与来得时相当;连续给药9周后,模型大鼠的血清BUN、TG和GHb显著降低,提示其具有保护肾功能、调节血脂的作用,并能减少糖尿病合并症的发生。
链脲佐菌素;1型糖尿病;甘精胰岛素;糖化血红蛋白
糖尿病(diabetes mellitus,DM)已成为危害人类健康的全球性难题,尤其1型糖尿病临床症状更为严重且患病率以每年2%~5%的增长速度不断蔓延[1],其发生的主要原因是自身免疫介导的胰腺β细胞破坏,从而引起胰岛素的缺失,因此患者必须进行外源胰岛素的强力治疗。甘精胰岛素(glargine)作为一种新型长效降糖药物[2],其效应-时间曲线更平稳,弥补了传统胰岛素注射频率高、夜间低血糖等缺点,具有独特的临床应用优势。链脲佐菌素(streptozotocin,STZ)是由无色链霉菌属发酵产生,可以对动物胰岛β细胞进行选择性的破坏。采用大剂量一次性注射的方法可以造成动物持续性高血糖[3],与人类1型糖尿病临床表现相似,可作为评价1型糖尿病较为理想的动物模型。本试验采用STZ诱导的SD大鼠1型糖尿病模型,通过对血糖、血清生物化学指标及糖化血红蛋白(glycosylated hemoglobin,GHb)进行监测,研究甘精胰岛素对糖尿病大鼠的降血糖作用,为甘精胰岛素的临床药效学评价提供参考依据。
1 材料与方法
1.1动物、药品与主要仪器
SPF级雄性SD大鼠120只,体质量170~220 g,由北京维通利华实验动物技术有限公司提供,生产许可证号为:SCXK(京)2012-0001,动物质量合格证号为:11400700075484。所有动物均有检疫证书,研究方案经动物福利委员会(Institutional Animal Care and Use Committee,IACUC)认证批准。动物饲养于天津药物研究院新药评价有限公司动物实验楼(屏障环境),温度设定范围20 ℃~26 ℃,湿度设定范围40 %~70 %,换气次数不少于每小时15次全新风,光照时间为12 h明12 h暗交替。大鼠均适应性饲喂11 d后进行正式实验。
甘精胰岛素注射液(glargine injection,300 IU, 3 mL,批号:20130701),来得时注射液(lantus injection,300 IU, 3 mL,赛诺菲安万特(北京)制药有限公司,批号:3B011A),甘精胰岛素注射液溶媒(批号:20130701),链脲佐菌素(1.0 g/支,批号:SLBJ7785V,美国Sigma公司)。
Accu-Chek Performa卓越型血糖仪(瑞士罗氏公司),血糖试纸(瑞士罗氏公司,批号:473034),LXJ-IIB冷冻离心机(上海安亭科学仪器厂),大鼠糖化血红蛋白检测试剂盒(南京建成生物工程研究所,批号:20150304),TU-1810D型紫外可见分光光度计、DK-98-II电热恒温水浴锅(天津市泰斯特仪器公司)。
1.2试验方法
1)1型糖尿病(insulin-dependent diabetes mellitus,IDDM)模型的建立:将120只雄性大鼠适应性饲养11 d后禁食18 h后采用刺破尾静脉取微量血的方法测定空腹血糖,采用数字表法随机选15只大鼠作为正常对照组,正常组尾静脉注射STZ的稀释溶剂,即柠檬酸钠缓冲液(0.1 mol/L、pH 4.2)。其余105只大鼠尾静脉注射质量分数为2%(质量分数)的STZ溶液,58 mg/kg,造模72 h后连续3 d监测大鼠禁食6 h后的空腹血糖,若连续3次空腹血糖均≥16.7 mmol/L者视为造模成功。
2)分组与给药:选择造模成功的75只大鼠,采用随机数字表法将动物分为糖尿病模型对照组、甘精胰岛素低剂量组(2 IU/kg)、中剂量组(4 IU/kg)、高剂量组(8 IU/kg)和来得时对照组(4 IU/kg),每组15只,采用皮下注射方式,每日给药1次,正常对照组和模型对照组皮下注射给予等体积的溶媒。因连续给药2周后甘精胰岛素低剂量组未检测到降血糖作用,所以调整给药剂量,即低剂量组(4 IU/kg)、中剂量组(6 IU/kg)、高剂量组(8 IU/kg)和来得时对照组(6 IU/kg);给药频率调整为每日2次,继续给药7周。
3)血糖、体质量、摄食量和饮水量的测定:采用刺破尾静脉取微量血的方法检测大鼠的随机血糖,给药后的第1天、7天(第1周)、63天(第9周)检测全点餐后血糖,具体时点为0 h(给药前)、1、2、5和8 h(给药后);第2、3、4、5、6、7和8周检测0 h(给药前)及给药后2 h或5 h餐后血糖值。并以给药前血糖浓度作为基础血糖浓度,计算降糖率:降糖率(%)=(基础血糖浓度-给药后血糖浓度)/基础血糖浓度×100,于给药前及给药期间每周称量1次动物空腹体质量(空腹3 h)和每笼(5只/笼)大鼠18 h内的饮食量/饮水量。计算每只大鼠约18 h内的平均摄食/饮水量:平均摄食/饮水量=(加料/水量—余料/水量)/ 每笼动物只数。
4)大鼠血清生物化学指标和GHb测定:给药结束后,大鼠经20 %(质量分数)乌拉坦麻醉,腹主动脉取血,采用全自动生化分析仪测定血清中尿素氮(blood urea nitrogen, BUN)、三酰甘油(triglyceride, TG)、肌酐(creatinine, Cr)和总胆固醇(total cholesterol, TC);比色法测定糖化血红蛋白。
1.3统计学方法

2 结果
2.1各组大鼠体质量、摄食量和饮水量的比较
给药期间,甘精胰岛素注射液各剂量组和来得时对照组动物体质量均呈增长趋势,各检测时点内体质量均值均高于同期模型对照组,且从第5周开始均与同期模型对照组差异有统计学意义(P<0.01),但均低于正常对照组动物体质量的增长。相同剂量下的供试品与原研对照品相比,体质量增长较为一致,差异无统计学意义(P>0.05)。结果详见图1A。从第5周开始,甘精胰岛素注射液各剂量组和来得时对照组动物的摄食量均值均低于同期模型对照组,中和高剂量组较低剂量组更为明显。结果见图1B。各剂量组和来得时对照组动物的饮水量与同期模型对照组相比差异均无统计学意义。
2.2各组大鼠血糖和降糖率的比较
第9周给药前,各治疗组和模型对照组的血糖值差异无统计学意义(P>0.05)。给药后各检测时点,模型对照组和正常对照组血糖和降糖率与给药前相比无明显变化;甘精胰岛素注射液各剂量组和来得时对照组的动物血糖浓度在皮下注射给药后1 h开始下降,并于2 h降至最低,此时,低、中和高剂量组的平均降糖率分别为57.8%、64.6%和70.8%。与模型对照组相比差异有统计学意义(P<0.01),且具有一定的剂量效应关系;来得时对照组与同剂量甘精胰岛素给药组相比差异无统计学意义(P>0.05)。随给药时间延长,给药后5 h血糖浓度逐渐回升,8 h基本恢复到给药前浓度。结果详见表1和表2。
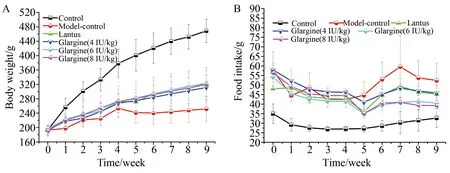
图1 大鼠给药期平均体质量(A)和摄食量(B)随时间的变化曲线
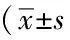
Tab.1 Effect of glargine on random fed blood glucose levels after 9 weeks subcutaneous injection administration in rats , n=15)
*P<0.05vsmodel-control group;**P<0.01vsmodel-control group.
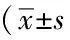
表2 皮下给药9周后大鼠随机血糖降糖率
2.3各组大鼠糖化血红蛋白和血清生物化学指标比较
连续给药9周后,正常对照组每10 g血红蛋白中GHb的吸光度均值为21.3,模型对照组均值为66.2,约为正常对照组的3倍,提示模型对照组的高血糖持续稳定。甘精胰岛素注射液低、中和高剂量组大鼠GHb的吸光度均值分别为35.6、30.9和28.5,较模型对照组(66.2)均有明显地降低(P<0.01),并具有一定的剂量效应关系;原研对照组吸光度均值为38.4,与供试品甘精胰岛素注射液中剂量组相比差异无统计学意义(P>0.05)。结果提示,在本试验条件下,大鼠连续皮下注射甘精胰岛素注射液9周,每天2次,能明显降低IDDM模型动物GHb,对IDDM大鼠具有一定的治疗作用。
连续给药9周后,甘精胰岛素注射液各剂量组和原研对照组动物的血清中BUN均值低于模型对照组,且差异有统计学意义(P<0.01);TG各剂量组均值均明显低于模型对照组(P<0.05或P<0.01),且具有一定的剂量相关性。各给药组动物Cr和TC含量与模型对照组比较未见明显变化(P>0.05)。具体结果详见表3。
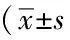
表3 皮下给药期结束大鼠糖化血红蛋白和主要血清生物化学指标比较
*P<0.05vsmodel-control group;**P<0.01vsmodel-control group; BUN:blood urea nitrogen; Cr:creatinine; TC:total cholesterol; TG:triglyceride; GHb:glycosylated hemoglobin.
3 讨论
链脲佐菌素通过损伤胰腺β细胞使得胰岛素的合成减少从而引发糖尿病[4-5]。β细胞受损程度与STZ剂量和给药途径相关[6];另外,STZ的作用强度与动物种属和性别有关,雄性大鼠较雌性大鼠更为敏感[7]。因此,本试验结合受试药物特点和预试验结果,选择雄性大鼠一次性静脉注射链脲佐菌素58 mg/kg制备胰岛素依赖型糖尿病动物模型,试验结果显示,该模型稳定,为受试药甘精胰岛素注射液药效学评价提供了较为理想的高血糖模型。
甘精胰岛素注射液是一种新型的长效胰岛素类似物,缓释作用机制是通过DNA重组技术对人胰岛素氨基酸序列进行结构修饰,改变了胰岛素的等电点,当药物注射到皮下组织后因pH发生改变而引起溶解度下降最后形成微细沉积物,该沉淀物可持续释放少量的甘精胰岛素,更大程度地延长了其吸收、分布时间[8-9]。本试验结果显示甘精胰岛素的起效时间为1 h,2 h药效作用最强,作用持续时间超过5 h,8 h后血糖基本恢复到给药前水平。为更好的维持血糖平稳,实验期间给药剂量和频率进行了合理的调整,提示甘精胰岛素在临床应用时,应实施个体化治疗,根据血糖控制情况,及时调整给药剂量和频率,使得血糖平稳控制在基础血糖范围内,同时避免夜间低血糖的发生。
糖、蛋白质及脂肪代谢紊乱是糖尿病的临床综合征,持续高血糖可引起机体多系统、多脏器功能损害衰竭等各种慢性合并症。BUN是评价肾功能的指标之一;而TG过高会增加动脉粥样硬化性心血管疾病的风险[10]。在糖尿病模型大鼠中,这两个指标均异常升高;而经甘精胰岛素注射液治疗后各剂量组的血清BUN和TG与模型对照组相比有了不同程度的降低(P<0.01),表明甘精胰岛素注射液能够通过降血糖和降血脂等起到对肾脏的保护作用,从而有效减少糖尿病肾病和心血管疾病的发生率。
目前,空腹血糖检查是一般临床上诊断糖尿病的常用指标,但空腹血糖仅代表抽血时的瞬时血糖,受多种因素影响较大而出现漏诊[11-12]。而GHb是由血液中葡萄糖的游离醛基与血红蛋白的β链N末端缬氨酸的氨基进行不可逆的非酶促反应形成的,主要取决于血糖浓度及血糖与Hb的接触时间[13-14]和红细胞的寿命,不受测定时间、瞬时血糖水平等的影响[15]。2002年美国糖尿病协会明确规定应定期检测GHb,并将其作为监测糖尿病患者血糖控制情况的金指标[16-17]。本研究数据表明,甘精胰岛素注射液各剂量组的糖化血红蛋白较模型组有明显降低(P<0.01),说明糖尿病大鼠血糖控制良好,从而有效地降低了糖尿病所引起的合并症。
[1]Daneman D. State of the world’s children with diabetes [J]. Pediatr Diabetes, 2009, 10(2): 120-126.
[2]Chakkarwar P N, Manjrekar N A. Insulin glargine:a long acting insulin analog [J]. J Postgrad Med, 2005, 51(1): 68-71.
[3]Kim Y T, Steinberg C. Immunologic studies on the induction of diabetes in experimental animals: cellular basis for the induction of diabetes by streptozotocin [J]. Diabetes,1984, 33(8): 771-777.
[4]张璞, 李容瑢, 李一欣, 等. 1型糖尿病小鼠模型构建及胰岛B细胞中胰岛素表达[J]. 贵阳医学院学报, 2014, 39 (2): 171-175.
[5]Like A A, Rossini A A. Streptozotocin-induced pancreatic insulitis: new model of diabetes mellitus [J]. Science, 1976, 193(4251): 415-417.
[6]Saini K S, Thompson C, Winterford C M, et al.Streptozotocin at low doses induces apoptosis and at high doses causes necrosis in a murine pancreatic beta cell line, INS-1 [J]. Biochem Mol Biol Int., 1996, 39(6):1229-1236.
[7]Rossini A A, Williams R M, Appel M C, et al.Sex differences in the multiple-dose streptozotocin model of diabetes [J]. Endocrinology, 1978, 103(4):1518-1520.
[8]Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues versus NPH human insulin in type 2 diabetes :a meta-analysis[J]. Diabetes Res Chin Pract, 2008,81(2):184-189.
[9]Rosenstock J, Dailey G, Massi-Benedetti M. Reduced hypoglycemia risk with insulin glargine: a meta-analysis comparing insulin glargine with human NPH insulin in type 2 diabetes[J]. Diabetes Care, 2005, 28(4):950-955.
[10]邓正照, 钱荣立. 糖尿病脂代谢异常与治疗[J].中国糖尿病杂志, 2001, 9(4): 251-254.
[11]顾燕, 罗建华,王亚林,等. 暴发性1型糖尿病四例临床分析[J]. 临床误诊误治,2015,28(8) :20-23.
[12]赵向府, 庄晓明,吴小娟,等. 中国人暴发性1型糖尿病2例病例临床特点总结及文献复习[J]. 首都医科大学学报,2013,34(3) :466-469.
[13]American Diabets Association. Implications of the United Kingdom Prospective Diabets Study [J]. Diabets Care, 2000, 23(Suppl): S27-S31.
[14]King H, Aubert R E, Herman W H. Global burden of diabets, 1995-2025: prevalence, numerical estimates, and projections [J]. Diabets Care, 1998, 21(9): 1414-1431.
[15]周新, 涂植光. 临床生物化学和生物化学检验[M]. 3版. 北京: 人民卫生出版社, 2006: 89.
[16]王笠, 李琳, 王达, 等. 糖化血红蛋白的检测和临床应用[J]. 上海医学检验杂志, 2003, 18(2) :119-121.
[17]程千鹏, 张星光,吕肖锋. 血糖控制达标的2型糖尿病患者血糖波动特征及其控制目标探讨[J]. 解放军医药杂志,2013,25(11) :24-27.
编辑孙超渊
, E-mail:zhangzp@tjipr.com
Antihyperglycemic effect of glargine injection in rat model of type 1 diabetes
Song Zihui△, Zhang Huixia△, Xiang Zongshang, Fan Mingyuan,Cai Yongming, Zhang Zongpeng*
(TianjinInstituteofPharmaceuticalResearchNewDrugEvaluationCompanyLimited,Tianjin300301,China)
ObjectiveTo evaluate the antihyperglycemic effect of glargine in streptozotocin (STZ)-induced type 1 diabetes in rats. MethodsHyperglycemic type 1 diabetic rats were obtained by intravenous injection of 2% STZ at the dose of 58 mg/kg and the success was adjudged by fasting glucose (≥16.7 mmol/L) within 3 consecutive days. Subsequently, 75 hyperglycemic rats were divided into five groups randomly and were treated with different doses of glargine, Lantus or control vehicle for 9 weeks, respectively. Meanwhile, a group consisted of 15 euglycemic rats was regarded as the control group and injected with control vehicle as well. Blood glucose levels, body weights, food intake and water intake in chow fed rats were measured weekly. Serum blood urea nitrogen (BUN), creatinine (Cr), total cholesterol (TC) and triglyceride (TG) were determined by automatic analyzer and glycosylated hemoglobin (GHb) was measured by rat glycosylated hemoglobin assay kits. ResultsCompared with model-control, an increase in body weight and a decrease in food intake were observed in rats treated with different doses of glargine. Also, glycemic levels in glargine group rats began to decline at 1 h post-injection, achieved minimally at 2 h and maintained for the following 8 hours. The reduction of GHb was dose-dependent and the decrease of serum concentration of BUN and TG was significant. ConclusionGlargine, consistent with Lantus, can lower the blood glucose in STZ-induced type 1 diabetic rats remarkably when injected twice daily with the dose of 4~8 IU/kg. It has the potent protection of kidney and regulation of blood lipid by decreasing serum concentration of BUN and TG, and could reduce the risk of diabetes complications by decreasing GHb level, as well.
streptozotocin (STZ); type 1 diabetes; glargine; glycosylated hemoglobin(GHb)
国家科技重大专项(2013ZX09302301)。This study was supported by National Science and Technology Major Project(2013ZX09302301).
时间:2016-10-1610∶55
http://www.cnki.net/kcms/detail/11.3662.R.20161016.1055.008.html
10.3969/j.issn.1006-7795.2016.05.018]
R 96
2016-02-03)
△共同第一作者
