山桐子(Idesia polycarpa Maxim)果实多酚的抗炎、抗菌活性研究
2016-11-10祖元刚
昝 鹏 张 琳 祖元刚 杨 磊 丛 赢
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
山桐子(IdesiapolycarpaMaxim)果实多酚的抗炎、抗菌活性研究
昝 鹏 张 琳*祖元刚 杨 磊 丛 赢
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
多酚类物质是植物体中重要的次级代谢产物,为充分利用山桐子果实,将果实中多酚类物质提取出来,并对其抗炎、抗菌效果进行研究。利用LSP诱导RAW264.7细胞产生炎症,经不同浓度给药后对MTT、细胞产生NO量进行测定;选取粪肠球菌、枯草芽孢杆菌、鼠伤寒沙门氏菌进行抗菌实验,判断抑菌效果。结果表明:山桐子果实中总多酚含量为6.6 mg·g-1;给药组浓度依次为50、100和200 μg·mL-1,随着给药浓度的增加RAW264.7细胞活力值也在增大,NO释放量随着给药浓度的升高降低,山桐子果实多酚对选取的三种细菌抑菌能力由强到弱为:枯草芽孢杆菌>沙门氏菌>粪肠球菌。
山桐子果实;多酚;抗炎;抗菌
山桐子(IdesiapalycarpaMaxim)是大风子科(Flacourtiaceae)山桐子属(Idesia)多年生木本植物。山桐子是高大落叶乔木,生长环境集中在我国秦岭以南及淮河一带[1~2],其对环境适应性强,对生长土壤的要求并不严格,可耐旱耐贫瘠。山桐子外型美观可在城市绿化方面作为优良树种,其果实产量极高,果实中含有较多油脂,多做生物柴油的原料,以减轻对石油需求的压力[3]。此外,山桐子油的安全性被越来越多的人认可,油中富含不饱和脂肪酸和亚油酸[4],如今已经走进亚洲许多国家的餐桌[5]。山桐子果实提取油脂后剩余大量的果实残渣,而残渣中多酚类物质利用较少。
植物的果实中含有的多酚类物质具有多种生物活性。有研究表明,胡桃楸多酚对亚硝酸根离子具有较强的抗氧化活性[6];Lamothe S[7]等在茶多酚中发现儿茶素和单宁类的抗氧化活性较强;Kazeem等[8]研究得出姜多酚具有抗氧化能力;多酚氧化活性迷迭香多酚>可可多酚>橄榄油多酚[9]。多酚类物质还有较强的抗癌活性,有文献报道多酚的抗癌功效在癌症的各个阶段都有存在[10],Korkina L.G[11]等认为天然植物多酚可用于药妆方面,且不损伤正常细胞的同时抑制癌细胞的转化;除此之外,多酚类化合物还可防治糖尿病[12]、抗炎[13]、治疗心脑血管疾病[14~15],临床实验证实,苹果多酚可以有效降低血浆中TC、LDL-C水平[16]。山桐子果实多酚的研究中,Seung Hyun Kim发现脱脂后的果渣中含有抑制脂多糖诱导的BV2细胞中NO生成的活性成分[17],另外还发现山桐子果实中的成分增加C2C细胞HSP70水平,使H2O2-induced氧化应激抵抗能力增强[18]。
山桐子生长迅速,果实产量多果实油产量高,除了食用价值外,其果实中多酚类物质的药用价值更是不可忽略。本文拟对山桐子果实多酚的抗炎和抑菌效果进行考察,确定其多酚类成分抗炎和抑菌效果,为寻找天然抗炎抗菌活性成分提供理论依据。
1 材料和方法
1.1 实验材料与药品
RAW264.7细胞由中国细胞库典藏细胞中心购买提供;粪肠球菌购自中国微生物菌种保藏中心;枯草芽孢杆菌、鼠伤寒沙门氏菌购自北京北纳创联生物技术研究院;胰蛋白胨大豆肉汤培养基由杭州百思生物技术有限公司提供,NO试剂盒购自Griess;MTT购自Sigma,FBS购自Gibco,DMEM低糖培养基购自Hyclone等。
1.2 山桐子果实多酚的提取
脱脂:将饱满的山桐子果实在鼓风干燥箱内低温烘干粉碎后过60目筛,按照料液比1∶20加入正己烷,25℃恒温震荡24 h,抽滤后将溶液与果实粉末分别收集,再按照料液比1∶10加入正己烷,恒温条件下继续震荡24 h,抽滤后取滤渣低温烘干[19]。
多酚提取:准确称取脱脂后干燥的粉末10 g,置于三角烧瓶内,向三角烧瓶中加入100 mL酸化甲醇溶液[20],超声仪中振荡1 h后离心收集上清,滤渣重复上述操作。合并两次滤液,旋转蒸发仪上回收滤液中的有机溶剂,粗提液4℃冰箱保存备用。
1.3 多酚含量检测
根据福林—肖卡法原理,将粗提液与福林肖卡试剂及碳酸钠溶液混匀,避光反应后765 nm比色法测定吸光度值,空白调零,每个样品重复三次,结果以没食子酸等价值表示。设置没食子酸浓度梯度为1、2、4、6、8、10 mg·mL-1,绘制标准曲线。
1.4 RAW264.7细胞培养
RAW264.7细胞置于含10%FBS和1%双抗的DMEM低糖培养基,温度37℃,CO2浓度5%。定期观察细胞形态并更换培养基,待细胞生长到对数生长期进行指标检测。
1.5 脂多糖(LPS)诱导细胞炎症及药物刺激
细胞培养至对数生长期后细胞移入96孔板,将细胞浓度调整到1.0×104个/mL,各孔中用培养基定容至100 μL。加LPS使每孔终浓度为1 μg·mL-1,24 h后吸出培养基,经PBS清洗后将细胞板分组,各孔按给药量刺激后用培养基定容至100 μL继续于37℃、CO25%培养箱内培养。
1.6 RAW264.7细胞活力检测
RAW264.7细胞分为五组,分别为不添加任何药物的空白组、阳性对照选择20 μg·mL-1地塞米松和山桐子多酚50、100、200 μg·mL-1组,经1.5步骤后药物作用24 h,每孔中加20 μg 0.5% MTT,孵育4 h,再加入100 μL DMSO震荡10 min,酶标仪490 nm处检测。细胞活力以溶剂对照为100%,按下式计算细胞活力:

1.7 RAW264.7细胞分泌NO含量的测定
RAW264.7细胞分为五组,分别为不添加任何药物的空白组、阳性对照选择20 μg·mL-1地塞米松和山桐子多酚50、100、200 μg·mL-1组,按照1.5方法处理后,1 000 g离心15 min,取50 μL上清到细胞板中,将Griess试剂A 50 μL加入上清中,室温避光静置5 min,再加入50 μL试剂B,室温避光静置10 min,540 nm检测吸光度值并绘制NO标准曲线。
1.8 细菌培养基的配制及菌种选择与活化
枯草芽孢杆菌培养基:葡萄糖0.5 g,蛋白胨1 g,酵母粉0.5 g,氯化钠1 g,琼脂粉18~20 g,加入1 L蒸馏水,加热煮沸,直到完全溶解,用1%氢氧化钠和50%柠檬酸钠调节其pH至7.4~7.6,121℃高压灭菌15 min后备用。
胰蛋白胨大豆肉汤培养基:取其43 g,琼脂粉18~20 g,加入1 L蒸馏水,加热煮沸,直到完全溶解,121℃高压灭菌15 min后备用。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂粉18~20 g,加入1 L蒸馏水,加热煮沸,直到完全溶解,用1%氢氧化钠和50%柠檬酸钠调节其pH至7.4~7.6,121℃高压灭菌15 min后备用。
菌种购自菌种保藏中心的冻干粉,无菌条件下,溶解安瓿瓶中冻干粉,吸出菌液接种到固体培养基中,在37℃的培养箱中,培养18~24 h。在已活化的菌种培养基中刮取少量菌种,接种到相对应的无菌液体培养基内,37℃下摇床中培养18~24 h。
1.9 抑菌圈的测定
将直径6 mm的圆形滤纸片121℃ 20 min灭菌。移液枪吸取200 μL菌悬液均匀涂布于平板中,无菌镊取滴加5 μL 50 μg·mL-1果实多酚的滤纸片呈倒三角放置于平板,无果实多酚的滤纸片为空白对照,培养箱37℃培养24 h。每种菌平行3组计算抑菌圈直径。
1.10 统计学分析
采用SPSS17.0进行数据统计分析,采用DUNCAN检测,以P<0.05代表差异具有统计学意义。
2 结果与分析
2.1 山桐子果实多酚总量测定
根据方法1.3步骤,以标准品浓度为横坐标,吸光度值(A)为纵坐标,绘制没食子酸标准曲线,在1~10 mg·L-1浓度范围内线性关系良好,回归方程为Y=0.102 2X-0.014 7,R2=0.998 3。根据回归方程计算,山桐子果实的多酚含量为6.6 mg·g-1。
2.2 细胞活力检测
山桐子果实多酚与RAW264.7细胞作用后细胞活力测定结果如图1。
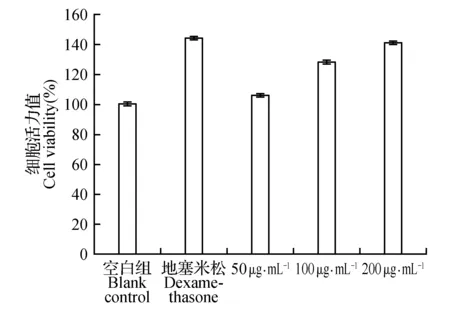
图1 山桐子果实多酚对LPS诱导RAW264.7细胞活力值的影响Fig.1 Effect of polyphenols in I.palycarpa fruit on LPS induced RAW264.7 cells viability
图1结果表明,给药组中各剂量均对RAW264.7细胞活力产生一定影响,在50~200 μg·mL-1范围内,山桐子果实多酚增强了RAW264.7细胞的活力,对RAW264.7细胞没有毒性。与空白组比较,地塞米松组活力值最高;给药组中,当给药剂量为200 μg·mL-1时,细胞活力值达到141%与地塞米松组细胞活力值相近;剂量为50和100 μg·mL-1时细胞活力值也表现出不同程度的增强。因此在给药浓度50~200 μg·mL-1范围内,随着给药浓度的增加,山桐子果实多酚对LPS诱导处于对数生长期的RAW264.7细胞炎症消除程度逐渐增强。
2.3山桐子果实多酚对RAW264.7细胞中NO释放的影响
已经证实植物生理活动中,NO在植物对生物与非生物的防御中有至关重要的作用[21]。动物体中NO释放决定了是否会影响正常细胞的代谢活动。机体受到外界刺激,细胞会产生NO促进抗炎因子合成,但NO过度积累会造成组织损伤[22~24]。
根据Griess试剂盒说明书,测定LPS诱导的RAW264.7炎症细胞中亚硝酸盐含量。以亚硝酸盐浓度与吸光度值(A)为横坐标与纵坐标,绘制标准曲线回归方程为Y=0.006 1X-0.002 0(R2=0.998 1)。
根据标准曲线回归方程计算各组细胞中亚硝酸盐含量,结果见图2。
由图2可知,给药剂量在50~200 μg·mL-1范围内给药剂量越小,LPS诱导的RAW264.7细胞中亚硝酸盐含量越高。当给药浓度变高时,药物对细胞炎症的抑制效果也在增强,细胞本身分泌的NO含量就会降低,在一系列的代谢过程中亚硝酸盐的含量自然降低,当给药浓度在50 μg·mL-1时亚硝酸盐含量在30%~35%,给药浓度增至100 μg·mL-1时,细胞中亚硝酸盐含量降低5%左右,当达到200 μg·mL-1的给药浓度时,LPS诱导的RAW264.7细胞中亚硝酸盐含量低至10%。结果说明给药浓度范围内随着药物浓度的增加,NO产生量减少十分显著。
2.4 山桐子果实多酚对细菌抑菌效果分析
近来大量实验发现多酚类物质可参与细胞信号的转导并与细胞受体相互作用[25~26]此外,其抗菌活性被开发成新型食物防腐剂[27],也被利用在治疗微生物感染的创新抗菌药物方面[28~29]。将山桐子果实多酚分别作用于枯草芽孢杆菌、粪肠球菌和鼠伤寒沙门氏菌三种细菌进行抑菌实验,结果见表1。
表1山桐子果实多酚的抑菌效果
Table1AntibacterialeffectofpolyphenolsinI.palycarpafruit

序号No.菌种名称Strains抑菌圈直径Diameterofinhibitionzone(mm)1枯草芽孢杆菌Bacillussubilis15.38±0.542粪肠球菌Enterococcusfaecalis9.75±0.123鼠伤寒沙门氏菌Salmonellatyphimurium13.17±0.334空白对照Blankcontrol0.00±0.00
从表1可知,山桐子果实多酚对枯草芽孢杆菌的抑菌性最强,其余依次是沙门氏菌、粪肠球菌。在同一计量浓度下对三种细菌抑菌性研究,虽然抑菌效果比较明显,但是差异较大,枯草芽孢杆菌抑菌圈直径可达到15.38 mm,而粪肠球菌抑菌圈直径仅为9.75 mm。推测出现差异的主要原因可能是由于每种菌对山桐子多酚类成分的敏感度不同造成,枯草芽孢杆菌在山桐子多酚类药物作用下受到影响更大,而山桐子果实多酚对粪肠球菌作用不明显。
3 讨论
多酚指分子中含有多羟基酚类物质的总称。在植物体中,植物多酚含量仅次于纤维素、半纤维素和木质素,是植物体中最丰富的次级代谢产物之一,其主要作用是保护植株免受外界病原体侵害[30]。多酚可有效清除机体自由基成分,减少蛋白质、核酸被氧化造成的组织功能障碍及免疫力下降诱发的多种疾病[31],实验主要通过检测细胞活力、检测细胞中NO的释放量及对部分细菌的抑制作用,初步判断山桐子果实中的多酚成分具有一定的抗炎、抗菌疗效,对山桐子果实多酚的进一步开发利用有重要意义。
研究结果表明,在50~200 μg·mL-1给药浓度范围内,炎症细胞的活力值都有一定的增强,说明该浓度范围山桐子果实多酚对RAW264.7细胞没有毒性。通过比较发现在给药浓度范围内的山桐子果实多酚对细胞活力值都有一定的影响,随着给药浓度的增加,细胞活力值逐渐增高。
机体受到刺激后会产生防御反应产生促炎因子,而促炎因子诱导机体释放NO参与炎症反应,当NO释放过多时,催化机体内抗炎因子大量释放造成机体局部损伤[32]。利用山桐子果实中多酚成分,抑制促炎因子使机体NO释放减少保护机体的同时达到治疗炎症的目的。通过Griess试剂盒结果得出,50~200 μg·mL-1给药浓度范围内对RAW264.7细胞释放NO均有不同程度的影响。
实验选取三种常见细菌枯草芽孢杆菌、粪肠球菌和鼠伤寒沙门氏菌分别进行抑菌效果研究,根据抑菌圈直径判断山桐子果实多酚的抑菌效果。结果发现,果实多酚对不同的细菌都有一定的抑菌效果,不同的细菌抑制效果不同。本文从细胞抗炎和细菌的抑制两方面验证山桐子果实中多酚利用的可行性,从而为山桐子果实有效利用提供理论依据与实验方向。
1.祝志勇,王强,阮晓,等.不同地理居群山桐子的果实含油率与脂肪酸含量[J].林业科学,2010,46(5):176-180.
Zhu Z Y,Wang Q,Ruan X,et al.Analysis of oil rate and fatty acids content ofIdesiapalycarpafruits from different geographical populations[J].Scientia Silvae Sinicae,2010,46(5):176-180.
2.吴志文,谢双喜,刘青,等.山桐子的研究进展及应用前景[J].贵州农业科学,2010,38(1):161-164.
Wu Z W,Xie S X,Liu Q,et al.Research progress and application prospect ofIdesiapolycarpa[J].Guizhou Agricultural Sciences,2010,38(1):161-164.
3.杨志玲,王开良,谭梓峰.值得开发的几种野生木本油料树种[J].林业科技开发,2003,17(2):41-43.
Yang Z L,Wang K L,Tan Z F.Introduction on several wild valuable oil trees[J].China Forestry Science and Technology,2003,17(2):41-43.
4.Wang Q Y,Du K F,Jia C M,et al.Optimization of linoleic acid fromIdesiapolycarpaMaxim.var.vestitaDiels by response surface methodology[J].Advanced Materials Research,2011,396-398:1222-1227.
5.Yang F X,Su Y Q,LI X H,et al.Preparation of biodiesel fromIdesiapolycarpavar.vestitafruit oil[J].Industrial Crops and Products,2009,29(2-3):622-628.
6.昝志惠,高艳梅,孙墨珑.核桃楸单宁提取及其抗氧化性[J].植物研究,2015,35(3):431-435.
Zan Z H,Gao Y M,Sun M L.Extraction and antioxidant activity of tannic inJuglansmandshuricaMaxim[J].Bulletin of Botanical Research,2015,35(3):431-435.
7.Shi R,Zhang Q Y,Vriesekoop F,et al.Preparation of organogel with tea polyphenols complex for enhancing the antioxidation properties of edible oil[J].Journal of Agricultural and Food Chemistry,2014,62(33):8379-8384.
8.Kazeem M I,Akanji M A,Hafizur R M,et al.Antiglycation,antioxidant and toxicological potential of polyphenol extracts of alligator pepper,ginger and nutmeg from Nigeria[J].Asian Pacific Journal of Tropical Biomedicine,2012,2(9):727-732.
9.Bubonja-sonje M,Giacometti J,Abram M.Antioxidant and antilisterial activity of olive oil,cocoa and rosemary extract polyphenols[J].Food Chemistry,2011,127(4):1821-1827.
10.Sakagami H,Takeda K,Makino Y,et al.Partial purification of novel differentiation-inducing substance(s) from hot water extract of Japanese pine cone[J].Japanese Journal of Cancer Research:Gann,1986,77(1):59-64.
11.Korkina L G,Pastore S,Dellambra E,et al.New molecular and cellular targets for chemoprevention and treatment of skin tumors by plant polyphenols:a critical review[J].Current Medicinal Chemistry,2013,20(7):852-868.
12.Fuhrman B,Volkova N,Aviram M.Pomegranate juice polyphenols increase recombinant paraoxonase-1 binding to high-density lipoprotein:studies in vitro and in diabetic patients[J].Nutrition,2010,26(4):359-366.
13.Leiro J M,Varela M,Piazzon M C,et al.The anti-inflammatory activity of the polyphenol resveratrol may be partially related to inhibition of tumour necrosis factor-α (TNF-α) pre-mRNA splicing[J].Molecular Immunology,2010,47(5):1114-1120.
14.Al-muammar M N,Khan F.Obesity:the preventive role of the pomegranate(Punicagranatum)[J].Nutrition,2012,28(6):595-604.
15.Lamothe S,Azimy N,Bazinet L,et al.Interaction of green tea polyphenols with dairy matrices in a simulated gastrointestinal environment[J].Food & Function,2014,5(10):2621-2631.
16.Kim S H,Jang Y P,Sung S H,et al.Inhibitory activity of phenolic glycosides from the fruits ofIdesiapolycarpaon lipopolysaccharide-induced nitric oxide production in BV2 microglia[J].Planta Medica,2007,73(2):167-169.
17.Jung M H,Yoo J M,Kang Y J,et al.Idesolide,an isolate ofIdesiapolycarpa,inhibits apoptosis through induction of intracellular heat shock protein 70 in C2C12 muscle cells[J].Biological & Pharmaceutical Bulletin,2010,33(6):1063-1066.
18.Chai S C,Hooshmand S,Saadat R L,et al.Daily apple versus dried plum:impact on cardiovascular disease risk factors in postmenopausal women[J].Journal of the Academy of Nutrition and Dietetics,2012,112(8):1158-1168.
19.李占君,张琳,祖元刚,等.二氧化碳超临界提取塔拉籽油及其品质分析[J].植物研究,2015,35(3):467-470.
Li Z J,Zhang L,Zu Y G,et al.Tara oil extraction by supercritical carbon dioxide and its quality[J].Bulletin of Botanical Research,2015,35(3):467-470.
20.Pérez-jiménez J,Saura-calixto F.Macromolecular antioxidants or non-extractable polyphenols in fruit and vegetables:intake in four European countries[J].Food Research International,2015,74:315-323.
21.陈平波,李霞.低浓度NO对高表达转玉米C4型pepc水稻光合的促进[J].植物研究,2012,32(4):402-409.
Chen P B,Li X.Promotion of photosynthesis of transgenic rice plant with overexpressing C4pepc from maize under low concentration NO[J].Bulletin of Botanical Research,2012,32(4):402-409.
22.Kolb H,Kolb-bachofen V.Nitric oxide in autoimmune disease:cytotoxic or regulatory mediator?[J].Immunology Today,1998,19(12):556-561.
23.Sharma J N,Al-omran A,Parvathy S S.Role of nitric oxide in inflammatory diseases[J].Inflammopharmacology,2007,15(6):252-259.
24.Pfeilschifter J,Eberhardt W,Beck K F.Regulation of gene expression by nitric oxide[J].Pflügers Archiv,2001,442(4):479-486.
25.Kang N J,Shin S H,Lee H J,et al.Polyphenols as small molecular inhibitors of signaling cascades in carcinogenesis[J].Pharmacology & Therapeutics,2011,130(3):310-324.
26.Byun E H,Omura T,Yamada K,et al.Green tea polyphenol epigallocatechin-3-gallate inhibits TLR2 signaling induced by peptidoglycan through the polyphenol sensing molecule 67-kDa laminin receptor[J].FEBS Letters,2011,585(5):814-820.
27.Vaquero M J R,Aredes Fernández P A A,De Nadra M C M,et al.Phenolic compound combinations onE.coliviability in a meat system[J].Journal of Agricultural and Food Chemistry,2010,58(10):6048-6052.
28.Jayaraman P,Sakharkar M K,Lim C S,et al.Activity and interactions of antibiotic and phytochemical combinations againstPseudomonasaeruginosain vitro[J].International Journal of Biological Sciences,2010,6(6):556-568.
29.Saavedra M J,Borges A,Dias C,et al.Antimicrobial activity of phenolics and glucosinolate hydrolysis products and their synergy with streptomycin against pathogenic bacteria[J].Medicinal Chemistry,2010,6(3):174-183.
30.Jeandet P,Douillet-breuil A C,Bessis R,et al.Phytoalexins from the Vitaceae:biosynthesis,phytoalexin gene expression in transgenic plants,antifungal activity,and metabolism[J].Journal of Agricultural and Food Chemistry,2002,50(10):2731-2741.
31.李永义.茶多酚对氧化应激仔猪的保护作用及机制研究[D].雅安:四川农业大学,2011.
Li Y Y.Protective effects of tea polyphenols for weaned pigs challenged with oxidative stress[D].Ya’an:Sichuan Agricultural University,2011.
32.Debprasad C,Hemanta M,Paromita B,et al.Inhibition of NO2,PGE2,TNF-α,and iNOS EXpression byShorearobustaL.:an ethnomedicine used for anti-inflammatory and analgesic activity[J].Evidence-Based Complementary and Alternative Medicine,2012,2012:254849.
Special Fund for Forestry Scientific Research in the Public Interest(20140460202)
introduction:ZAN Peng(1989—),male,master,specializing in research and utilization of plant resources.
date:2016-06-04
Anti-inflammationandAntibacterialActivityofPolyphenolsinIdesiapolycarpaMaxim.Fruit
ZAN Peng ZHANG Lin*ZU Yuan-Gang YANG Lei CONG Ying
(Key Laboratory of Forest Plant Ecology,Northeast Forestry University,Harbin 150040)
Polyphenols are important secondary metabolites in plant. For full use of the fruit, polyphenols inLdesiapalycarpaMaxim fruit were extracted and the anti-inflammatory activity and antibacterial effect were studied. LSP-induced RAW264.7 inflammatory cells were treated with different concentration polyphenols and the anti-inflammatory effect was determined by MTT assays and NO amount of RAW264.7 cells.Enterococcusfaecalis,Bacillussubtilis,Salmonellatyphimuriumwere selected for antimicrobial experiment to analyze antibacterial activity. The content of polyphenols ofL.palycarpaMaxim fruit was 6.6 mg·g-1. Under the administration concentrations with 50, 100 and 200 μg·mL-1, along with the increase of administration concentration, RAW264.7 cells viability value was increased and the release of NO from RAW264.7 cells was also decreased. The antibacterial ability of polyphenols inL.palycarpafruit of selected three kinds of bacteria in the descending order ofB.subtilis,S.typhimuriumandE.faecalis.
Idesiapolycarpafruit;polyphenols;anti-inflammatory activity;antibacterial activity
公益性行业科研专项经费项目(20140460202)
昝鹏(1989—),男,硕士研究生,主要从事植物资源开发与利用研究。
* 通信作者:E-mail:zhanglin6600@sina.com
2016-06-04
* Corresponding author:E-mail:zhanglin6600@sina.com
Q949.759.3
A
10.7525/j.issn.1673-5102.2016.06.021
