葡萄风信子谷胱甘肽S转移酶基因克隆与表达分析
2016-11-10杨慧萍刘雅莉刘妮妮
杨慧萍 刘雅莉 娄 倩 刘妮妮
(西北农林科技大学,旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,林学院,杨凌 712100)
葡萄风信子谷胱甘肽S转移酶基因克隆与表达分析
杨慧萍 刘雅莉*娄 倩 刘妮妮
(西北农林科技大学,旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,林学院,杨凌 712100)
以亚美尼亚葡萄风信子为材料,利用本课题组前期获得的葡萄风信子转录组数据库,根据已经获得的葡萄风信子GST基因片段,通过PCR技术克隆得到葡萄风信子GST基因的cDNA序列,命名为MaGST。MaGST的cDNA全长为711 bp,开放阅读框为666 bp,编码221个氨基酸,推测蛋白质分子量为54.1 kD,理论等电点pI为5.13。利用生物信息分析软件对MaGST基因进行同源性比对和系统进化分析表明,结果显示该基因编码的氨基酸具有谷胱甘肽S转移酶典型的C端与N端双结构域,属于GST Tau家族蛋白;与洋葱和小麦GST基因的一致性分别为76.72%和62.50%。实时定量PCR结果显示MaGST在葡萄风信子各组织器官表达强度相似,属于组成型表达;水杨酸(SA)可以明显诱导MaGST表达,MaGST对氯化钠(NaCl)应答不是很明显,甚至表达量有稍微的下调。
亚美尼亚葡萄风信子;谷胱甘肽S转移酶;克隆;荧光实时定量PCR;胁迫
谷胱甘肽S-转移酶(gultathione S transferase,GST)作为一组由多基因编码的多功能蛋白酶,参与到许多内源性或外源性毒素的解毒过程[1]。GST可以催化还原型谷胱甘肽(glutathione,GSH)与各种亲电化合物进行亲核加成反应[2],然后将代谢产物转运到液泡内从而起到解毒的作用。根据GST所编码氨基酸序列的结构、底物的特异性以及免疫的特异性,可以分为lambda、phi、tau、dhar、theta和zeta六类[3],而lambda、phi、tau三类为植物所特有。GST蛋白参与到细胞内一些生长激素、花青素的运输,代谢物质的合成,也受多种环境因子的胁迫诱导,在植物的生长发育、次生代谢中有很重要的作用[4]。在模拟酸雨胁迫下,青花菜GST基因的表达量在胁迫初期显著增大,随时间延长开始下降表明其参与了青花菜抗酸雨的应答反应[5];周向红在对条斑紫菜的研究中发现GST基因可以参与对铅的解毒过程[6];橡胶树HbGSTU1的表达受割胶、伤害、低温、2,4-D、乙烯利和死皮病等因素调控,但对JA、SA和ABA处理的应答不明显[7]。另外Nobuhiro Sasaki在对康乃馨的研究中发现DcGST在花色素积累运输中起着重要作用[8];基因敲除和互补实验证明仙客来CkmGST3参与花青素的运输[9]。
葡萄风信子(Muscariarmeniacum)是风信子科(Hyacinthaceae)葡萄风信子(Muscari)属春季球根花卉,具有很重要的观赏、生态与科研价值。目前关于葡萄风信子的研究主要集中于组织培养[10],色素成分分析[11]方面,但是关于葡萄风信子属植物有关谷胱甘肽S-转移酶的基因研究还未见报道,一定程度上限制了对葡萄风信子属植物更加广泛深入的研究。
本实验室前期结合转录谱和代谢组学技术从葡萄风信子花组织器官数据库中筛选到了一条GST候选基因序列。本研究利用PCR技术克隆到了葡萄风信子的这条GST基因,荧光实时定量PCR分检测其在根、茎、叶和不同发育时期花器官中的表达情况,并对其进行了胁迫分析,为进一步研究该基因调控机理和功能奠定了一定的基础。
1 材料与方法
1.1 植物材料

1.2 方法
1.2.1 总RNA提取与cDNA第一条链的合成
根据北京百泰克生物技术有限公司的多糖多酚植物总RNA快速提取试剂盒说明书(BioTeKe)操作说明分别提取不同组织及花中的总RNA,琼脂糖凝胶电泳检测所提取RNA的完整性,并用NanoDrop微量紫外分光光度计(Nanodrop Technologies Inc,Delaware,USA)检测样品纯度和浓度。
使用Prime Script RT reagent Kit(TaKaRa公司),以提取的RNA为模板,Oligo(dT)为引物,按照cDNA第一链合成试剂盒说明书反转录合成cDNA第一链。
1.2.2 葡萄风信子MaGST基因全长克隆
利用葡萄风信子转录普测序获得的GST基因序列设计特异性引物MaGST-1/MaGST-2扩增其全长。引物设计采用软件Primer 5.0进行,合成由北京奥科鼎盛生物科技有限公司负责。以反转录的‘亚美尼亚’花瓣cDNA为模板进行PCR全长扩增,扩增条件为94℃预变性3 min;94℃变性30 s,57℃退火30 s,72℃延伸60 s,30个循环;72℃延伸10 min。电泳检测后回收与预期片段大小一致的条带,连接到克隆载体pMD18-T Vector(TaKaRa公司)后转化感受态细胞E.coliTop10(天根生化科技有限公司),经蓝、白斑筛选阳性克隆后送交北京奥科生物科技有限公司进行测序分析。
1.2.3 葡萄风信子MaGST基因生物信息学分析
将获得的MaGST基因序列在NCBI的ORF finder预测开放读码框,并进行BLAST搜索,对葡萄风信子MaGST基因序列及其编码的蛋白进行生物信息学分析;利用DNAMAN软件对MaGST基因全长cDNA序列进行分析,获得该序列的氨基酸序列、分子量和等电点等,并且根据获得的氨基酸序列进行同源比对分析;利用Predict Protein对蛋白质的二维结构进行分析;用Mega 5.0软件构建系统发育树。
1.2.4 葡萄风信子MaGST基因时空表达模式分析
根据MaGST基因序列设计实时定量引物MaGST-3/MaGST-4,内参基因为Actin。分别取亚美尼亚葡萄风信子根、茎、叶以及不同发育时期花蕾的总RNA各1 μL,反转录合成cDNA,参照SYBR Premix Ex TaqTMⅡ(Perfect Real Time)(TaKaRa公司)实时荧光定量操作说明书进行操作,利用IQ5 Multicolor Real-Time PCR Detection System实时定量PCR仪检测花蕾不同发育时期与不同组织部位MaGST的相对表达量,每个样品设3个重复。RT-PCR扩增体系为10 μL SYBR Premix EX TaqTMⅡ(2×),上、下游引物各0.8 μL,cDNA 1 μL,无菌水8.4 μL。RT-PCR扩增程序为95℃变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸30 s,40个循环。Excel 2010和Origin 8.0对数据进行计算和处理,采用2-ΔΔCT法[12]分析该基因的相对表达情况。
1.2.5 胁迫条件下MaGST基因的表达分析
分别以反转录的亚美尼亚葡萄风信子根、茎、叶以及水杨酸(SA)和氯化钠(NaCl)处理的5个发育时期的花瓣混合物、根、茎、叶的cDNA为模板进行RT-PCR分析。RT-PCR扩增体系为10 μL SYBR Premix EX TaqTMⅡ(2×),上、下游引物各0.8 μL,cDNA 1 μL,无菌水8.4 μL。RT-PCR扩增程序为95℃变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸30 s,40个循环。Excel 2010和Origin 8.0对数据进行计算和处理,采用2-ΔΔCT法分析该基因的相对表达情况。
2 结果与分析
2.1 葡萄风信子MaGST基因全长cDNA克隆
根据转录普测序所得到的基因序列设计引物MaGST-1/MaGST-2,以亚美尼亚葡萄风信子花瓣cDNA为模板进行PCR扩增后得到一条长为711 bp的cDNA片段(图1:B)。测序结果表明其开放阅读框长666 bp,编码221个氨基酸,命名为MaGST。
表1亚美尼亚葡萄风信子MaGST基因克隆与表达分析所用序列
Table1PrimersequencesingenecloningandexpressionanalysisofM.armeniacum
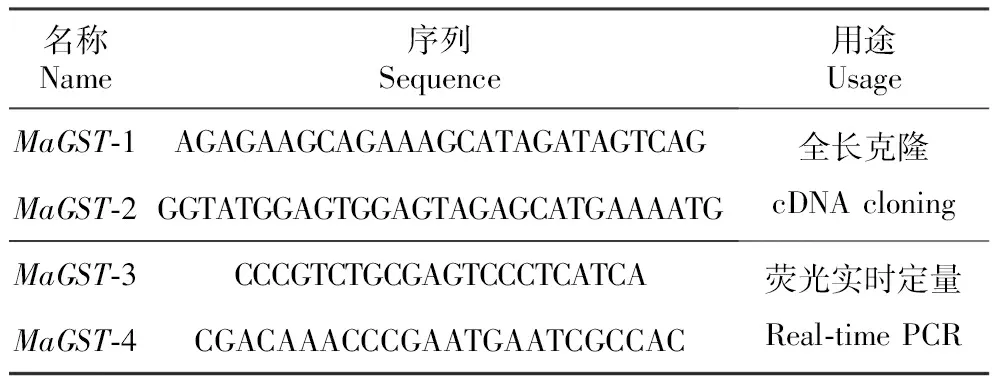
名称Name序列Sequence用途UsageMaGST⁃1AGAGAAGCAGAAAGCATAGATAGTCAGMaGST⁃2GGTATGGAGTGGAGTAGAGCATGAAAATG全长克隆cDNAcloningMaGST⁃3CCCGTCTGCGAGTCCCTCATCAMaGST⁃4CGACAAACCCGAATGAATCGCCAC荧光实时定量Real⁃timePCR

图1 葡萄风信子MaGST基因PCR电泳检测 A.葡萄风信子花瓣RNA电泳检测;B.葡萄风信子MaGST基因全长扩增结果;M. DL5000 DNA Maker;1~2. PCR全长扩增产物Fig.1 Agarose gel electrophoresis analysis of MaGST genes fragments from M.armeniacum A.Agarose gel electrophoresis analysis of RNA from M.armeniacum petals; B.The full length of MaGST cDNA amplification; M.DL5000 DNA Maker; 1-2. Represent two replications
2.2 葡萄风信子MaGST基因生物信息学分析
使用DNAMAN软件对MaGST基因序列进行分析,结果显示MaGST理论分子量为54.10 kD,理论等电点pI为5.13。在溶液中MaGST的不稳定指数为39.66,略低于域值40,可能属于稳定蛋白。此外,MaGST的脂肪族系数为23.87,总疏水系数为0.775,蛋白质总体疏水性较强,并且发现在水溶液中MaGST可能折叠成一个紧密的的球状分子。
TMHMM2.0预测该蛋白不具跨膜区,蛋白全部在膜外,属于胞外蛋白。SignalP 4.1分析显示该序列N端无信号肽,属于非分泌性蛋白。利用PSORT Ⅱ Prediction对MaGST进行亚细胞定位预测,定位信号主要集中在细胞质内,在细胞壁内也发现了定位信号。用NetPhos 2.0预测MaGST磷酸化位点,MaGST有11个Thr磷酸化位点。PredictProtein预测MaGST的二级结构,结果显示该蛋白包含了50.68%的α螺旋和3.17%的延伸链,其cDNA序列和推导的氨基酸序列如图2所示。使用SWISS-MODEL在线预测MaGST蛋白的三级结构,并以水稻OsGST1的编码的蛋白为模型,发现MaGST蛋白具有明显的双结构域,C端结构域有7个α螺旋,而N端结构域具有3个α螺旋和4个β折叠(图3)。

图2 MaGST基因的核苷酸序列及推导的氨基酸序列Fig.2 Nucleotide sequence and deduced amino acid sequence of MaGST
利用Blastp在线分析MaGST的氨基酸序列,发现该蛋白7~80位置为GST-N-Tau结构域,具有3个保守结构域或活性结合位点:谷胱甘肽(GSH)结合位点(G-site);一个可结合多肽的二聚体面,一个C端多肽结合域。位于91~214的部分为GST-C-Tau结构域,属于GST-C-Phi亚家族GST-C家族,该段蛋白序列包含一个结合多肽的二聚体面,一个底物结合位点(H-site)和一个N端多肽结合域(图4)。
将葡萄风信子MaGST与NCBI检索到的其他物种GST蛋白进行聚类分析并构建系统发育树,结果如图5显示MaGST蛋白与洋葱(AlliumcepaBAK222528.1)聚为一类亲缘关系较近为76.72%,与粟(SetariaitalicaXP004981530.1)、玉米(ZeamaysNP001146786.1)、小麦(TriticumaestivumXP002532823.1)聚类较近,分别为65.95%、62.07%、62.50%,与烟草(NicotianatabacumP25317)、葡萄(VitisviniferaABL84692.1)等虽然有同源性但是聚类较远。
2.3 葡萄风信子MaGST基因的时空表达模式分析
为了研究MaGST在不同组织器官以及不同花发育时期中的时空表达,进行了荧光实时定量分析。结果显示(图6),MaGST基因在各组织器官都有表达。在花发育中除了S1与S3时期,其他时期表达量基本相近;在营养组织中根的表达量最高,其次是叶,而茎中的表达量最低且低于花器官S1与S3时期。由此可见MaGST在亚美尼亚葡萄风信子中的表达不具有组织特异性属于组成型表达。

图4 葡萄风信子MaGST与其他植物GST同源性比对 —.N端和C端保守结构域;▽.GSH结合残基;▼.底物结合位点;☆.位于G位点或H位点的保守氨基酸残基Fig.4 Alignment of MaGST with other GSTs —.The N-terminal and C-terminal domain; ▽.The GSH binding sites; ▼.The substrate binding pocket; ☆.Amino acids with asterisks indicate the conserved residues of the G-site or H-site
2.4不同处理对葡萄风信子MaGST基因的表达分析
以未处理的植株为对照组,利用不同处理形成人为的环境胁迫研究MaGST的相对表达量。结果表明,在高盐和激素处理条件下,MaGST在转录水平上呈现出不同程度的差异表达。2 mmol·L-1水杨酸(SA)处理植株明显提高植株根和茎组织器官中MaGST的表达量,分别是对照组的8.36倍、5.87倍,但是在处理组花瓣和叶片中MaGST的表达量有所降低。氯化钠(NaCl)对亚美尼亚植株进行处理结果发现除了在花器官MaGST表达量增加外其他组织部位表达量均是小幅度的下调。以上结果说明MaGST基因使诱导型表达,并且具有组织表达差异,水杨酸(SA)能够在转录水平激起MaGST的相应信号,保护组织免受伤害。
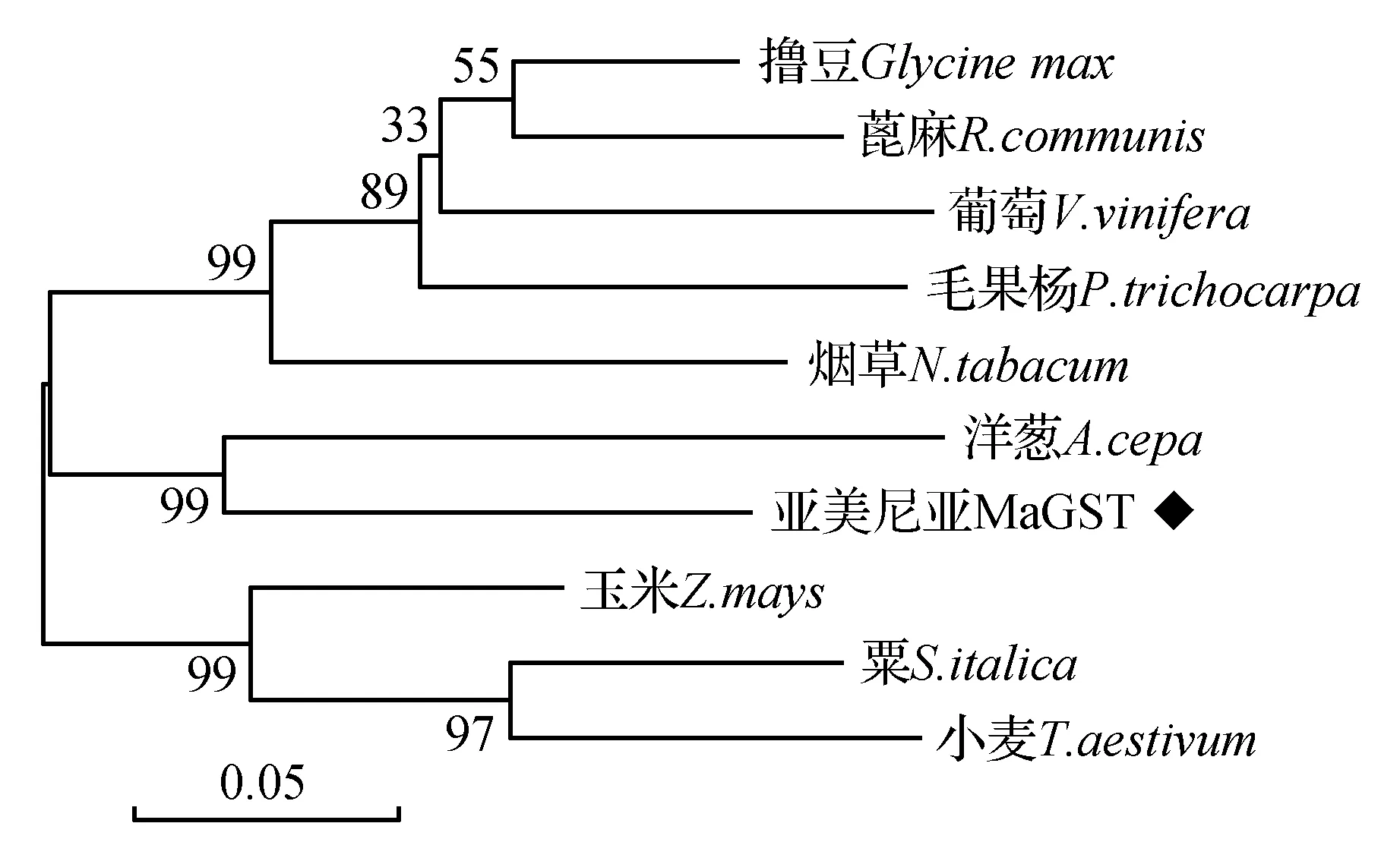
图5 几种植物GST氨基酸序列的系统发育树 标尺代表遗传距离;数值代表从1000次重复计算得到的bootstrap百分比值Fig.5 Phylogenetic tree of the deduced amino acid sequence of flavonol synthase in different plants The scale bar represents genetic distance; Numbers represent the bootstrap percentage values calculated from 1 000 replicates.
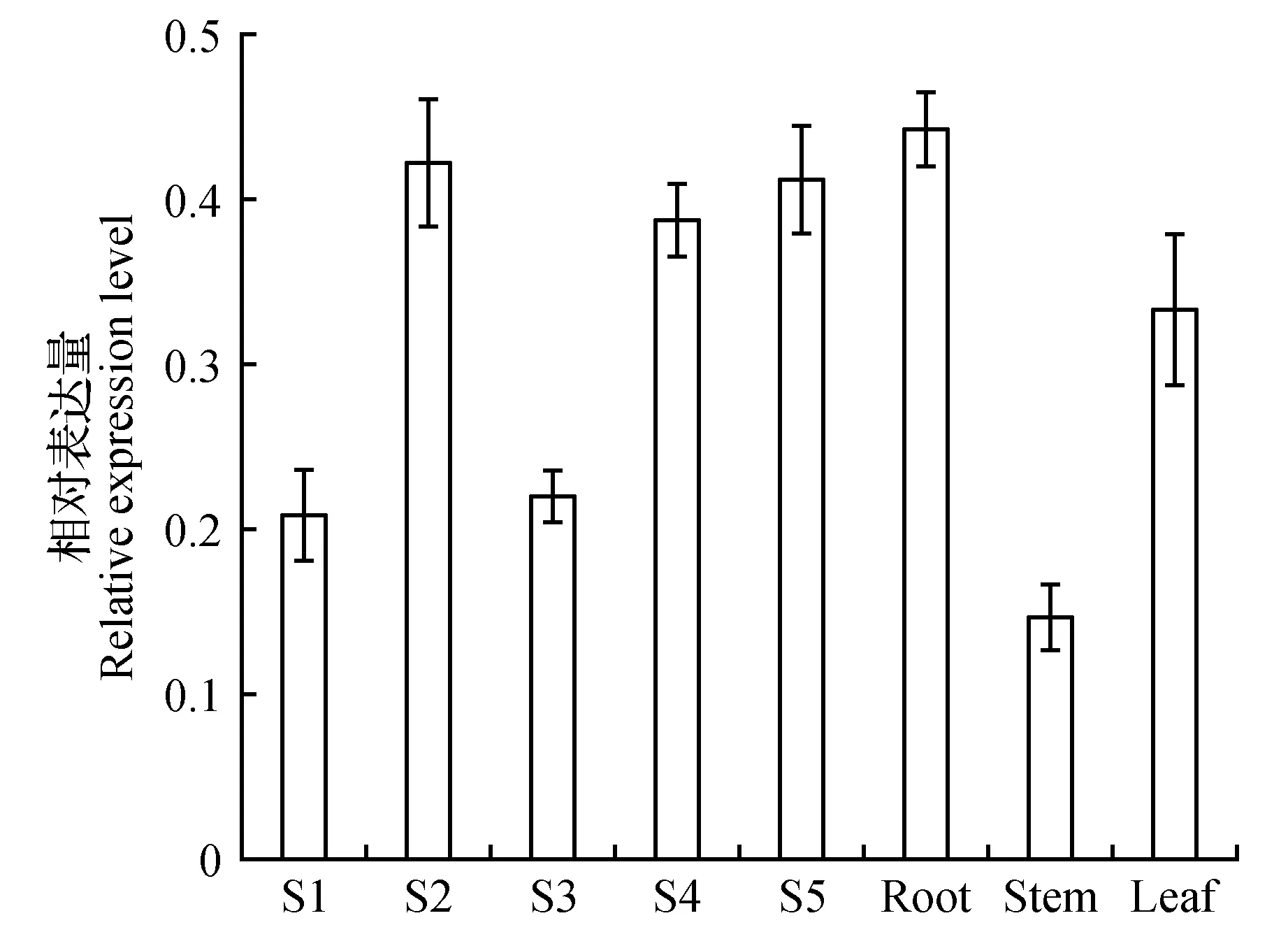
图6 MaGST在亚美尼亚葡萄风信子不同组织部位的表达Fig.6 Different expression level of MaGST gene in different organs of M.armeniacum
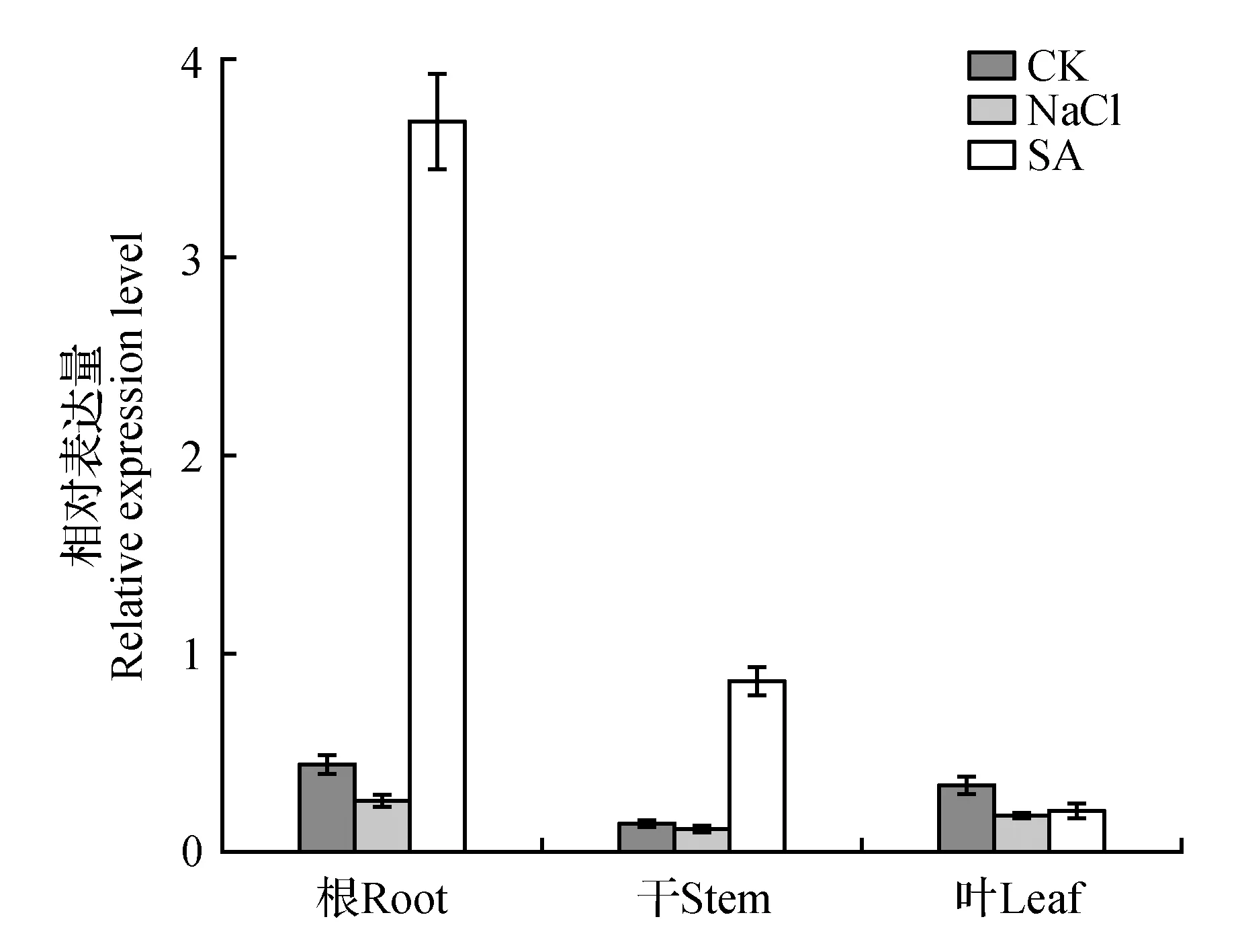
图7 亚美尼亚MaGST在胁迫下的相对表达量Fig.7 Different expression level of MaGST gene in of M.armeniacum under environment stress
3 讨论
早期关于谷胱甘肽-S-转移酶基因GST的研究表明,GST对于底物的特异性选择是由两个基本的功能域决定,分别是位于N端的GSH结合位点(G-site)和位于C端的结合亲电化合物底物的作用位点(H-site)[13]。Frear D S最早在玉米中发现GST基因,并且发现其参与了花青素的运输[14],随后在拟南芥[15]、康乃馨[16]、棉花[17]、瓜叶菊[18]等物种中分离到了GST基因。本研究首次从葡萄风信子‘亚美尼亚’中获得GST基因,对MaGST进行序列和理化性质分析,结果表明MaGST与其他植物的GST高度一致,具有谷胱甘肽-S-转移酶典型的双保守域以及G-site和H-site保守的氨基酸残基。同源比对和系统进化分析显示,葡萄风信子MaGST与洋葱AcGST亲缘关系最近,且属于Tau类GST。
对亚美尼亚葡萄风信子各个组织器官与不同花瓣发育时期进行荧光定量PCR分析,结果在各个部位都检测到了MaGST表达,为组成型表达基因。值得注意的是,在花瓣发育S2时期即花瓣开始着色时期,MaGST的表达水平出现了一个明显的上升。已有研究发现瓜叶菊ScGST3[19]、山葡萄VAmGST4[20]等植物的GST基因与花色苷的合成密切相关,参与到花色苷的积累运输过程。因此S2时期引起MaGST高表达的原因推测可能是因为S2时期是花青素合成最旺盛的时期,花青素开始大量积累,由于花青苷高的生物化学活性会对细胞造成一定程度的伤害,因此需要MaGST将花青苷转移到液泡和细胞壁内,导致MaGST表达量明显增加。S3时期MaGST表达量相较于S2时期有所下降,到了S4时期又大量增加,原因可能是因为在花瓣着色结束之后花瓣开放过程中受到授粉、紫外线等的影响诱导MaGST的表达。另外在本研究中水杨酸(SA)对MaGST的上调作用其原因也可能是因为环境胁迫引起花色苷在细胞质中大量合成,细胞产生毒害作用,引起MaGST等相关酶的合成,将花色苷运输到液泡中,然后在液泡中固定、贮存,从而达到稳定细胞内环境的目的。
本研究通过荧光定量发现MaGST经水杨酸(SA)处理过后MaGST的表达量明显升高,尤其在根部表达量达到对照组的8.36倍,高于茎和叶片中的表达量,而在非诱导条件下以及氯化钠(NaCl)处理下根、茎、叶中的表达量相近,这说明MaGST参与亚美尼亚葡萄风信子对水杨酸(SA)的胁迫应答。早在1994年就有研究指出水杨酸并不是系统获得抗性的信号分子[21],而是由水杨酸结合蛋白(salicylic-acid-binding protein SABP2)与水杨酸结合后形成脂溶性分子,表现出脂酶活性,继而引发一系列的抗性反应[22]。另外我们推测该基因的启动子区域可能含有调控顺式元件,受水杨酸(SA)的诱导。Wenqiong Chen等发现拟南芥GST6基因的启动子区域含有ocs元件,在水杨酸和过氧化氢诱导下其表达活性明显升高,且主要在根部表达[23]。
GST基因是一份具有多功能的基因,涉及到许多生化反应,目前对于GST在植物中功能以及如何进行抗逆的分子机制不是很清楚,本研究克隆了一个MaGST基因,为深入研究该基因功能和遗传转化奠定了基础,并且对于葡萄风信子抗逆分子育种提供一个新的方向进行深入研究。鉴于GST是一个多基因的家族,因此对其他GST基因的克隆与表达分析,全面分析其理化性质和作用机理将是我们下一步工作的内容。
1.Hayes J D,Flanagan J U,Jowsey I R.Glutathione transferases[J].Annual Review of Pharmacology and Toxicology,2005,45:51-88.
2.刘军,汪永红,王昌富.谷胱甘肽s-转移酶的生物学特性及其临床应用[J].国际检验医学杂志,2007,14(1):57-58.
3.Moons A.Regulatory and functional interactions of plant growth regulators and plant glutathione-S-transferases(GSTs)[J].Vitamins and Hormones,2005,72:155-202.
4.张严,胡军.植物谷胱甘肽-S-转移酶的分子生物学研究进展[J].哈尔滨师范大学:自然科学学报,2007,23(4):76-79.
5.范玉洁,林飞鹏,安泽伟,等.一个橡胶树谷胱甘肽-S-转移酶基因的克隆和表达特性分析[J].中国农业科学,2011,44(20):4150-4158.
6.高世超,林义章,钟凤林,等.青花菜谷胱甘肽S转移酶基因克隆及其表达分析[J].西北植物学报,2014,34(4):0651-0657.
7.周向红,易乐飞,李信书,等.条斑紫菜谷胱甘肽S-转移酶基因的克隆与表达分析[J].水产学报,2011,35(9):1354-1361.
8.Nobuhiro Sasakil,Yuzo Nishizakil,Yasuhiro Uchidal1,et al.Identification of the glutathione S-transferase gene responsible for flower color intensity in carnations[J].Plant Biotechnology,2012,29:223-227.
9.Satoshi Kitamuraa,Yusuke Akitaa,Hiroshi Ishizakab,el at.Molecular characterization of an anthocyanin-related glutathione S-transferase gene in cyclamen[J].Journal of Plant Physiology,2012,169:636-642.
10.Mohammad Amin Baghchesara,Hossein Abdizadeh,Hamid Reza Baharvandi.Effects of MgO Nano Particles on Microstructural and Mechanical Properties of Aluminum Matrix Composite prepared via Powder Metallurgy Route[J].International Journal of Modern Physics Conference Series,2012,5:607-614.
11.Qi Y Y,Lou Q,Li H B,et al.Anatomical and biochemical studies of bicolored flower developmentinMuscarilatifolium[J].Protoplasma,2013,250(6):1273-1281.
12.Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C) method[J].Methods,2001,25(4):402-408.
13.Edwards R,Dixon D P.Walbot V Plant glutathione S-transfera-ses:enzymes with multiple functions in sickness and in health.Trends Plant Sci,2000,5(5):193-198.
14.Frear D S,Swanson H R.Biosynthesis of S-(4-ethylamino-6-isopropylamino-2-s-triazino) glutathione:Partial purification and properties of a glutathione Stransferase from corn[J].Phytochemistry,1970,9(10):2123-2132.
15.Bartling D,Radzio R,Steiner U,el at.A glutathione S-transferase with glutathione peroxidase activity fromArabidopsisthaliana:Molecular cloning and functional characterization[J].Eur J Biochem,1993,216:579-586.
16.Itzhaki H,Woodson W R.Characterization of an ethylene-responsive glutathione S-transferase gene cluster in carnation[J].Plant Mol Biol,1993,22:43-58.
17.Liu D Q,ZHang X L,Tu L,el at.Isolation by suppression subtractive hybridization of genes preferentially expressed during early and late fiber development stages in cotton[J].Molecular Biology,2006,40:741-749.
18.胡可,孟丽,韩科厅,等.瓜叶菊花青素合成关键结构基因的分离及表达分析[J].园艺学报,2009,36(7):1013-1022.
29.金雪花,洪艳,黄河,等.瓜叶菊谷胱甘肽转移酶基因GST的分离及表达分析[J].园艺学报,2013,40(6):1129-1138.
20.刘海峰,王军.山葡萄谷胱甘肽S-转移酶基因(VAmGST4)克隆及表达分析[J].植物生理学报,2011,47(12):1161-1166.
21.Vernooij B, Friedrich L.Morse A,et al.Salicylic Acid Is Not the Translocated Signal Responsible for Inducing Systemic Acquired Resistance But Is Required in Signal Transduction[J].Plant Cell,1994,6(7):959-965.
22.Kumar D,Klessig D F.High-affinity salicylic acid-binding protein 2 is required for plant innate immunity and has salicylic acid-stimulated lipase activity[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(26):16101-16106.
23.Chen Wenqiong,Karam B,Singh.The auxin,hydrogen peroxide and salicylic acid induced expression of the Arabidopsis GST6 promoter is mediated in part by an ocs element[J].The Plant Journal,1999,19(6):667-677.
CloneandCharacterizationofAGlutathione-s-transferaseGeneinMuscariarmeniacum
YANG Hui-Ping LIU Ya-Li*LOU Qian LIU Ni-Ni
(State Key Laboratory of Crop Stress Biology in Arid Areas,Key Laboratory of Horticultural Plant Biology and Germplasm Innovation in Northwest China,Ministry of Agriculture,College of Forestry,Northwest A&F University,Yangling 712100)
Based on the latex the transcriptome database, the full length cDNA of glutathione-S-transferase(GST) fromMuscariarmeniacumwas cloned by reverse-PCR and PCR, designated asMaGST. The full length cDNA ofMaGSTwas 711 bp, and the ORF(Open Reading Frame) length was 666 bp, encoding a protein polypeptide of 221 amino acids with a predicted molecular weight of 54.1 kD and pI of 5.13. By phylogenetic tree analysis, the putativeMaGSTprotein displayed identities to the GSTs ofAlliumcepaandTriticumaestivumof 76.72% and 62.50%, respectively, and contained the Tau GST-specific N-terminal domain(G site) and the C-terminal domain(H site), belonging to the family of GST Tau. By real-time PCR, the expression pattern ofMaGSTin different organs were similar, belonging to constitutive expression. The expression ofMaGSTwas regulated by salicylic acid, but not by the NaCl.
Muscariarmeniacum;glutathione-s-transferase;clone;florescent real-time quantitative PCR;environment stress
国家自然科学基金(31170652)
杨慧萍(1990—),女,硕士研究生,主要从事园林植物分子育种的研究。
* 通信作者:E-mail:lyl6151@126.com
2015-01-13
S330
A
10.7525/j.issn.1673-5102.2016.01.019
