典型全氟化合物的去除技术研究进展
2016-11-08卢丽娟唐敏康高乃云许建红
卢丽娟,唐敏康,陈 瑛,高乃云,许建红
(1.江西理工大学资源与环境工程学院,江西 赣州 341000;2.污染控制与资源化国家重点实验室(同济大学),上海 200092)
· 综述 ·
典型全氟化合物的去除技术研究进展
卢丽娟1,唐敏康1,陈瑛1,高乃云2,许建红2
(1.江西理工大学资源与环境工程学院,江西 赣州341000;2.污染控制与资源化国家重点实验室(同济大学),上海200092)
全氟类化合物已经生产并且应用超过50年。其中,全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)是最典型的两种化合物。它具有极好的理化性质,被大量的应用于生产生活当中。由于其具有生殖毒性、诱变毒性、发育毒性等,近几年来,相关研究人员及学者开始关注全氟化合物对环境、生物、人体等的影响。现有的去除典型全氟化合物的技术有光化学降解、吸附去除技术、电化学氧化法等。在对全氟类化合物的特性以及现状进行分析后,综述了近几年来国内研究学者对典型全氟化合物去除技术研究的进展,并对全氟化合物的未来研究方向与趋势进行了展望。
全氟化合物;特性;污染现状分析;去除技术
全氟类化合物(Perfluorinated compounds, PFCs)自1951年由3M公司研制成功以来,以其优良的稳定性、表面活性以及疏水疏油等性能被广泛用于化工、纺织、涂料、皮革、合成洗涤剂等与生产生活密切相关的产品中。
全氟化合物是分子中与碳原子连接的氢原子全部被氟原子取代的一种新型有机污染物,在各种全氟类化合物中,全氟磺酸盐和全氟羧酸盐应用广泛,其中全氟辛烷(C8)产品占80%以上[1]。然而大量的生产和使用随之而来的便是环境污染、威胁人类身体健康等一系列问题。
近几年来,人们逐渐开始关注全氟化合物对环境、生物体、人类健康的影响,相关的限制措施也相继出台。在2009年5月召开的《关于持久性有机污染物的斯德哥尔摩公约》第四次缔约方大会上,将PFOS及其盐和全氟辛基磺酰氟列入《斯德哥尔摩公约》附录A或B。
因此,去除水体中全氟类污染物的技术是非常迫切并且有意义的。本文介绍了近些年来全氟化合物的去除技术及特性,简要阐明PFCs的未来的研究方向,并且提出了对全氟化合物去除技术的最新见解。
1 全氟化合物的特性
全氟化合物通常是指碳链上的碳氢键完全被碳氟键取代,然后在末端连接上不同官能团而形成不同的化合物,具有很高的热稳定性和较强的动力学稳定性,具有很高的耐酸碱和强氧化剂性能[2]。离子态全氟化合物具有较低的蒸汽压和较高的水溶性,挥发性低[3]。表1为两种典型全氟化合物的基本物理化学性质。随着全氟化合物广泛使用,它们的分解产物PFOA或PFOS可以在环境和生物体内检测到[4]。
这类化合物具有生殖毒性、免疫毒性等[5]。在所有的日本的地下水和温泉水中,PFCs都有被发现。PFOS和PFOA,PFHpA,PFNA是地下水中的主要种类,各自的浓度在地下水样品中为0.28~133,0.1~20,0.47~60和0.1~94 ng/L[6]。陈清武等人,应用固相萃取分离、富集与高效液相色谱-质谱联用相结合的方法,研究了深圳市沿海岸18处表层海水中15种PFCs的残留特征、分布规律及其成因。结果表明,深圳沿海岸表层海水中PFCs总的残留水平受人类活动的影响显著,沿海岸表层海水中 PFCs 的主要残留种态为中、短链的全氟辛烷磺酸、全氟辛酸、全氟己酸和全氟戊酸。这可能由于生产使用全氟类化合物引起的全氟类污染物的聚集[7]。沈阳地区地表水及地下水中普遍存在PFOS、PFOA污染,地表水样品中PFOS和PFOA的检出率为100%,地表水中PFOA为主要PFCs化合物,其次为PFOS和PFHpA[8]。

表1 2种典型全氟化合物基本物理化学性质
2 典型全氟化合物的去除方法
2.1吸附技术
采用吸附技术去除全氟类化合物是一种高效可行的方法。吸附剂一般有活性炭、活性污泥、沸石、阴离子交换树脂、纳米碳管等。余强[9]分析了活性炭和阴离子交换树脂等一些常用的吸附剂对PFOA和PFOS吸附性能,利用两步交联法合成一种对PFOS具有选择性吸附的壳聚糖分子印迹材料。这种材料对PFOS具有吸附专一性和选择性。在同等的吸附条件下,吸附性能是非印迹吸附剂的两倍。在阴离子干扰试验中,竞争吸附并没有干扰它对PFOS的吸附。在与普通的活性炭和阴离子交换树脂等吸附剂比较,壳聚糖分子印迹材料选择吸附性高、吸附速率快、吸附量高,适合高浓度PFOA的吸附去除。牛利[10]通过原子转移自由基聚合(ATRP)对无孔的稻壳进行改性,制备出氨化稻壳吸附剂并对PFBA、PFOA、PFOS进行吸附去除研究。表征分析结果显示在稻壳表面成功引入氨基。氨化稻壳与PFCs之间存在静电作用和疏水作用。Valeria Ochoa-Herrera[11]等报道了固体颗粒活性炭、沸石、污泥对全氟化合物的吸附。实验证明,在低溶度时,活性炭对于PFOS的吸附强于PFOA和PFBS,主要是由于全氟化合物的链长、官能团影响着阴离子表面活性剂的吸附。沸石对PFOS的吸附主要是由沸石含硅的量所决定的疏水性影响,较高的硅含量的沸石比较低硅含量的沸石更易吸附PFOS。沸石、污泥、活性炭对PFOS的吸附比较如下:颗粒活性炭>疏水沸石>厌氧污泥>活性污泥。Xiaona Li[12]等报道了多壁碳纳米管(MWNTS)对五种可电离的有机污染物的吸附。实验证明,MWNTS对PFOA、PFOS、PFOSA的吸附效果主要是疏水性起主导作用,对壬基酚(4—NP)、2,4-二氯苯氧乙酸(2,4-D)吸附是由疏水性和π-e极化性共同作用的。MWNTS的氧含量与吸附效果成反比,是由于氧占据了吸附位点。
Yan Qu[13]等也利用粉末活性炭对PFOA进行吸附实验。实验证明,吸附效果受接触时间、吸附剂量、温度的影响。同时,从热力学角度上看,吸附是一种自发的吸热的过程,并且遵循伪二级动力学模型。
同时,一些金属化合物也被用作吸附剂,这主要是它们在水中会形成水合金属氧化物。Hiroshi Moriwakia[14]等提出了一种新型的TiC吸附剂。它是一种对水、固相有效的吸附剂。实验证明,1ug/mL的溶液通过TiC暗盒,这种物质能完全被吸收。尽管它的吸附能力低于活性炭,然而它可以反复洗脱,达到重复利用的效果。同时,通过改变Ti∶C的比例和表面材料可以提高吸附能力。因此,TiC吸附剂被用来去除水中典型全氟化合物有很大的潜力。
活性炭吸附被认为是最经济的处理方法,采用吸附法去除水中的全氟化合物,操作简单并且效率较高,但是单纯的利用活性炭吸附的特点,仅是将吸附质过渡到另一个载体上,从根本上没有将污染物进行降解,可能会存在二次污染等问题。对于吸附剂的后续处理也是值得研究和关注的问题。
2.2光化学降解
作为无催化剂的光化学降解,一般会用到氧化能力较强的物质。这些氧化剂尽可能去捕捉电子,使空穴与电子不能重新结合,从而提供反应场所,使反应能顺利的进行。HISAO HORI[15]等报道了PFOA通过UV、UV和H2O2辐射以及钨掺杂多酸来分解PFOA。通过实验证明,直接光照可以产生CO2、F-、短链的全氟羧酸。同时,氧气不仅在C7F15和COOH之间的C-C键断裂起着作用,同时还在CO2、F-产生的过程中起着作用。另一方面,杂多酸引导PFOA有效分解并且生成F-和CO2,同时抑制短链全氟羧酸在反应溶液中的积累,并且钨掺杂多酸可以循环使用。因此,氧气、光照、钨掺杂多酸可以有效地分解PFOA。这种结合可以分解不同溶度的PFOA。
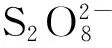
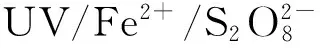
(1)
C7F15COOH·+→C7F15·+CO2+H+
(2)
C7F15·+H20→C7F15OH+H·
(3)
C7F15OH→C6F13COF+H++F-
(4)
C6F13COF+H2O→C6F13COOH+H++F-
(5)
C7F15COO-+Fe3+→[C7F15COO-Fe]2+
(6)
[C7F15COO-Fe]2++hv→Fe2++C7F15COO·
(7)
C7F15COO·+3H2O→C6F13COOH+HCOOH+2F-+2H++·OH
(8)
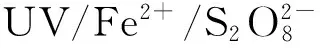
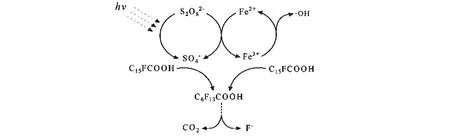
图光化学氧化PFOA的降解机理Fig. Degradation mechanism of PFOA by photochemical oxidation of UV/Fe2+/S2O2-
目前,有关全氟化合物光化学降解方面的研究报道比较多。这种方法既可以单独处理全氟化合物,也可以与其他处理方式联用共同降解。它的反应速率快,可以在较短时间内达到降解效果,其降解的中间产物为短链的全氟羧酸、CO2以及F-。短链的全氟羧酸因所采用的反应体系不同而有所差异。但是这种方法对反应的条件要求较高,并且大规模的应用费用较高。
2.3光催化降解
光催化降解包括非均相、均相两种类型。均相光催化降解主要以双氧水、Fe3+、Fe2+为介质,通过光助-芬顿反应降解污染物,这反应可以直接利用可见光。非均相光催化降解是在污染体中加入适当的光敏半导体材料,然后在光照作用下,半导体的导带和价带上分别形成非常活跃的电子-空穴对(e-h),可分别被水溶液中的OH-、H2O和O2俘获生成羟基自由基,具有强氧化性,可以在常温常压下分解结构稳定的有机物,不产生二次污染。HISAO HORI[15]等首次报道出钨掺杂多酸可以作为分解PFOA的有效光催化剂。然而,具有化学稳定性高、较深的价带能级、耐光腐蚀的TiO2是近年来研究的热点。Tsuyoshi Ochiai[22]等报道了在大气压力下,TiO2作为光催化剂,利用中压紫外线灯照射(MPUV)分解在TiO2悬浮液中的PFOA。实验表明,PFOA 在直接光照和有TiO2存在下的分解速率分别是1.3×10-2和8.6×10-2dm3h-1。PFOA吸附在TiO2表面上,并且可以被MPUV灯产生的空穴和自由基简单的分解。但纯纳米TiO2一般很难降解PFOS或PFOA,一般都需要加入电子转移介质,电子转移介质可以改变PFOS或PFOA的性能和结构,从而提高催化效果。Ralf Dillert[23]等报道了在TiO2下光诱导全氟羧酸的降解。以及调查混合均匀的磷钨酸和TiO2是否增强光催化活性。结果表明,在UV照射TiO2悬浮液下,可以分解全氟羧酸产生CO2和F-。然而,由于低光子效率和强酸的条件(PH1),这方法不能用于工艺过程。Panchangam S.C.[24]等用TiO2做光催化剂,分别加载两个不同数量高氯酸(0.075和0.15M)对光催化进行了比较,在以0.15M高氯酸加载在TiO2上,在紫外(220~460nm)照射,可更好的降解PFOA。HClO4溶液的存在,增加TiO2所产生的空穴和PFOA之间电子的转移,在反应过程中O2同时作为电子转移媒介和氧化剂。Estrellan C R[25]等在TiO2中掺杂金属Fe和Nb来对水中的PFOA进行降解,在HClO4溶液和有O2的环境中,降解效果要优于纯TiO2。金属共掺杂有利于提高TiO2物理化学方面的性质,如比表面积,晶粒尺寸,可见光的吸收,防止锐钛矿型转变成金红石型。更重要的是,Fe:Nb-TiO2较高的活性可以归因于金属的协同效应,Fe降低带隙能量,Nb作为电子阱从而防止电子-空穴对的重组,在扩展波长处促进了更高的吸收和电荷分离的增强。Qu Y[26]等报道了在254nm光照条件下以PH为9,室温和厌氧状况加入KI介质,在光催化作用下能对PFOA降解脱氟。KI在反应过程中可以转移电子而脱氟。促进PFOA 分解的关键试剂,即水合电子,能够通过一系列的KI分解反应生成。通过实验,当KI达到0.3mM时,可以观察到反应峰值。目前,全氟有机酸PFOS或PFOA中所加入的电子转移介质都是溶液,不易回收,对环境会造成很大的污染。
对于PFOS或PFOA这类难降解的有机污染物,光催化降解是一种有效方法。光催化过程中催化剂的选择以及活性的提高尤为重要。TiO2高效并且无毒,近紫外吸收性能良好,无二次污染,其表面可以使一些吸热的反应加速进行,是一种常用的催化剂。同时制备高效廉价的复合型催化剂以便更加有效地降解与控制环境中的PFCs。
2.4声化学降解

超声波降解的原理是在超声波辐射下产生的空化气泡,瞬间破裂产生高能量的冲击波和微射流,此时,空化气泡中的水蒸气发生热解,产生可以分解有机污染物的·HO等自由基。超声声场的效应主要是源于它的空化作用,同时控制溶液的电导率、黏度、表面张力也较为关键。
2.5诱导分解法
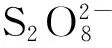
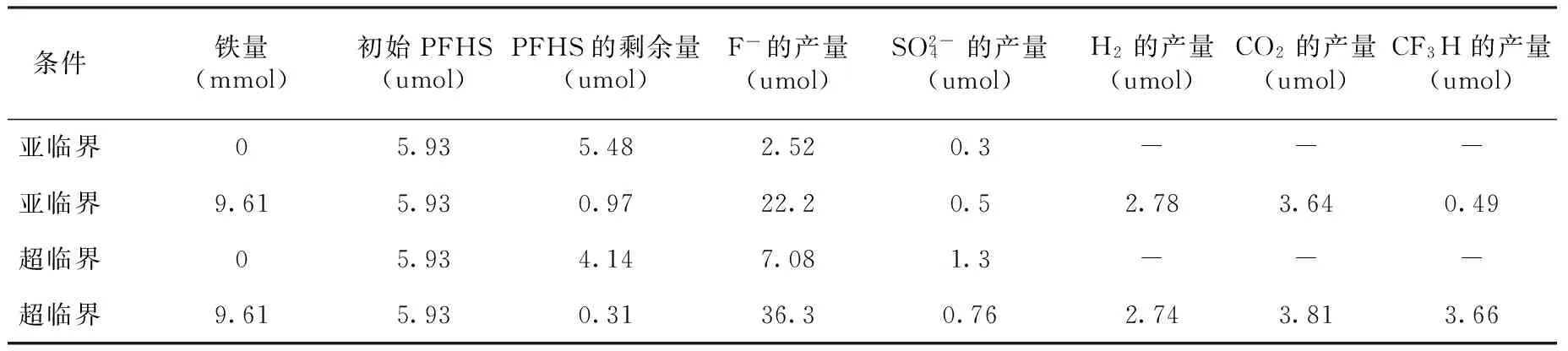
表2 PFHS在次临界水和超临界水中的分解情况
2.6电化学氧化法
最近,通过用BDD电极来电解有机污染物引起了广泛的关注,BDD电极具有可以产生各种活跃的氧化剂的潜能。Tsuyoshi Ochiai[35]等报道了用BDD电极电化学分解PFOA。实验证明,PFOA分解的速率常数随电流密度和标准渗透值增加而增大。被氟化的BDD可以用中等压力的照射光再生。同时,直接的电化学氧化反应主要是电化学氧化可以直接断裂PFOA中的C7H15与COOH之间的C-C键,产生一个C7H15自由基和CO2。C7H15形成不稳定的C7H15OH,接着去氟形成C6F13COF,然后水解成全氟羧酸C6F13COOH和F-。最后,PFOA可以分解成CO2和F-。此外,鉴于BBD表面容易被PFOA溶液电化学反应氟化,中压紫外线灯(MPUV)照射水溶液能够轻易去除BDD表面氟化物。Qiongfang Zhuo[36]等报道用Ti/SnO2-Sb-Bi电极来分解PFOA。经过2 h电解后,超过99%的PFOA得到有效降解。在水溶液中发现的中间产物包括短链CF3COO-,C2F5COO-,C3F7COO-,C4F9COO-,C5F11COO-和C6F13COO-以及F-。电化学氧化机理显示,PFOA分解首先直接电子从PFOA羧基上转移到3.37 V的电位阳极,之后PFOA的脱羧形成全氟辛基允许在全氟辛基和羟基自由基/氧气之间的脱氟反应,电喷雾电离(ESI)质谱进一步确认,PFOA在Ti/SnO2-Sb-Bi电极上的氧化是从PFOA的羧基开始的而不是C-C分裂。实验证明,去除溶液当中PFOA,这是一种有潜力的处理方法。
电化学氧化法无二次污染,可以对难降解的有机物达到很好的降解效果。在采用电化学氧化法降解PFCs的实验中,可以参考电化学氧化法降解其它持久性有机污染物的研究,合理选择并优化电极,考察不同因素对PFCs降解的影响。
3 展望和结语
(1)全氟化合物的去除和降解技术达到了一定的水平,但无论哪种技术仍存在一些缺点。物理法去除全氟化合物成本低、易操作并且普遍适用,但是很难将其完全去除,化学方法易生成F-并且可能会生成短链的全氟羧酸,但是实际操作存在费用高等相关条件的限制。
(2)从多角度分析实际应用的可行性,可将多种方法结合起来,达到协同的效果。试以活性炭为载体,炭基上负载纳米金属氧化物(含纳米TiO2)为主体,掺杂金属单质、金属离子和电子转移介质,开发出集吸附、光催化及电子转移功能于一体的炭基掺杂纳米金属氧化物来高效光催化降解全氟化合物。
(3)今后的研究,仍要考察各种方法的实际操作性,加大力度研究全氟化合物的污染治理,降低全氟化合物对环境、人体的污染,保持生态平衡,切实维护人们的安全。从源头和传播途径着手,研究出经济、安全、环保的新方法。从根本上解除全氟化合物对环境及生物的危害。
[1]Prevedouros K, Cousins I T, Buck R C, et al. Sources, Fate and Transport of Perfluorocarboxylates[J]. Environmental Science & Technology, 2006, 40(1):32-44.
[2]Giesy J P, Kannan K. Peer Reviewed: Perfluorochemical Surfactants in the Environment[J]. Environmental Science Technology, 2002, 36(7):146A-152A.
[3]Prevedouros K, Cousins I T, Buck R C, et al. Sources, Fate and Transport of Perfluorocarboxylates[J]. Environmental Science & Technology, 2006, 40(1):32-44.
[4]Vecitis C D, Wang Y, Cheng J, et al. Sonochemical degradation of perfluorooctanesulfonate in aqueous film-forming foams.[J]. Environ.sci.technol, 2010, 44(1):432-438.
[5]Wang Y, Zhang P. Photocatalytic decomposition of perfluorooctanoic acid (PFOA) by TiO2 in the presence of oxalic acid.[J]. Journal of Hazardous Materials, 2011, 192(3):1869-1875.
[6]Murakami M, Kuroda K, Sato N, et al. Groundwater pollution by perfluorinated surfactants in Tokyo.[J]. Environmental Science Technology, 2009, 43(10):3480-3486.
[7]陈清武, 张鸿, 柴之芳,等. 深圳市沿岸表层海水中全氟化合物的残留特征及其分布规律[J]. 环境科学, 2012, 33(6):1795-1800.
[8]杨永亮, 路国慧, 杨伟贤,等. 沈阳地区水环境和生物样品中全氟化合物的污染分布特征[J]. 环境科学学报, 2010, 30(10):2097-2107.
[9]余强. 水中典型全氟化合物的吸附去除研究[D]. 北京:清华大学, 2009.
[10]牛利. 氨化吸附剂的制备及吸附重金属和全氟化合物研究[D]. 北京:清华大学, 2012.
[11]Ochoa-Herrera V, Sierra-Alvarez R. Removal of perfluorinated surfactants by sorption onto granular activated carbon, zeolite and sludge[J]. Chemosphere, 2008, 72(10):1588-1593.
[12] Li X, Zhao H, Quan X, et al. Adsorption of ionizable organic contaminants on multi-walled carbon nanotubes with different oxygen contents[J]. Journal of Hazardous Materials, 2011, 186(1):407-415.
[13]Yan Q, Zhang C, Fei L, et al. Equilibrium and kinetics study on the adsorption of perfluorooctanoic acid from aqueous solution onto powdered activated carbon[J]. Journal of Hazardous Materials, 2009, 169(1-3):146-152.
[14]Moriwaki H, Kitajima S, Shirai K, et al. Application of the powder of porous titanium carbide ceramics to a reusable adsorbent for environmental pollutants[J]. Journal of Hazardous Materials, 2011, 185(2-3):725-731.
[15]Hori H, Hayakawa E, Einaga H, et al. Decomposition of environmentally persistent perfluorooctanoic acid in water by photochemical approaches.[J]. Environmental Science & Technology, 2004, 38(22):6118-6124.
[16]Hori H, Yamamoto A, Hayakawa E, et al. Efficient decomposition of environmentally persistent perfluorocarboxylic acids by use of persulfate as a photochemical oxidant[J]. Environmental Science & Technology, 2005, 39(7):2383-2388.
[17]Hori H, Yamamoto A, Kutsuna S. Efficient photochemical decomposition of long-chain perfluorocarboxylic acids by means of an aqueous/liquid CO2biphasic system[J]. Environmental Science & Technology, 2005, 39(19):7692-7697.
[18]Cao M H, Wang B B, Yu H S, et al. Photochemical decomposition of perfluorooctanoic acid in aqueous periodate with VUV and UV light irradiation.[J]. Journal of Hazardous Materials, 2010, 179(3):1143-1146.
[19]Wang Y, Zhang P Y, Pan G, et al. Photochemical degradation of environmentally persistent perfluorooctanoic acid (PFOA) in the presence of Fe(Ⅲ)[J]. 中国化学快报(英文版), 2008, 19(3):371-374.
[20]Wang Y, Zhang P, Pan G, et al. Ferric ion mediated photochemical decomposition of perfluorooctanoic acid (PFOA) by 254?nm UV light[J]. Journal of Hazardous Materials, 2008, 160(1):181-186.
[21]宋洲. 紫外光化学氧化/还原处理全氟辛酸的研究[D]. 武汉:华中科技大学, 2014.
[22]Ochiai T, Iizuka Y, Nakata K, et al. Efficient Decomposition of Perfluorocarboxylic Acids in Aqueous Suspensions of TiO 2 Photocatalyst with Medium-Pressure Ultraviolet Lamp Irradiation under Atmospheric Pressure[J]. Industrial & Engineering Chemistry Research, 2011, 50(19):10943-10947.
[23]Dillert R, Bahnemann D, Hidaka H. Light-induced degradation of perfluorocarboxylic acids in the presence of titanium dioxide[J]. Chemosphere, 2007, 67(4):785-792.
[24]Panchangam S C, Lin Y C, Shaik K L, et al. Decomposition of perfluorocarboxylic acids (PFCAs) by heterogeneous photocatalysis in acidic aqueous medium[J]. Chemosphere, 2009, 77(2):242-248.
[25]Estrellan C R, Salim C, Hinode H. Photocatalytic decomposition of perfluorooctanoic acid by iron and niobium co-doped titanium dioxide[J]. Journal of Hazardous Materials, 2010, 179(s 1-3):79-83.
[26]Qu Y, Zhang C, Li F, et al. Photo-reductive defluorination of perfluorooctanoic acid in water[J]. Water Research, 2010, 44(9):2939-2947.
[27]毕晓妹, 刘志莲, 张炉青,等. 含氟有机化合物的转产与降解研究进展[J]. 有机氟工业, 2011,(1):42-46.
[28]Cheng J, Vecitis C D, Park H, et al. Sonochemical Degradation of Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoate (PFOA) in Groundwater: Kinetic Effects of Matrix Inorganics[J]. Environmental Science & Technology, 2010, 44(1):445-450.
[29]Vecitis C D, Park H, Cheng J, et al. Kinetics and Mechanism of the Sonolytic Conversion of the Aqueous Perfluorinated Surfactants, Perfluorooctanoate (PFOA), and Perfluorooctane Sulfonate (PFOS) into Inorganic Products[J]. Journal of Physical Chemistry A, 2008, 112(18):4261-4270.
[30]Vecitis C D, Wang Y, Cheng J, et al. Sonochemical degradation of perfluorooctanesulfonate in aqueous film-forming foams.[J]. Environ.sci.technol, 2010, 44(1):432-438.
[31]Hori H, Nagaoka Y, Sano T, et al. Iron-induced decomposition of perfluorohexanesulfonate in sub- and supercritical water[J]. Chemosphere, 2008, 70(5):800-806.
[32]Hori H, Murayama M, Inoue N, Ishida K, Kutsuna S. Efficient mineralization of hydroperfluorocarboxylic acids with persulfate in hot water[J]. Catalysis Today, 2010, 151(1-2): 131-136.
[33]Lee Y C, Lo S L, Chiueh P T, et al. Efficient decomposition of perfluorocarboxylic acids in aqueous solution using microwave-induced persulfate[J]. Water Research, 2009, 43(11):2811-2816.
[34]Lee Y C, Lo S L, Chiueh P T, et al. Microwave-hydrothermal decomposition of perfluorooctanoic acid in water by iron-activated persulfate oxidation[J]. Water Research, 2010, 44(3):886-892.
[35]Ochiai T, Iizuka Y, Nakata K, et al. Efficient electrochemical decomposition of perfluorocarboxylic acids by the use of a boron-doped diamond electrode[J]. Diamond & Related Materials, 2011, 20(2):64-67.
[36]Zhuo Q, Deng S, Yang B, et al. Efficient electrochemical oxidation of perfluorooctanoate using a Ti/SnO2-Sb-Bi anode.[J]. Environmental Science & Technology, 2011, 45(7):2973-2979.
Research Progress on the Removal Technologies of Typical Perfluorinated Compounds
LU Li-juan1,TANG Min-kang1,CHEN Ying1,GAO Nai-yun2,XU Jian-hong2
(1.SchoolofResources&EnvironmentEngineering,JiangxiUniversityofScience&Technology,Ganzhou,Jiangxi341000,China; 2.StateKeyLaboratoryofPollutionControl&ResourcesReuse(TongjiUniversity),Shanghai200092,China)
Perfluorinated compounds have been produced and applied for more than 50 years, among which perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) are the most typical two compounds. Due to its excellent physical and chemical properties, it has been widely used in production and life. However, in recent years, researchers and scholars began to concern about the impact of perfluorinated compounds on the environment, biology and human body since it has reproductive toxicity, mutagenic toxicity anddevelopmental toxicity. The existing methods for removal of typical Perfluorinated compounds are photochemical degradations, adsorption removal techniques, electrochemical oxidizing methods, etc. After analyzing the characteristics and current situation of the Perfluorinated compounds, this paper reviewed the removal technologies of typical perfluorinated compounds both in our country and abroad, future research direction and trend of the Perfluorinated compounds were prospected.
Perfluorinated compounds; characteristics; analysis of pollution status; removal technologies
2016-05-04
国家自然科学基金项目(51208364)。
卢丽娟(1992-),女,内蒙古乌兰察布市人,江西理工大学安全工程专业2014级在读硕士研究生,从事水处理及技术方向研究。
唐敏康,584843521@qq.com。
X703
A
1001-3644(2016)05-0135-07
