鲈鱼stat6 cDNA克隆及表达分析
2016-11-08于小娜刘艳杰钱云霞
于小娜, 刘艳杰, 钱云霞
(宁波大学 海洋学院, 宁波 315211)
鲈鱼stat6 cDNA克隆及表达分析
于小娜, 刘艳杰, 钱云霞
(宁波大学 海洋学院, 宁波 315211)
信号转导和转录激活因子6(Signal transducers and activators of transcription,STAT6)在白介素IL-4、IL-13诱导的炎症反应中起关键作用。利用RT-PCR和SMART RACE的方法从鲈鱼(Lateolabraxjaponicus)肝脏中克隆得到stat6全长cDNA序列。该序列的cDNA为3938 bp,5′ 非翻译区295 bp,3′ 非翻译区1369 bp,开放阅读框2274 bp,可编码757个氨基酸,蛋白质分子质量为86.43 ku,等电点为5.90。分析STAT6氨基酸序列发现,与鳜鱼相似性达93.7%;与人相似性为41.7%。荧光定量PCR结果表明,stat6在脾、头肾、大脑、肠和鳃中表达较高。腹腔注射哈维氏弧菌3 h后,stat6在脾、头肾、肠、鳃组织中的表达均显著上调(P<0.05),表明细菌感染会增加stat6的表达。研究结果为进一步研究鱼类stat6在病原菌感染免疫中的分子机制提供一定基础。
stat6;鲈鱼;克隆;组织表达
信号转导和转录激活因子(Signal transducers and activators of transcription,STATs)是一种存在于胞浆内的转录因子,能被多种配体激活形成二聚体,随后从细胞浆转移到细胞核,与目标基因启动子区的DNA结合,从而调节该基因的表达[1-2]。在哺乳动物中,STATs家族包含7个成员,即STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6[3]。研究发现不同的STATs功能不同,在小鼠中证实STAT1在干扰素系统和先天免疫系统上起到至关重要的作用[4],白介素IL-6信号对STAT3在人类造血细胞和抗凋亡中是必需的[5]。STAT5a和STAT5b在小鼠生长、哺乳期和造血中有着重要功能[6]。以上研究表明了STAT1、STAT3和STAT5有广泛的生物学效应,而偶数STAT蛋白质功能相对受限制,大部分集中在免疫应答上,如STAT2被干扰素α/β激活,STAT4被IL12激活,STAT6被IL4和IL13激活[7-8]。
STAT6作为STATs的重要成员之一,Kaplan等[9]报道STAT6在白介素4(interleukin-4,IL-4)、白介素13(interleukin-13,IL-13)诱导的炎症反应中起关键作用。当IL-4和细胞膜上的IL-4 受体的α链发生结合后,IL-4 受体形成异二聚体,从而引发酪氨酸激酶系统JAK的激活,使胞浆内STAT6的酪氨酸残基磷酸化而被激活,继而进入细胞核内与特定的 DNA位点结合,最终诱导相关炎症基因,如IgE、IL-4R、Eotaxin、FcR和Ⅱ类MHC等的转录表达[10-11]。
也有报道STAT6参与了鱼类的免疫应答。鲶鱼(Pangasiushypophthalmus)白细胞中,STAT6蛋白在生长因子和有丝分裂原刺激下被激活并移到核内。此外,鲶鱼的非特异性细胞毒性细胞抗原受体NCCRP-1(nonspecific cytotoxic cells antigen receptor)和JAK激酶作用后刺激STAT6的活性和核移位[12]。目前stat6已经在鳜鱼(Sinipercachuatsi)[13]、东方鲀(Tetraodonfluviatilis)[2]等鱼类中被分离克隆以及进行初步功能的研究,在东方鲀中发现STAT6的N-末端结构域和卷曲螺旋结构域在哺乳动物IL-4受体复合体和STAT6之间的相互作用中起着关键作用。鳜鱼的研究表明,鱼类的JAK/STAT信号转录途径与哺乳动物相似,并且这种信号转录途径在鱼类的抗病毒应答调节中起着至关重要的作用。
鲈鱼(Lateolabraxjaponicus)属鲈形目,鮨科,花鲈属。广泛分布于太平洋西部、中国沿海地区,属于广盐性鱼类,其肉质细腻,营养丰富,是我国重要的海水养殖经济鱼类。本研究从鲈鱼肝脏中克隆了鲈鱼信号转导及转录激活因子stat6,并对其进行结构和特点分析,利用Real-time PCR技术分析哈维氏弧菌感染后鲈鱼stat6的表达变化,为今后研究鲈鱼stat6在免疫中的作用提供基础。
1 材料与方法
1.1 材料
鲈鱼采自宁波水产品大世界,大肠杆菌DH5α,由本实验室保存。Trizol试剂(Invitrogen公司);逆转录试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit)、SMARTTMRACE cDNA Amplification Kit、rTaq酶、pMD18-T Vector、SYBR Premix EX TaqTMII购自TaKaRa生物有限公司;凝胶回收试剂盒购于Beyotime公司。
1.2 方法
1.2.1 总RNA提取和cDNA的合成
麻醉后解剖鲈鱼,将心脏、肝、脾、头肾、鳃、眼、脂肪、肌肉、大脑和肠组织,放于液氮中,用Trizol试剂提取总RNA。用ND-2000微量核酸测定仪测定RNA浓度,各取1 μg总RNA按照PrimeScriptTM1st Strand cDNA Synthesis Kit说明书进行逆转录反应,将合成的cDNA进行-20℃保存。另取1 μg肝脏总RNA按照SMARTTMRACE cDNA Amplification Kit说明书合成3′和5′ Ready cDNA,合成的DNA 进行-80℃保存。
1.2.2 鲈鱼stat6全长cDNA序列的克隆
实验室经华大基因高通量测序,获得鲈鱼cDNA文库,BLAST比对,有一预测的stat6序列片段与鳜鱼stat6相似度达到90%以上,根据该序列片段,设计引物stat6-F0:TGTTTGACTGAAGCCCTGC和stat6-R0:CAATGTCTGCTTTGCTCTCA,以鲈鱼肝脏cDNA为模板扩增stat6。PCR反应条件如下:94℃预变性5 min;94℃变性 30 s,54℃退火 30 s,72℃延伸 2 min 30 s,共35个循环;最后72℃再延伸8 min。
5′ RACE和3′ RACE扩增使用按Clontech公司的SMARTTMRACE cDNA Amplification Kit说明书进行。根据验证过的已知片段,设计3′和5′端引物stat6-3′ F1:TGACGACAACCTCAACCCCCTGC和stat6-5′ R1:TCAGAGAGAGGTGCCAGGGATGTAGC,分别以3′ RACE cDNA和5′ RACE cDNA为模板,以及试剂盒提供通用引物UMP进行3′ RACE和5′ RACE PCR反应。第2轮PCR的引物为stat6-3′ F2:CCTGGGAAGCCTGTGGTGCTAAAG和stat6-5′ R2:CCGATGGGTGACGCTTGAGGCT,与试剂盒提供的引物Nest-UPM分别进行PCR扩增,PCR条件按照说明书进行。
将上述PCR产物凝胶电泳,割胶回收,与pMD-18T Vector连接,转化至大肠杆菌DH5α中,挑克隆PCR阳性检测,送至上海Invitrogen公司测序。
1.2.3 鲈鱼STAT6氨基酸的序列分析
通过http://web.expasy.org/compute_pi/在线预测STAT6蛋白质的分子质量、等电点,利用http://smart.embl-heidelberg.de/在线分析STAT6蛋白质结构,利用Bioedit比对氨基酸序列,用MEGA6.0构建STAT6的进化树。
1.2.4 鲈鱼stat6组织表达分析
根据已得到的鲈鱼stat6的cDNA序列,设计荧光定量stat6引物和内参基因stat6-F:AAGGAGTGTGTGGACTGTTTGG,stat6-R:GAGGTTGTCGTCAAAAGGATGT,β-actin-F:TGTGCAAAGCCGGATTCG,β-actin-R:CCTCTCTTGCTCTGGGCTTCA,以心脏、肝、脾、头肾、鳃、眼、脂肪、肌肉、大脑和肠组织的cDNA为模板,扩增目的片段长度为114 bp。反应条件为:95℃预变性20 s;95℃变性15 s,58℃退火15 s,68℃延伸20 s,40个循环。反应结束后,通过测得Ct值,再利用2-△△Ct法计算stat6在不同组织中的相对表达量。
1.2.5 哈维氏弧菌感染后stat6表达分析
取50条体重约100 g,体长约20 cm的新鲜鲈鱼进行感染。水温15℃,pH 7.2,盐度25‰,分成4组放入养殖箱,2组为实验组,另2组为对照组,实验组腹腔注射100 μL哈维氏弧菌(3.8×106CFU/mL),对照组腹腔注射生理盐水,分别在0、3、6、12和24 h随机各取5条鲈鱼,麻醉后取脾、头肾、肠和鳃组织,通过Real-time PCR测定stat6的表达。数据处理方法同上,利用SSPS 13.0软件进行显著性分析。
2 结果
2.1 鲈鱼stat6全长cDNA的克隆
通过stat6-F0和stat6-R0引物从鲈鱼肝脏的cDNA中扩增得到长度为2350 bp的产物,经BLAST分析是鲈鱼stat6。根据该序列设计RACE引物,分别得到2290 bp的5′ 末端和2638 bp的3′ 末端,将其拼接得到stat6的全长cDNA序列(GeneBank 登录号为KT956195)。鲈鱼stat6全长cDNA序列为3938 bp,5′ UTR和3′UTR分别为295 bp和1369 bp,含有PolyA加尾信号aataaa,最后以Poly(A)结尾。整个CDS为2274 bp,编码757个氨基酸,该蛋白质的分子质量为86.43 ku,等电点5.90(图1)。
2.2 鲈鱼STAT6的氨基酸序列分析
通过NCBI的BLAST将鲈鱼STAT6氨基酸序列进行相似性检索,发现鲈鱼与同为鲈形目的鳜鱼相似性最高,为93.7%;与鲈形目的大黄鱼(Larimichthyscrocea)和鲀形目的东方鲀也都有较高的相似性,分别为86.7%和73.7%。与亲缘关系较远的鲤形目鲤鱼和鲶形目斑点叉尾鮰相似性为64.6%和61.5%。与人(Homosapiens)、牛(Bostaurus)和大鼠(Rattusnorvegicus)相似性分别为41.7%、40.8%和40.3%。
多序列比对结果显示(图2),鲈鱼STAT6蛋白质和其他物种一样,存在着高度保守的功能结构域,包括N-末端结构域(2~125区段),卷曲螺旋结构域(143~304区段),DNA结合域(306~551区段),SH2结构域(560~647区段)和转录激活域(648~757区段)。根据http://www.expasy.ch/swissmod/SWISS-MODEL.html在线软件分析,鲈鱼STAT6的卷曲螺旋结构域是由4个α螺旋结构组成,分别在143~184、198~250、260~279、285~303区段。
利用MEGA6.0软件建立STAT6系谱树(图3)。从系谱树可以看出,STAT6可以分成两大分枝。第一分枝是哺乳类、两栖类和爬行类,第二分枝是硬骨鱼类。
2.3 鲈鱼stat6组织表达分析
荧光定量PCR结果显示,stat6在鲈鱼检测的组织中都表达,在脾、头肾、鳃、大脑和肠组织中表达较高,在心脏、眼、脂肪和肌肉中表达较少,其中肌肉表达量最低,鳃中表达最高(如图4)。
2.4哈维氏弧菌感染后stat6表达变化
由于stat6在脾、头肾、肠和鳃中表达较高,因此用Real-time PCR技术检测注射哈维氏弧菌后stat6在鲈鱼这4个组织中的表达变化。结果显示,腹腔注射哈维氏弧菌3 h后,鲈鱼stat6 mRNA表达在脾、头肾、肠和鳃中显著增加(P< 0.05),脾、肠和鳃在6 h达到峰值,12 h回落,24 h继续下降,但仍高于对照组,而头肾在12 h达到峰值,24 h回落,同样仍显著高于对照组(如图5)。

图2 鲈鱼、鳜鱼、大鼠和人STAT6的氨基酸序列比较Fig 2 STAT6 amino acid sequences from L. japonicus, S. chuatsi, R. norvegicus and H. sapiens黑色区域代表相同氨基酸;*代表酪氨酸(Tyr);黑框代表NCoA-1结合位点;下划线代表α螺旋
3 讨论
本研究用RACE-PCR方法在鲈鱼肝脏中克隆得到stat6的cDNA全长,并推断可翻译757个氨基酸。该蛋白具有5个典型特征: N-末端结构域、卷曲螺旋结构域、DNA结合域、SH2结构域和转录激活域。
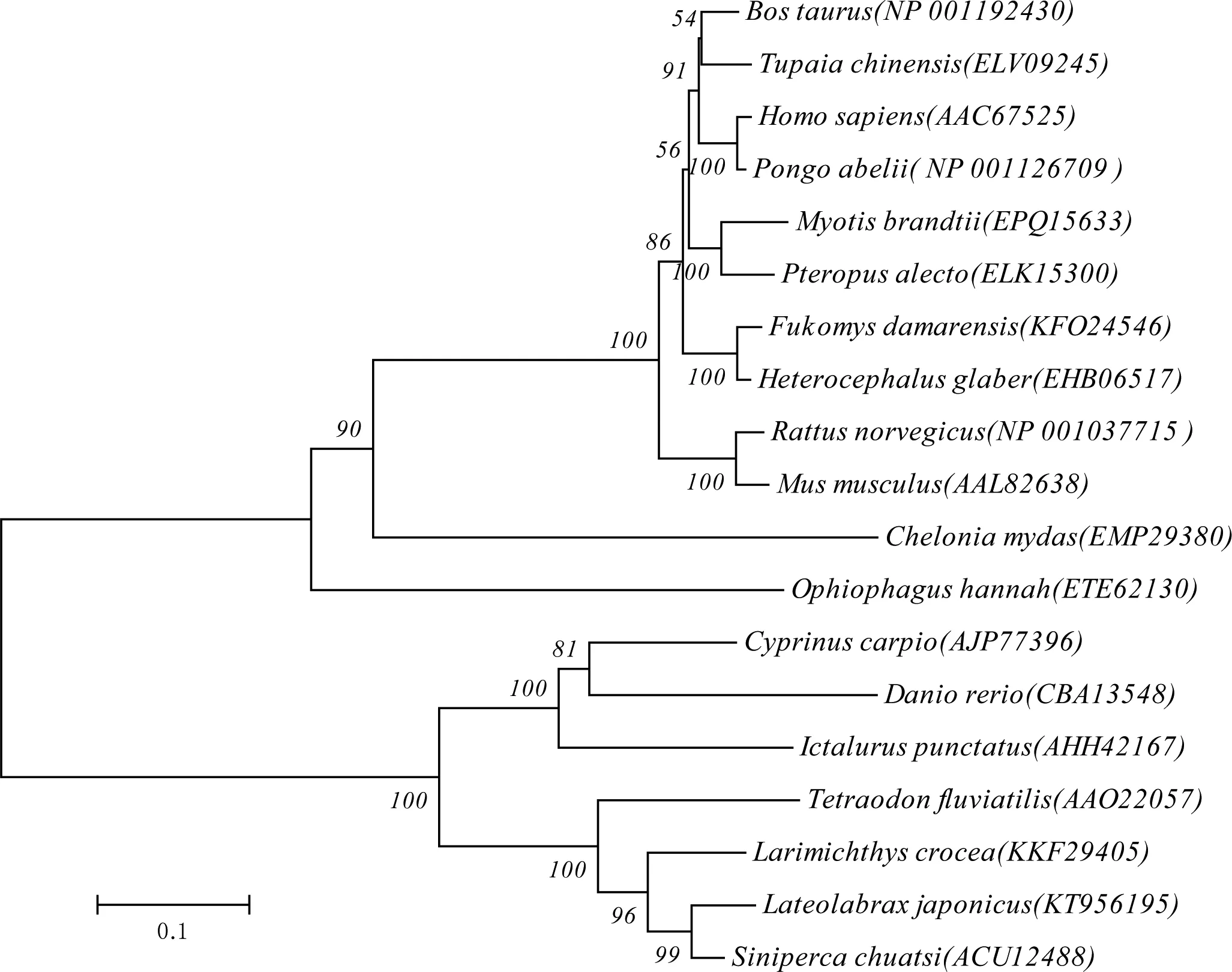
图3 鲈鱼与其他物种STAT6氨基酸序列进化树Fig 3 Phylogenetic tree of STAT6 amino acid sequence of L. japonicus and other species
STAT蛋白的卷曲螺旋区域参与了受体结合、磷酸化和核转运过程[1]。STAT1的晶体结构显示,卷曲螺旋区是由4个α螺旋状结构组成,为转录因子和调节蛋白提供作用位点[14]。鲈鱼STAT6的卷曲螺旋结构域也包含4个α螺旋(图3),推测鲈鱼STAT6蛋白的卷曲螺旋结构具有和转录因子互相作用的功能。
STAT6的激活需要依靠IL-4和IL-13参与,当其与受体结合后,引发酪氨酸激酶系统JAK的激活,使受体磷酸化,磷酸化后的受体与STAT6的SH2结构域结合,使得STAT6的Tyr-641也被JAK激酶磷酸化。随后STAT6形成二聚体并定位到核内并调节目标基因的转录[11]。可见641位的Tyr磷酸化是STAT6调控目标基因转录的关键因素,Yumiko等证实第641位的Tyr发生突变,STAT6将丧失与结合DNA的能力[15]。在东方鲀,STAT6的Tyr-637的酪氨酸的发生突变后也不能和DNA发生结合,不能转录激活目标基因[2]。鲈鱼STAT6蛋白的第641个氨基酸残基也是酪氨酸(Tyr),恰好在SH2区域上,推测鲈鱼STAT6蛋白的SH2区域在磷酸化和二聚体形成过程中发挥重要功能。
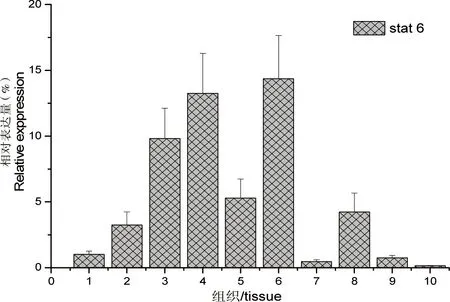
图4 鲈鱼stat6在不同组织中的表达Fig 4 Expression of stat6 in various tissues of L. japonicus
1:心脏;2:肝;3:脾;4:头肾;5:肠;6:鳃;7:眼;8:大脑;9:脂肪;10:肌肉
所有STAT蛋白质均可和有回文结构[TTC(N)2-4GAA]的DNA结合,而STAT6 所结合的DNA元件特征是中间间隔3或4个核苷酸[16]。研究发现在哺乳动物中β-酪蛋白、免疫球蛋白和IRF4(Interferon regulatory factor 4)的启动子区都存在该序列[17-18],因而这3个都是STAT蛋白的靶基因。在斑马鱼(Danio rerio)中,IRF4的启动子区也存在与STAT6的DNA结合域结合的回文序列[18],因此在鱼类中IRF4同样可作为STAT6的靶基因。
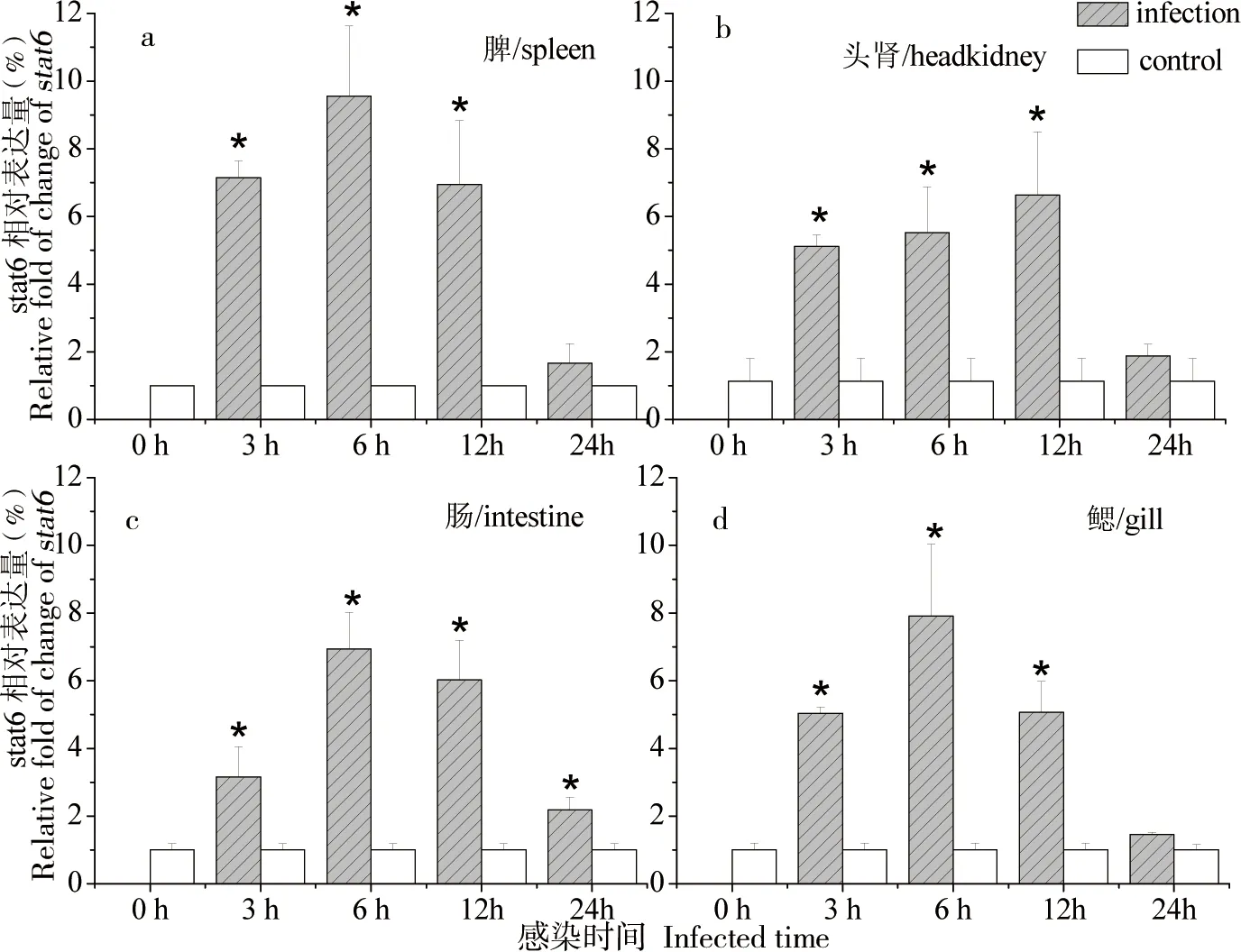
图 5 哈维氏弧菌感染后stat6在脾、头肾、肠、鳃中的表达变化Fig 5 Expression of stat6 in spleen, kidney, intestine and gill of L. japonicus after intraperitoneal injectin of Vibrio harveyi
*表示显著差异(P<0.05)
STAT6转录激活域的特点是其转录激活效应依赖于细胞的类型,可能是不同细胞所具有的转录共激活子不同。人STAT6通过其转录激活域的羧基端招募结合共激活子NCoA-1,这种结合依赖于STAT6羧基端的LXXLL基序[19-20],我们在鲈鱼STAT6蛋白的羧基端并没有发现存在LXXLL基序,所以无法推断其转录激活是否需要共激活子NCoA-1参与。哺乳动物中STAT6转录激活域富含脯氨酸(Pro),虽然东方鲀鱼STAT6蛋白的转录激活域和哺乳动物的有着很大差异,但是这种差异性并没有影响STAT6蛋白的功能[2]。
鲈鱼stat6在所检测的10个组织中均有表达,与东方鲀鱼和黄颡鱼(Pelteobagrusfluvidraco)[21]研究结果类似,其中鲈鱼stat6在脾、头肾、大脑、肠和鳃中表达较高,当腹腔注射哈维氏弧菌3 h后,stat6在脾、头肾、鳃、肠组织中均显著上调,证明了stat6在抵抗细菌感染过程中扮演着重要作用,为stat6在研究鱼类病原菌感染免疫分子机制提供了一定的基础。
[1]黄 路, 高 峰. 信号转导及转录激活因子(STATs)结构与功能研究进展[J]. 陕西师范大学学报(自然科学版), 2005, 33: 112-117.
[2]SUNG S C, CHENG C H, CHOU C M, et al. Expression and characterization of a constitutively activeSTAT6 fromTetraodon[J]. Fish & Shellfish Immunology, 2010, 28(s5-6): 819-828.
[3]VAINCHENKER W, CONSTANTINESCU S N. Jak/stat signaling in hematological malignancies[J]. Oncogene, 2013, 32(21): 2601-2613.
[4]DE PRATI A C, CIAMPA A R, CAVALIERI E, et al. STAT1 as a new molecular target of anti-inflammatory treatment[J]. Current Medicinal Chemistry, 2005, 12(16): 1819-1828.
[5]HODGE D R, HURT E M, FARRAR W L. The role of IL-6 and STAT3 in inflammation and cancer[J]. European Journal of Cancer, 2005, 41(16): 2502-2512.
[6]BARASH I. STAT5 in the mammary gland: controlling normal development and cancer[J]. Journal of Cellular Physiology, 2006, 209(2): 305-313.
[7]WATFORD W T, HISSONG B D, BREAM J H, et al. Signaling by IL-12 and IL-23 and the immunoregulatory roles of STAT4[J]. Immunological Reviews, 2004, 202(1): 139-156.
[8]KIMA Y H, NINOMIYAA Y, YAMASHITAA S, et al. IL-4 receptor α in non-lipid rafts is the target molecule of strictinin in inhibiting STAT6 activation[J].Biochem Biophys Res Commun, 2014, 450(1):824-830.
[9]KAPLAN M H, SEHRA S, CHANG H C, et al. Constitutively activeSTAT6 predisposes toward a lymphoproliferative disorder[J]. Blood, 2007, 110(13): 4367-4369.
[10]LEE Y L, YEN J J, HSU L C, et al. Association ofSTAT6 genetic variants with childhood atopic dermatitis in Taiwanese population[J]. Journal of Dermatological Science, 2015, 79(3): 222-228.
[11]GONZ LEZ-ARENAS A, VALADEZ-COSMES P, JIM NEZ-ARELLANO C, et al. Progesterone-induced blocking factor is hormonally regulated in human astrocytoma cells, and increases their growth through the IL-4R/JAK1/STAT6 pathway[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2014, 144: 463-470.
[12]EVANS D L, LEARY J H 3RD, JASO-FRIEDMANN L. An antigen receptor (NCCRP-1) on nonspecific cytotoxic cells is a phosphoprotein associated with the JAK-STAT activation pathway[J]. Cell Signal, 1999, 11(4): 287-292.
[13]GUO C J, ZHANG Y F, YANG L S, et al. The JAK and STAT family members of the mandarin fishSinipercachuatsi: molecular cloning, tissues distribution and immunobiological activity[J]. Fish & Shellfish Immunology, 2009, 27(2): 349-359.
[14]CHEN X, VINKEMEIER U, ZHAO Y, et al. Crystal structure of a tyrosine phosphorylated STAT1 dimer bound to DNA[J]. Cell, 1998, 93(5): 827-839.
[15]MIKITA T, CAMPBELL D, WU P, et al. Requirements for interleukin-4-induced gene expression and functional characterization of Stat6[J]. Molecular and Cellular Biology, 1996, 16(10): 5811-5820.
[16]SCHINDLER U, WU P, ROTHE M, et al. Components of aSTATrecognition code: evidence for two layers of molecular selectivity[J]. Immunity, 1995, 2(6): 689-697.
[17]MORIGGL R, BERCHTOLD S, FRIEDRICH K, et al. Comparison of the transactivation domains ofSTAT5 andSTAT6 in lymphoidcells and mammary epithelial cells[J]. Molecular and Cellular Biology, 1997, 17(7): 3663-3678.
[18]LI S, GUO X, LU L F, et al. Regulation pattern of fish irf4 (the gene encoding IFN regulatory factor 4) bySTAT6,c-RelandIRF4[J]. Developmental and Comparative Immunology, 2015, 51(1): 65-73.
[19]LITTERST C M, PFITZNER E. Transcriptional activation bySTAT6 requires the direct interaction with NCoA-1[J]. Journal of Biological Chemistry, 2001, 276(49): 45713-45721.
[20]GOENKA S, KAPLAN M H. Transcriptional regulation bySTAT6[J]. Immunologic Research, 2011, 50(1): 87-96.
[21]WU K, TAN X, XU Y H, et al. JAK and STAT members of yellow catfishPelteobagrusfulvidracoand their roles in leptin affecting lipid metabolism[J]. General and Comparative Endocrinology, 2016, 226 (15): 14-26.
Gene cDNA cloning and expression analysis of stat6 from Lateolabrax japonicas
YU Xiao-na, LIU Yan-jie, QIAN Yun-xia
(School of Marine Science, Ningbo University, Ningbo 315211, China)
Signal transduction and transcriptional activation factor 6 plays an important role in the inflammation induced by IL-4 and IL-13. A full-length cDNA of thestat6 in sea perch (Lateolabraxjaponicus) was amplified by RT-PCR and SMART RACE methods. The cDNA was 3938 bp with 5′-UTR of 295 bp, 3′-UTR of 1369 bp and open reading frame of 2274 bp. It encoded a protein of 757 amino acids with the molecular weight of 86.43 ku and pI 5.90. The blast analysis indicated that the deduced amino acids sequence of sea perch STAT6 shared the highest identity of 93.7% withSinipercachuatsiand the lowest identity of 41.7% withhomosapien. Real-time PCR results showed thatstat6 was expressed in all tissues tested with higher levels in spleen, kidney, brain,intestine and gill. The expression ofstat6 increased obviously in spleen, kidney, intestine and gill after intraperitoneal injectin ofVibrioharveyi. This obtained information will provide a theoretical basis for studying the molecular mechanism of fishstat6 in regulating fish immune response to pathogens.
stat6;Lateolabraxjaponicus; cloning; tissue expression
2015-12-21;
2016-01-19
宁波大学“水产”浙江省重中之重开放基金资助(xkzsc1513)
于小娜,硕士研究生,研究方向为水产动物免疫基因,E-mial: 1034051030@163.com
钱云霞,教授,硕士生导师,主要从事水产动物分子生物学,E-mial: qianyunxia@nbu.edu.cn
Q786
A
2095-1736(2016)05-0053-05
doi∶10.3969/j.issn.2095-1736.2016.05.053
