巢湖5种鱼类肌肉部位有机氯农药分布特征研究及风险评估
2016-11-08孙丙华吴唤玲李进华
徐 彪, 孙丙华, 姜 珊, 吴唤玲, 李进华,2
(1.安徽大学 资源与环境工程学院, 合肥 230601; 2.合肥师范学院 生命科学学院, 合肥 230601)
巢湖5种鱼类肌肉部位有机氯农药分布特征研究及风险评估
徐 彪1, 孙丙华1, 姜 珊1, 吴唤玲1, 李进华1,2
(1.安徽大学 资源与环境工程学院, 合肥 230601; 2.合肥师范学院 生命科学学院, 合肥 230601)
为了了解不同食性鱼类不同肌肉组织的有机氯农药(OCPs)富集特征,探讨鱼类监测背部肌肉取样的合理性及巢湖鱼类有机氯农药风险。通过索氏提取—磺化去脂—层析柱净化—旋转蒸发和氮吹浓缩—气相色谱与质谱联用仪分析的方法,对巢湖5种鱼类的4个不同肌肉部位的六六六(HCHs)和滴滴涕(DDTs)质量分数进行了分析。结果表明:巢湖5种鱼类肌肉部位的OCPs的平均浓度为2.929~10.523 ng/g。其中肉食性鲶鱼(10.523 ng/g)>植食性鲢鱼(6.407 ng/g)>肉食性乌鳢(4.514 ng/g)>杂食性青鱼(3.390 ng/g)>杂食性鲫鱼(2.292 ng/g)。整体上呈现出肉食性鱼类(鲶鱼)>植食性(鲢鱼)>杂食性(青鱼等)的特点。鲶鱼和乌鳢的尾上肌肉、鲢鱼和鲫鱼的腹部肌肉OCPs含量显著高于其背部肌肉富集含量。背部肌肉不能完全代表整个鱼体肌肉的富集特征。建议在鱼类肌肉OCPs含量分析时选择各肌肉部位的混合样品来进行分析。巢湖鱼类体内的六六六和滴滴涕估算每日摄食量远低于国家标准所规定的每日摄食量。食用巢湖鱼类产生有机氯农药危害的风险较低。
巢湖; 鱼类; 有机氯农药; 富集; 分布特征
有机氯农药(OCPs)是公认的环境优先控制污染物[1]。该类物质可通过降雨、地表径流等方式进入水生生态系统,经食物链在生物体内蓄积,可对生物体产生致畸、致癌、致突变的“三致”效应[2-3],严重危害水生生物健康和水产品安全[4]。鱼类处于水生生态系统食物链的顶端,受OCPs危害严重。鱼类OCPs的富集特征研究及鱼类食品安全问题,是近年来广泛关注的热点[5-8]。
现今鱼类OCPs富集的研究热点主要集中在对其肌肉组织含量的检测并进行相应的风险评估[8-9]。其中鱼类监测的样品大多取自于鱼类背部肌肉[10-11],少数取样于腹部肌肉[9]。不同肌肉部位的分布特征的相对研究较少,已有研究发现鱼类背部肌肉四溴双酚A含量低于腹部肌肉的[12],但并没有进行肌肉部位的差异性分析。 OCPs在鱼类各肌肉部位中是否具有显著差异性有待进一步分析。鱼类肌肉部位的OCPs分布的差异性分析可为鱼类取样来自于背部肌肉是否合理提供基础数据。通过各肌肉部位的OCPs含量分析更全面地为食鱼风险提供依据。
本文选择5种常见巢湖鱼类即鲢鱼、青鱼、鲫鱼、乌鳢和鲶鱼作为研究对象,以期探讨OCPs在不同食性鱼种间肌肉组织中的分布特征,通过分析鱼类肌肉部位分布特征和差异性判断鱼类取样主要来自于背部肌肉的合理性,为鱼类有机氯农药风险提供数据支持。
1 材料和方法
1.1 实验样品
依据水和废水监测分析方法第4版中关于鱼类的生物调查中规定的标准,于2013年10月购买了巢湖常见的5种市售经济性鱼类,每种选择4条以满足分析要求。鱼样通过侧线、尾鳍等划分为背部肌肉、腹部肌肉、尾部上侧肌肉(简称尾上肌肉)、尾部下侧肌肉(简称尾下肌肉)4个肌肉部位。样品剪碎装袋后在-20℃条件下冷冻保存。鱼类相关参数如表1。
表1 巢湖鱼类相关参数
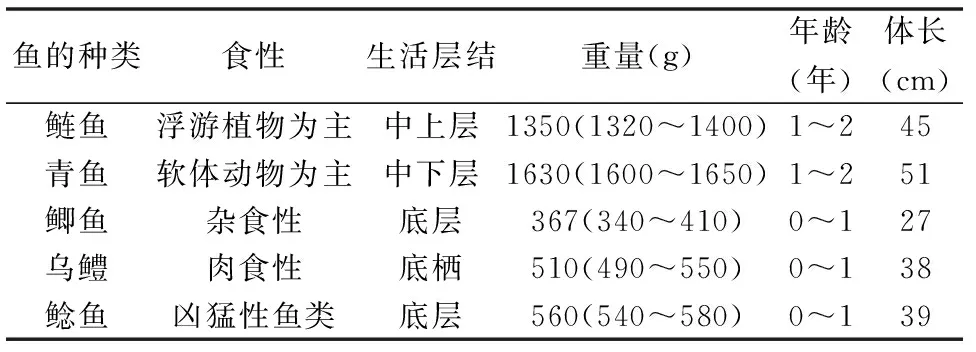
Table 1 Parameters for fishes in Chao Lake
1.2 仪器与耗材
仪器:索氏提取器(SXT-06),旋转蒸发仪(RE52A),氮吹仪(D10-12),气相色谱与质谱联用仪(Aligent7890A5975C)。
耗材:正己烷、二氯甲烷、丙酮(天津四友、色谱纯),无水硫酸钠(西陇化工),柱层层析硅胶(青岛海洋化工),氧化铝(上海五四)。
有机氯标样:由上海安谱仪器设备有限公司代购o2si 8种(α-BHC、γ-BHC、β-BHC、δ-BHC、p,p′-DDE、 o,p′-DDE、 p,p′-DDD、 p,p′-DDT)有机氯农药混标。以正己烷作为溶剂配制成10 mg/L的有机氯农药混标储备液。
1.3 实验方法
1.3.1 预处理方法
冷冻干燥48 h后的10 g鱼样与无水硫酸钠1∶1混匀后在100 mL(1∶1配比的正己烷和丙酮)溶液中索氏提取18 h。提取液经浓硫酸磺化去脂,然后使用3%硫酸钠溶液去磺化。去磺化得到的样品液通过以氧化铝、硅胶为填料的玻璃层析柱净化。净化液经旋转蒸发仪和氮吹仪定容到1 mL后使用气相色谱与质谱联用仪(GC/MS)检测分析。
1.3.2 分析方法
气质色谱条件:自动进样器不分流进样,进样量为1μL。HP5-MS色谱柱(30 m×250 μm×0.25 μm);进样口温度210℃;柱温程序:80℃保留1 min,20℃/min升温到190℃保留5 min,5℃/min升温到220℃保留5 min,10℃/min升温到250℃保留3 min,20℃/min升温到280℃保留3 min。280℃后运行1 min。辅助加热器打开加热器温度260℃。柱流速:1 mL/min;载气为高纯氦气。
质谱条件:电子轰击电离源(EI);电子能量70 eV;离子阱温度220℃;传输线温度270℃;溶剂延迟5 min;SIM扫描方式。
1.3.3 标准曲线、最低检出限、方法回收率和精密度
使用外标法定量。以不同浓度混合标准(x)和其得到的不同面积(y)来绘制标准曲线。经数据分析得出的相关系数均大于0.99,满足定量分析条件。并根据低浓度曲线以3倍信噪比得出各组分的最低检出限。
所有样品通过投加内标物2,4,5,6-四氯间二甲苯(TCMX)得出的方法回收率范围为84.4%~103.1%。回收率范围满足分析要求。通过6次重复加标回收试验,使用外标法计算其回收率和相对标准偏差。结果显示:有机氯农药回收率范围为81.74%~113.84%,相对标准偏差(RSD)为3.31%~10.06%,满足农药多残留分析的要求。
1.4 数据分析方法
采用Excel和SPSS19.0统计分析软件进行数据分析处理, SPSS检验用于差异性和相关性分析。
2 结果与分析
2.1 不同鱼类体内OCPs含量
鱼类富集OCPs的主要途径之一是通过鳃膜从水中吸收[13];另一种是通过肠道摄食富集[14]。一般而言,食物链中营养级越高,摄食途径在环境暴露中也就越重要。本文选择了不同食性的鱼类对其体内的有机氯农药的分布进行了研究。结果显示:鱼类体内的OCPs的平均浓度范围为2.929~10.523 ng/g。肉食性鲶鱼(10.523 ng/g)>植食性鲢鱼(6.407 ng/g)>肉食性乌鳢(4.514 ng/g)>杂食性青鱼(3.390 ng/g)>杂食性鲫鱼(2.292 ng/g)。经差异性分析发现:除杂食性青鱼和杂食性鲫鱼差异性不显著(P=0.116>0.05,N=20)外其余鱼种两两间均有显著性差异(P<0.001,N=20)。与近海鱼类OCPs富集对比我们发现巢湖鱼类体内的HCHs与DDTs富集差异性不显著[15]。
通过对5种鱼种间的对比发现:肉食性鲶鱼在5种鱼类中OCPs富集最高。这与已有研究肉食性鱼类OCPs富集含量高于其他食性鱼类的结果相似[16]。已有研究表明含脂率、营养位置和年龄等也是鱼类OCPs富集的主要影响因素。且对鱼类富集DDTs等影响因素中营养位置比年龄更重要[17]。由于本研究针对的是市售的年龄一定的经济性鱼样,因此没有考虑到不同年龄鱼类富集OCPs的特征。我们通过鱼类肠道富集暴露及含脂率对5种鱼类OCPs富集差异进行了分析。5种鱼类的肠道(含肠系膜)OCPs富集含量研究发现鲶鱼、乌鳢和鲢鱼3种鱼类富集含量均高于25 ng/g。而青鱼和鲫鱼富集含量均小于10 ng/g。这一结果说明鲶鱼等3种鱼类较青鱼和鲫鱼OCPs暴露更多,因而导致这3种鱼富集含量较高。3种鱼类中富集时间相当的肉食性鲶鱼显著高于肉食性乌鳢。对它们的肌肉含脂率进行了分析,与已有研究相似,鱼类肌肉组织部位与其含脂率之间存在着显著的正相关关系(P<0.020,N=16)[18]。鲶鱼的肌肉含脂率显著高于乌鳢的,含脂率可能是导致鲶鱼和乌鳢虽然营养位置、富集年龄相当而鲶鱼含量高于乌鳢的主要原因。此外我们还注意到植食性鲢鱼体内的OCPs含量也显著高于肉食性乌鳢的含量,这可能是由于鲢鱼对OCPs富集时间较乌鳢等长所导致。可以看出年龄是鱼类OCPs富集的重要因素之一。这与Jenifer的关于鱼类年龄对食物网中有机氯农药富集研究相似[17]。青鱼虽然营养位置和肠道富集来源均略低于鲫鱼,但其富集时间较鲫鱼更长,多种原因综合导致青鱼与鲫鱼OCPs富集差异性不显著。鲫鱼由于其富集时间和营养位置等多重影响导致其在所选鱼种中富集含量最低(图1)。
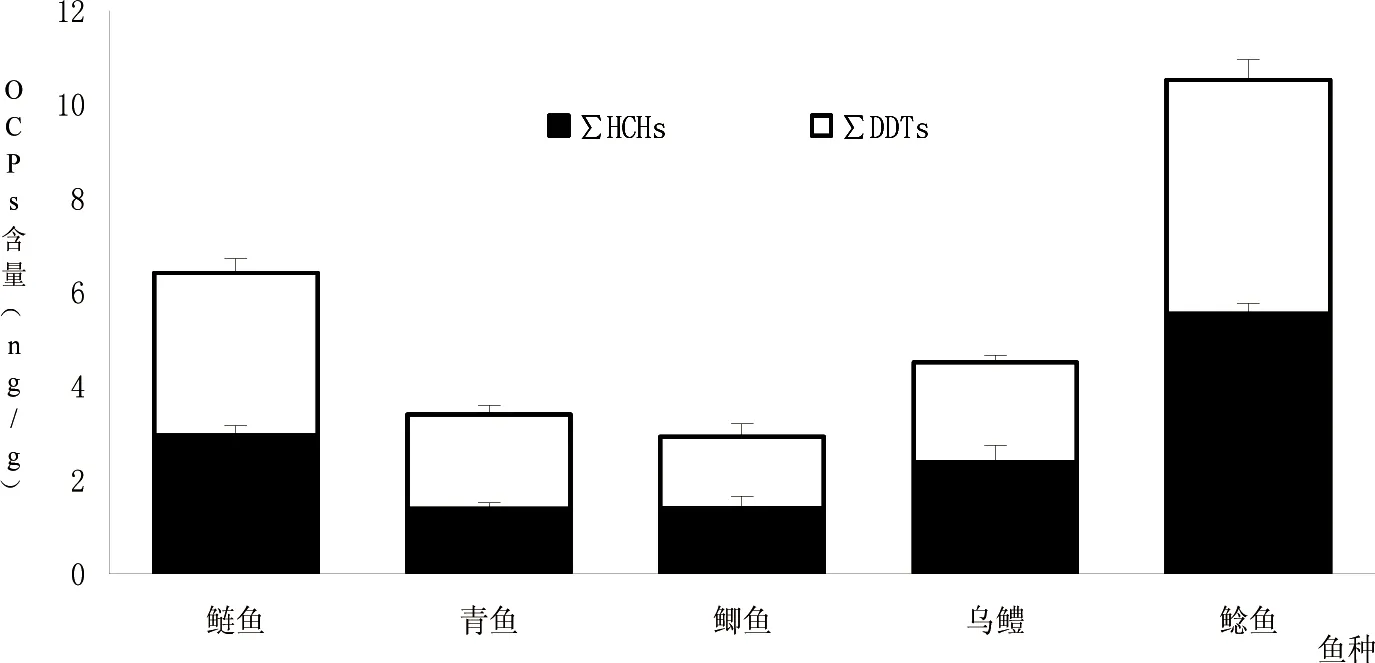
图1 5种巢湖鱼类体内OCPs平均浓度Fig 1 Mean concentration of OCPs in five fishes from Chao Lake
2.2 OCPs在鱼类不同肌肉部位中的分布特征
对鱼类的肌肉部位OCPs含量和差异性进行了分析,肌肉含量结果如图2、3所示,差异性见表2。研究发现5种鱼类4种肌肉间OCPs富集规律存在一定差异性。
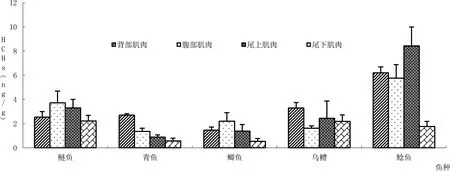
图2 HCHs在5种鱼类不同肌肉部位富集Fig 2 HCHs of different muscle parts from five fish species
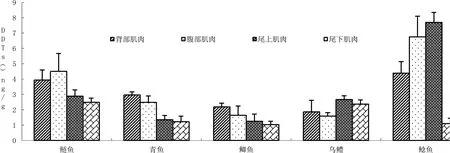
图3 DDTs在5种鱼类不同肌肉部位富集Fig 3 DDTs of different muscle parts from five fish species表2 5种巢湖鱼类不同肌肉间差异性一览表Table 2 Differences between different muscles in five fishes from Chao Lake
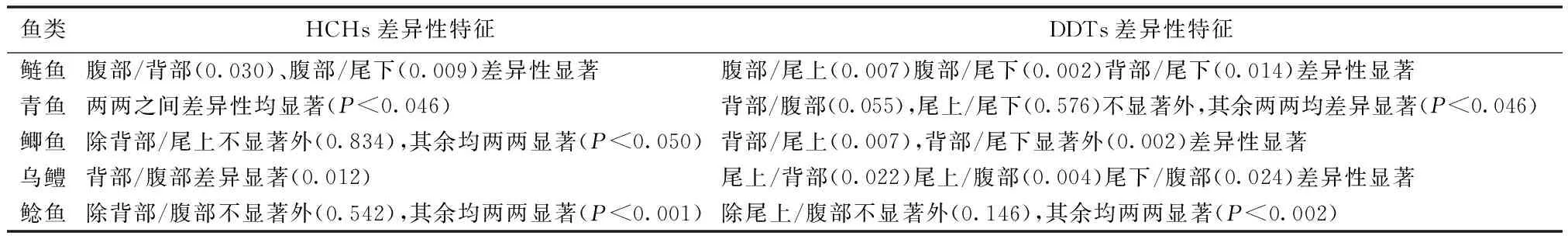
鱼类HCHs差异性特征DDTs差异性特征鲢鱼腹部/背部(0.030)、腹部/尾下(0.009)差异性显著腹部/尾上(0.007)腹部/尾下(0.002)背部/尾下(0.014)差异性显著青鱼两两之间差异性均显著(P<0.046)背部/腹部(0.055),尾上/尾下(0.576)不显著外,其余两两均差异显著(P<0.046)鲫鱼除背部/尾上不显著外(0.834),其余均两两显著(P<0.050)背部/尾上(0.007),背部/尾下显著外(0.002)差异性显著乌鳢背部/腹部差异显著(0.012)尾上/背部(0.022)尾上/腹部(0.004)尾下/腹部(0.024)差异性显著鲶鱼除背部/腹部不显著外(0.542),其余均两两显著(P<0.001)除尾上/腹部不显著外(0.146),其余均两两显著(P<0.002)
腹部/背部描述背部肌肉与腹部肌肉的差异性比较,且前者高于后者,括号中数据为肌肉差异性P值,N=16
鱼类OCPs富集的相关研究中鱼类样品大部分取至于鱼类的背部肌肉,而研究发现5种鱼类中,鲶鱼和乌鳢的尾上肌肉、鲢鱼和鲫鱼的腹部肌肉OCPs含量在其肌肉组织中含量最高,且均显著高于其背部肌肉。由于5种鱼类肌肉部位中存在着一定的差异性,因此背部肌肉并不能完全代表整个鱼体肌肉的富集特征。如果需要整体了解鱼类的肌肉含量特征,鱼类的腹部肌肉和尾上肌肉也应当引起更多的关注。对这些差异性的肌肉部位进行分析,才能更加完善地了解到鱼类的肌肉部位OCPs的富集情况。此外通过对5种鱼类的对比研究发现,5种鱼类的肌肉部位OCPs含量并不存在一致性,即5种鱼类的最高肌肉部位并不统一。由于5种鱼类各肌肉部位存在的差异性及不一致性,我们建议在鱼类肌肉OCPs含量分析时选择各肌肉部位的混合肌肉来进行分析。
2.3 巢湖鱼类风险评价
对因生物食品所引起的人类健康所进行风险评估有很多标准,其中比较常见的有由农粮组织和世界卫生组织(FAO/WHO)所规定的可以被人类所接受的每日摄食量(ADI)。ADI通常是对样品中的有机氯农药的浓度和相关法律规定的浓度范围进行对比。是一种不用考虑居民饮食习惯和消费速率的风险评价分析方法[19]。本研究通过每日摄食量对巢湖地区的鱼类食用有机氯农药风险进行了评估。
我们选择了最新现行有效的食品安全国家标准GB 2763—2014所规定的每日摄食量作为依据,其中六六六和滴滴涕的每日摄食量分别为 0.005 mg/kg·BW和 0.01 mg/kg·BW。张欢等对我国居民的水产品消费水平做了相关统计,预测表明,到2015年,我国城镇居民的人均消费水产品约为38.9 g/d[20]。本研究在对鱼类风险ADI和潜在风险评估时选择人均体重为60 kg,根据张欢等的研究选择人均消费鱼类为38.9 g/d。计算时采用的平均浓度为肌肉组织中有机氯农药的平均值。通过分析发现,巢湖鱼类体内的六六六和滴滴涕估算每日摄食量远低于国标所规定的每日摄食量。详见表3。
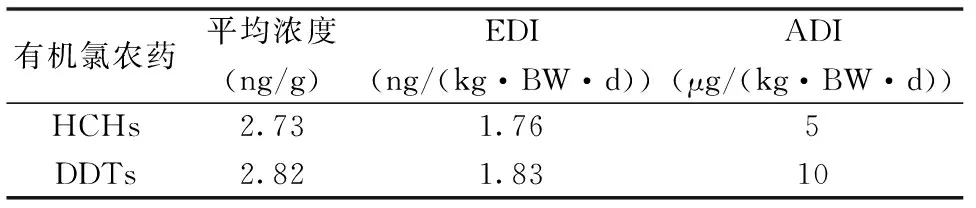
表3 巢湖地区居民摄食鱼类的有机氯农药富集的 估算每日摄食量(EDI)Table 3 The estimated daily food intake of organochlorine pesticide concentration feeding fish from Chao Lake
EDI代表估算的每日摄入量;ADI代表可以被人类所接受的每日摄食量
我们使用的EDI计算方法为:估算的每日摄取量=每日消费量(38.9 g/d)×平均浓度/体重(60 kg)。计算结果表明,摄食巢湖鱼类的有机氯农药富集的估算每日摄食量远低于国标所规定的每日摄食量。因而,在这种消费水平之下,因食用巢湖鱼类产生有机氯农药危害的风险较低。
3 结论
1)巢湖5种经济型鱼类OCPs富集整体上呈现出肉食性鱼类(鲶鱼)>植食性(鲢鱼)>杂食性(青鱼等)的特点。
2)背部肌肉不能完全代表整个鱼体肌肉的富集特征。建议在鱼类肌肉OCPs含量分析时选择各肌肉部位的混合样品来进行分析。
3)摄食巢湖鱼类的有机氯农药富集的估算每日摄食量远低于国标所规定的每日摄食量。食用巢湖鱼类产生有机氯农药危害的风险较低。
[1]张家泉, 祁士华, 邢新丽, 等. 闽江干流沿岸土壤及河口沉积柱中有机氯农药分布特征[J]. 环境科学, 2011, 32(3):673-679.
[2]陈晓娟, 皇甫铮. 持久性有机污染物(POPs)的危害及现状分析[J]. 污染防治技术, 2011, 24(6):17-21.
[3]谢武明, 胡勇有, 刘焕彬, 等. 持久性有机污染物(POPs)的环境问题与研究进展[J]. 中国环境监测, 2004, 20(2):58-61.
[4]李雪梅, 张庆华, 甘一萍, 等. 持久性有机污染物在食物链中积累与放大研究进展[J]. 应用与环境生物学报, 2007, 13(6):901-905.
[5]SOLÉ M, MANZANERA M, BARTOLOMÉ A, et al. Persistent organic pollutants (POPs) in sediments from fishing grounds in the NW Mediterranean: Ecotoxicological implications for the benthic fish Solea sp [J]. Marine Pollution Bulletin, 2013, 67(1/2):158-165.
[6]SHI J, LI Y, LIANG H, et al. OCPs and PCBs in marine edible fish and human health risk assessment in the eastern Guangdong, China[J]. Archives of Environmental Contamination and Toxicology, 2013, 64(4): 632-642.
[7]ZHAO Z, ZHANG L, WU J, et al. Residual levels, tissue distribution and risk assessment of organochlorine pesticides (OCPs) in edible fishes from Taihu Lake, China [J]. Environmental Monitoring and Assessment, 2013, 185 (11):9265-9277.
[8]SHOIFUL A, FUJITA H, WATANABE I, et al. Concentrations of organochlorine pesticides (OCPs) residues in foodstuffs collected from traditional markets in Indonesia [J]. Chemosphere, 2013, 90 (5): 1742-1750.
[9]ZHAO Z, WANG Y, ZHANG L, et al. Bioaccumulation and tissue distribution of organochlorine pesticides (OCPs) in freshwater fishes: a case study performed in Poyang Lake, China′s largest lake [J]. Environmental Science And Pollution Research, 2014, 21 (14) : 8740-8749.
[10]李 荣, 何 力, 王 淼, 等. 气相色谱-电子捕获检测法和气相色谱-质谱法同时测定鱼体内19种有机氯农药[J]. 分析科学学报, 2010, 26(5):497-502.
[11]鲁宝权. 扬州市长江段不同水层中鱼类有机氯农药残留研究[J]. 环境科学与管理, 2010, 35(3):65-67.
[12]杨苏文, 王圣瑞, 闫振广, 等. 四溴双酚A在5种巢湖鱼类体内的组织分布与生物浓缩因子研究[J]. 环境科学, 2012, 33(6):1852-1857.
[13]WANG X H, WANG W X. Uptake, absorption efficiency and elimination of DDT in marine phytoplankton, copepods and fish [J]. Environmental Pollution, 2005, 136(3):453-464.
[14]RANDALL D J,CORNELL D W, YANG R, et al. Concentrations of persistent lipophilic compounds in fish are determined by exchange across the gills, not through the food chain [J].Chemosphere, 1998, 37 (7): 1263-1270.
[15]连子如, 王江涛, 谭丽菊, 等. 青岛近海生物体内多环芳烃、多氯联苯和有机氯农药的含量和分布特征[J]. 生态毒理学报, 2010(5):746-751.
[16]夏重欢. 中国沿海地区海鱼体内持久性有机污染物和痕量元素的污染水平以及对人类健康的风险评估[D].合肥:中国科学技术大学,2011.
[17]MCINTYRE J K, BEAUCHAMP D A. Age and trophic position dominate bioaccumulation of mercury and organochlorines in the food web of Lake Washington [J]. The Science of the Total Environment, 2007, 372(2/3): 571-584.
[18]KIDD K A, BOOTSMA H A, HESSLEIN R H, et al. Biomagnification of DDT through the benthic and pelagic food webs of Lake Malawi, East Africa: importance of trophic level and carbon source [J]. Environ Sci & Technol, 2001, 35(1): 14-20.
[19]DOONG A, PENG C K, SUN Y C, et al. Composition and distribution of organochlorine pesticide residues in surface sediments from the Wu-Shi River estuary, Taiwan [J]. Marine Pollution Bulletin, 2002, 45(1-12): 246-253.
[20]张 欢, 孙 琛. 我国居民水产品消费水平与消费特征分析[J]. 农业现代化研究, 2009, 30(4):430-433.
Distribution features and risk assessment of OCPs in muscle parts of five fishes from Chao Lake
XU Biao1, SUN Bing-hua1, JIANG Shan1, WU Huan-ling1, LI Jin-hua1,2
(1. School of Resources and Environmental Engineering, Anhui University, Hefei 230601;2. School of Life Science, Hefei Normal University, Hefei 230601, China)
In order to understand the tissue accumulation of OCPs in five different diet fishes of Chao Lake, and to probe into the rationality of back muscle sampling method and the organochlorine pesticide risk of Chao Lake, we analyzed the concentrations of HCHs and DDTs in four muscle parts of five fish species from Chao Lake by the following methods of soxhlet extraction, sulfonate degrease, chromatographic column purification, rotary evaporation, nitrogen blow concentration, and analysis by GC/MS. Results showed that the average concentration of OCPs was from 2.929 ng/g to 10.523 ng/g. Specifically, concentrations in different fishes were listed as below: catfish (10.523 ng/g) > chub (6.407 ng/g) > snakeheaded fish (4.514 ng/g) > black carp (3.390 ng/g) > crucian (2.292 ng/g).OCPs in upper tail muscles (from catfish and snakeheaded fish) and belly muscles (from chub and black carp) were both significantly higher than those in back muscles. It was estimated that daily concentrations of HCHs and DDTs from species fish Chao Lake was far lower than daily food intake from national standard. In conclusion, concentrations of OCPs in typical fishes of Chao Lake appeared that carnivore fishes > phytophagous fishes > polyphagia fishes. The accumulation of OCPs in back muscle was just one of the features of OCPs in entire fish muscles.
Chao Lake; fish; OCPs; enrichment; accumulation features
2015-12-09;
2015-12-23
湿地典型持久有机污染物检测(2012YQ22011308)
徐彪,专业方向为环境生态与资源管理,E-mail:365046454@qq.com
李进华,教授,博士生导师,研究方向为动物行为及生态环境,E-mail:jhli@ahu.edu.cn
X592;X820.4
A
2095-1736(2016)05-0019-04
doi∶10.3969/j.issn.2095-1736.2016.05.019
