湿加松组织培养快繁技术的研究
2016-11-08朱尾银
朱尾银
(福建林业科技试验中心,福建漳州363600)
湿加松组织培养快繁技术的研究
朱尾银
(福建林业科技试验中心,福建漳州363600)
以半木质化穗条茎段为外植体,开展湿加松组培快繁关键技术对比试验,探讨不同的外植体消毒方法、培养基类型、植物激素对芽的诱导、增殖、分化和生根的影响。结果表明:灭菌净浸泡8min+75%乙醇消毒10 s+含吐温-20的0.1%HgCl2消毒8min,或灭菌净浸泡8min+75%乙醇消毒15 s+含吐温-20的0.1%HgCl2消毒6 min,消毒效果最佳;改良MS+0.5mg·L-16-BA+0.8mg·L-1ZT+0.3mg·L-1IBA是最优的继代增殖培养基,增殖倍数3.2,基部长出的丛生芽健壮,生长力强。以1/2改良MS为生根培养的基本培养基,添加的生长素浓度组合以0.8mg·L-1IBA+0.1mg·L-1NAA为最佳,生根率可达36.7%。
湿加松;组织培养;基本培养基;激素;生根率
湿加松(Pinus elliottii×Pinus oaribaea)又名湿加杂交松,澳大利亚研究选育出的优良品种,由湿地松与洪都拉斯加勒比松互为父母本的杂交后代[1-3]再经杂交而成的二代杂交品种,综合了双亲的优点,杂种优势极其明显,树形圆满通直,木材纤维长度和基本密度在二个亲本之间,耐水湿能力、抗风与抗病虫害能力强,生长迅速,适应范围广[4-5],产脂量也远远高于亲本和马尾松,是一个速生、丰产、优质的优良树种,极具推广价值[6-7]。湿加松以全新的松属中的一员进入中国的市场,对它的研究较少[8-9]。为保持其优良基因型,湿加松主要采用无性繁殖方式进行种苗生产。组织培养是迅速扩大种苗生产规模的重要途径。目前,湿加松组织培养快繁技术研究取得一定进展,但还存在增殖系数低、胚状体发生频率低、生根困难等问题[10-13],提高了组培苗生产成本,严重限制了组培技术在现阶段的应用[14]。本研究以半木质化穗条茎段为外植体,开展湿加松组培快繁关键技术对比试验,探讨不同的外植体消毒方法、培养基类型、植物激素对芽的诱导、增殖、分化和生根的影响,提高丛生芽的增殖系数、生根率,对完善湿加松组培快繁技术,解决湿加松的种苗规模化生产的瓶颈问题,促进湿加松在林业上的推广应用,具有重要意义。
1 材料与方法
1.1试验材料来源
从福建省林业科技试验中心五板桥试验基地湿加松采穗圃选取生长健壮、无病虫害的嫩芽茎段作为外植体。湿加松采穗圃建于2007年。
1.2材料处理与培养条件
从采穗圃采回的幼嫩枝条,用自来水冲洗15min后用洗衣粉浸泡10min,再用自来水冲洗30min。在超净工作台上切成2.0~2.5 cm长的具潜伏芽的茎段,用无菌水冲洗一次,置工作台上进行不同消毒措施对比试验。继代培养基对比试验、激素浓度和组合对比试验、生长素浓度对比试验均使用诱导的无菌材料进行接种。培养室温度控制在(24±2)℃,光强为2 000~3 000 Lx,光照时间为12 h·d-1。
1.3试验设计
1.3.1外植体消毒方法的筛选
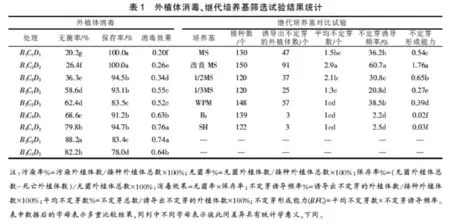
将湿加松中上部幼嫩茎段预处理后进行消毒处理,消毒程序依次为灭菌净浸泡后用无菌水清洗3遍,接着75%乙醇消毒,然后再用含吐温-20的0.1% HgCl2消毒,无菌水洗净后接种。试验采用灭菌净(B)、75%乙醇(C)和含吐温-20的0.1%HgCl2(D)3因子的3个消毒处理的时间梯度的正交L9(34)设计,共计9个组合(见表1),其中消毒时间梯度,B因子为0、5、8min;C因子水平为10、15、20 s;D因子水平为6、7、8 min。消毒完成后按正常接种程序,接种于MS+ZT(0.8mg·L-1)+IBA(0.2mg·L-1)诱导培养基上。每组接种50个,试验重复3次。接种15 d后调查污染率,比较消毒效果,筛选最佳消毒方法。
1.3.2继代培养基的选择
将诱导的无菌材料分别接种于MS、改良MS、0.5MS、0.3MS、WPM、B5、SH培养基,各培养基里均添加ZT0.8 mg·L-1和IBA0.2 mg·L-1植物激素。各培养基同时接种50个,试验重复3次。培养60 d后,观察并记录不定芽形成情况,计算芽的诱导率和芽的形成能力(感染细菌、死亡的接种径段不参与统计)。
1.3.3激素浓度组合的筛选
湿加松增殖培养激素浓度组合的筛选,采用6-BA(0.3、0.5、0.8 mg·L-1)和ZT(0.5、0.8、1.2 mg·L-1)和IBA(0.1、0.2、0.3 mg·L-1)三因素三水平的正交L9(34)设计,共计9个组合,基本培养基为改良MS,每组接种50个,试验重复3次。
1.3.4生根激素浓度的筛选
生根使用常规的IBA和NAA组合,采用随机区组试验设计,A因素为IBA(0.5、0.8、1.0 mg·L-1)和B因素NAA(0.05、0.1、0.2mg·L-1),共9个处理。基本培养基为1/2改良MS,试验重复3次。将湿加松丛生芽中2~3 cm高的芽切割成单株,转入生根培养基中进行不定根诱导,30 d后试验结果调查,筛选最佳生根的激素浓度。
1.4数据处理
用SPSS统计软件进行数据分析。不同外植体消毒方法下的无菌率、存活率情况统计结果和继代培养基筛选试验统计结果见表1,方差分析结果见表2、表3。激素浓度和组合筛选的试验结果见表4,生根激素浓度筛选试验结果见表5。
2 结果与分析
2.1不同消毒方法对湿加松外植体污染的影响
2.1.1无菌率的差异分析
从表1可以看出,不同消毒方法的无菌率差异极大,无菌率最低的是B1C1D1组合,最大的是B3C2D1,两者相差62.0%。表2方差分析结果表明,B因素3水平间、C因素3水平间差异均具有高度统计学意义,D因素3水平间差异具有统计学意义,区组间差异不具有统计学意义。模型误差具有高度统计学意义,B、C、D三因素间存在交互作用,各因素水平间的差异不能真正反映因素的主效,所以进行处理间多重比较,寻求最优水平组合。多重比较结果见表1。从表1可知,除B3C3D2与B3C1D3间、B2C2D3与B2C1D2间差异不具有统计学意义外,其它处理组合间均具有统计学意义。外植体消毒处理后的无菌率表现上,最优水平组合为

表2 外植体消毒试验结果方差分析表
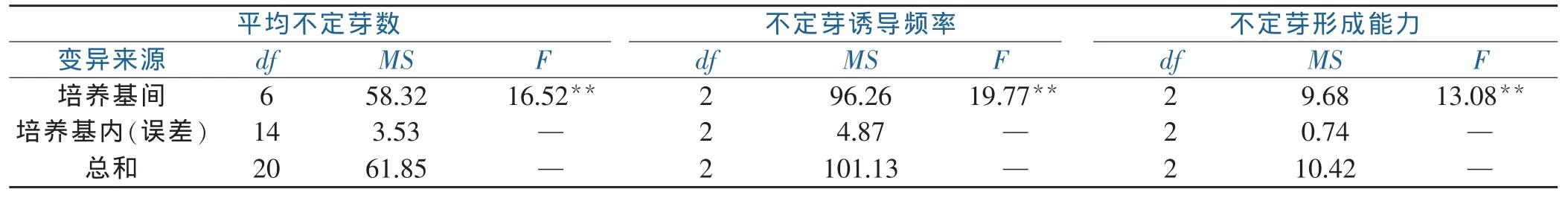
表3 不同基本培养基对比试验结果方差分析
2.1.2保存率差异分析
从表1可以看出,不同消毒方法的保存率差异很大。组合B1C1D1、B1C2D2保存率最高,达到100%,组合B3C3D2的保存率最低,仅为78.0%。表2方差分析结果表明,表2方差分析结果表明,B因素3水平间、C因素3水平间差异均具有高度统计学意义,D因素3水平间差异具有统计学意义,区组间差异不具有统计学意义,模型误差具有高度统计学意义。多重比较结果(表1)表明,B1C1D1、B1C2D2间,B1C3D3、B2C1D2、B2C3D1、B3C1D3间,B2C2D3、B3C2D1间差异不具有统计学意义,其它水平组合间差异具有统计学意义。从保存率上看,最优水平组合为B1C1D1、B1C2D2。
无菌率衡量的是对外植体上的细菌的灭杀效果,无菌率越高,说明灭菌效果越好,但也可能存在灭菌过度,从而杀死外植体。保存率指无感染的外植体中还存活着的外植体的比重,是衡量是否灭菌过度的一个重要指标。保存率低,说明该消毒措施在灭杀细菌的同时,对外植体也产生严重毒害作用。因此,两指标必须综合考虑。
2.1.3消毒效果差异分析
为了准确优选消毒方案,以无菌率与保存率的乘积(即消毒效果)来作为最终选择的指标。从表1消毒效果统计数据可以看出,B3C1D3组合的消毒效果数据最高,达到0.76;B3C2D1组合的消毒效果次之;9个水平组合中,B1C1D1最低,仅为0.2。表2方差分析结果表明,B因素3水平间、C因素3水平间的消毒效果差异均具有高度统计学意义,D因素3水平间差异具有统计学意义,区组间差异不具有统计学意义,模型误差具有高度统计学意义。表1中的多重比较结果表明,除B3C1D3与B3C2D1之间、B3C3D2与B2C3D1之间、B2C1D2与B2C3D1之间差异不具有统计学意义外,其他水平组合间均具有高度统计学意义或具有统计学意义。最优消毒效果的水平组合为B3C1D3、B3C2D1。
2.2湿加松继代培养的基本培养基、激素浓度组合的筛选
2.2.1基本培养基对平均不定芽数和不定芽诱导频率的影响
从表1基本培养基对比试验结果可以看出,不同的基本培养基,在平均不定芽数、不定芽诱导频律上,均存在明显差异,其中,改良MS的平均不定芽数、不定芽诱导频率均最高。接种于B5和SH培养基上的外植体,在相同的条件下几乎不能出芽,外植体生长50 d后,出现发黄、顶端枯萎等现象,逐渐失去生长能力,直至死亡,如图1(a),图1(b)。而接种于其它培养基MS、0.5MS、0.3MS上的外植体虽有新芽长出,但相对于改良MS培养基上的外植体而言,诱导出的腋芽数量较少,同时生长也较慢。

图1 在B5(a)和SH(b)培养基上生长情况
由于平均不定芽数属于计数数据,不定芽诱导频率数据小于70%,均标准化处理后参与方差分析。表3方差分析结果表明,基本培养基间在平均不定芽数、不定芽诱导频率上,差异均具有高度统计学意义。表1多重比较结果表明,在平均不定芽数上,MS、0.3MS间差异不具有统计学意义,0.3MS、WPM、B5、SH间差异不具有统计学意义,其它均具有统计学意义。在不定芽诱导频率上,除0.3MS、B5、SH间不具有统计学意义外,其它均存在具有统计学意义。改良MS培养基,在平均不定芽数、不定芽诱导频率上,均显著优于其它基本培养基。所以,选择改良MS培养基为后续试验的基本培养基。
不定芽形成能力,是不定芽诱导频率与平均不定芽数的乘积,作为筛选基本培养基的重要指标,更具直观性。表3方差分析结果表明,不同的基本培养基间,在不定芽形成能力上,差异具有高度统计学意义。表1中多重比较结果表明,改良MS的不定芽形成能力最好,与其他基本培养基间差异具有统计学意义,进一步验证了改良MS是7种基本培养基中最适合湿加松继代培养的培养基。
2.2.2激素浓度组合对湿加松增殖的影响

图2 处理L5(a)、L7(b)和L9(c)的湿加松生长情况

表4 6-BA和ZT、IBA对湿加松增殖的影响
从表4可以看出,在改良MS中添加不同浓度组合的激素,增殖倍数差异较大,变动浮动为1.5~3.7,方差分析结果(表4)表明,6-BA不同浓度间、ZT不同浓度间的增殖倍数,差异均具有高度统计学意义,因此确定6-BA、ZT浓度,构成最优激素浓度组合,对提高组培效果,降低组培成本,具有重要意义。IBA不同浓度间差异不具有统计学意义。区组间差异不具有统计学意义,而模型误差具有高度统计学意义,说明模型误差主要来源于3种激素在不同浓度水平组合下的交互作用,应以3种激素的浓度水平组合进行多重比较,优选水平组合。多重比较结果见表4。除,L4、L7、L8之间,L1、L2、L3之间不具有统计学意义外,其它激素浓度组合间均具有统计学意义。L9与L8之间不具有统计学意义,增殖倍数最大,丛生芽多,但L9组合的丛生芽老叶容易变黄,芽高生长近乎停滞(见图2C),L8组合的丛生芽卷曲、黄化,均生长状况不正常,显然不是最优组合;L5与L7、L8间增殖倍数不具有统计学意义,但L5的丛生芽从基部长出,芽粗壮,生长力强(图2A),L7却是基部长出紧缩的芽团。其它激素浓度组合的增殖倍数均与L5组合间存在具有统计学意义,且丛生芽生长力不如L5。因此,L5是最优激素浓度组合。
综上所述,改良MS+0.5mg·L-16-BA+0.8mg·L-1ZT+ 0.3mg·L-1IBA是最适合湿加松的继代增殖培养基。

表5 不同生长素浓度对湿加松生根的影响
2.3不同生长素浓度对湿加松生根的影响
由表5可知,以1/2改良MS为基本培养基进行湿加松生根诱导,随着不同浓度的IBA、NAA加入,生根率及根特征有很大差异。为探讨IBA、NAA对生根率的影响,进行双因素方差分析,表5方差分析结果表明,不同的IBA浓度、NAA浓度的生根率差异,均具有高度统计学意义,IBA浓度×NAA浓度交互作用,差异具有统计学意义。在试验设定的9个浓度组合中,F5、F8间生根率差异不具有统计学意义,为生根率最高的浓度组合,与其他浓度组合间均具有统计学意义。F8存在出根不整齐问题,F5出根整齐,根条健壮,所以,F5组合,即0.8 mg·L-1IBA+0.1mg·L-1NAA为本试验最优生长素浓度组合。
3 结论与讨论
湿加松幼嫩茎段为外植体进行的组织培养,最优消毒效果的水平组合为B3C1D3、B3C2D1,即灭菌净浸泡8min后用无菌水清洗3遍,接着75%乙醇消毒10 s,然后再用含吐温-20的0.1%HgCl2消毒8min,最后无菌水清洗干净,或灭菌净浸泡8min后用无菌水清洗3遍,接着75%乙醇消毒15 s,然后再用含吐温-20的0.1%HgCl2消毒6 min,最后无菌水清洗干净。改良MS培养基平均诱导不定芽个数2.9个,不定芽诱导频率达到60.7%,不定芽形成能力为1.76,均具有统计学意义优于其它基本培养基;以改良MA为继代培养的基本培养基时,激素浓度组合以0.5mg·L-16-BA+0.8 mg·L-1ZT+0.3 mg·L-1IBA为最佳,增殖倍数3.2,基部长出的丛生芽健壮,生长力强。以1/2改良MS为生根培养的基本培养基,添加的生长素浓度组合以0.8 mg·L-1IBA+0.1 mg·L-1NAA为最佳,生根率可达36.7%,根条正常、健壮,无愈伤化迹象。
(1)75%酒精配合0.1%升汞是比较常规的灭菌方法。75%酒精具有浸润和灭菌的双重作用,能渗入外植体内杀死病菌,但是对植物组织具毒害作用;0.1% HgCl2对植物组织也具较明显的毒害作用。灭菌净主要成分为三氯异氰脲酸(TCCA),有效氯含量达18%~21%,是一种强力、广谱、高效的杀菌剂。它的使用可以大大减少菌的数量,提高杀菌的效果,对植物组织的破坏性不明显。湿加松幼嫩茎段生长时间短,内生菌少,重点在于灭杀外植体表面细菌。用75%酒精配合0.1%升汞直接消毒,需要处理较长时间才能有效杀灭全部的外植体表面细菌,但同时会导致外植体内有机物溶解过多,部分细胞被毒害,所以即使消毒过关了,芽也难萌发或产生了畸形的芽[15]。从表2可以看出,在无菌率、保存率、消毒效果上,均存在灭菌净F值>75%乙醇F值>0.1%升汞F值,说明在对无菌率、保存率、消毒效果的影响上,灭菌净>75%乙醇>0.1%升汞。本试验结果与马兰珍等[16]杂交松组织培养中外植体的灭菌方法的研究和常金财[18]湿加松无性系组培快繁技术研究结果一致。本试验先用灭菌净浸泡,降低75%乙醇消毒、0.1%HgCl2消毒时间,在达到灭菌效果的同时,较大幅度提高了保存率。
(2)湿加松对大量元素的比例要求比较苛刻,这是造成湿加松组培难的关键性问题。参试的MS、改良MS、0.5MS、0.3MS、WPM、B5、SH等7种培养基中,大量元素含量高的MS不适合,而大量元素比例相同而含量降低的0.5MS和0.3MS,以及木本植物常用的WPM、B5和SH培养基培养效果也不理想。改良MS培养基,突破了常规的MS大量元素比例,获得了相对理想的继代增殖效果。
(3)继代增殖培养中,6-BA(0.5 mg·L-1)+ZT(0.8 mg·L-1)+IBA(0.3mg·L-1)为最佳激素水平。6-BA、ZT对增殖倍数的影响上,不同浓度水平间差异均具有高度统计学意义;F值6-BA(31.77)>ZT(16.02),6-BA不同浓度对增殖倍数的影响大于ZT。IBA浓度对增殖倍数的影响不具有统计学意义,但由于模型误差具有高度统计学意义,存在不同激素间的交互作用。本试验中,交互作用可能存在于6-BA与ZT间,也可能存在于6-BA与IBA间,或ZT与IBA间,以及6-BA、ZT、IBA三者之间,因此,不能因IBA不同浓度水平间增殖倍数不具有统计学意义,忽略对IBA的浓度筛选。本试验首次在湿加松增殖培养中引进了ZT,且发现最合适的浓度水平为0.8 mg·L-1。
(4)NAA、IBA对湿加松有明显的促进生根作用,不同浓度对生根率的影响均具有高度统计学意义。方利娟[17]在NAA对杂交松试管苗伸长生长的影响研究中也发现,过高浓度的NAA则导致产生了大量的愈伤组织。本试验中,当NAA浓度0.2 mg·L-1时,无论IBA浓度多少,均基部发生大量愈伤组织,甚至早期长出的根也完全再次愈伤化,与方利娟的研究结论吻合。试验中IBA的F值(16.65)>NAA的F值(9.47),IBA浓度对生根率的影响大于NAA。NAA、IBA不同浓度间的交互作用明显,两者搭配使用可望获得更好的生根效果。
本试验以湿加松半木质化穗条茎段为外植体,对湿加松的外植体消毒方法、继代增殖培养基筛选,以及生根培养基添加的生长素浓度组合等进行了较为系统的研究,通过方差分析和多重比较,从试验设计中筛选出最优的外植体消毒技术方案、继代增殖培养基和0.5MS生根培养基的生长素浓度组合。经试验优选的湿加松组培技术方案,外植体消毒效果≥0.74,继代培养增殖倍数3.2,达到较为理想水平,但生根培养中生根率较低,仅36.7%,有待于进一步优化。
[1]何克军.澳大利亚昆士兰州松树杂交育种和造林[J].广东林业科技,1996,12(3):34-38.
[2]黄永利,陈寿莲,杨章旗.巴哈马加勒比松种源试验研究[J].贵州林业科技,1998,26(4):43-47.
[3]黄永李,杨章旗.洪都拉斯加勒比松种源试验研究[J].广西科学院学报,2000,16(2):87-91.
[4]黄永权,赵奋成.广东湿加松良种选育现状及发展对策[J].福建林业科技,2007,(1):159-162.
[5]黄永李,杨章旗.洪都拉斯加勒比松种源试验研究[J].广西科学院学报,2000,16(2):87-91.
[6]黄永权,赵奋成.广东湿加松良种选育现状及发展对策[J].福建林业科技,2007,(1):159-162.
[7]林能庆.湿地松加勒比松杂交组合引种试验研究[J].福建林业科技,2005,32(2):35-38.
[8]成小龙,花小梅,李文钿.马尾松离体培养条件下的微繁殖和菌根的形成[J].林业科学研究,1995,8(3):241-246.
[9]曹孜义,刘国民.实用植物组织培养技术教程[M].甘肃:甘肃科学技术出版社,2002.
[10]黄健秋,卫志明.松属树种的组织培养和原生质体培养[J].植物学通报,1994,11(1):34-42.
[11]李科友,唐德瑞,朱海兰,等.美国黄松组织培养不定根诱导的研究[J].西北植物学报,2003,23(3):464-467.
[12]刑世岩.松属树种细胞、组织和器官培养名录[J].植物生理学通讯,1990(1):75-79.
[13]李正理,张新英.红松后胚离体培养的研究I不同培养方式下幼苗生长的比较观察[J].植物学报,1962,10(2):103-112.
[14]李林.白皮松和美国黄松组织培养及快繁技术研究[D].咸阳:西北农林科技大学,2004.
[15]王利民,周毅,陈龙友,等.植物组织培养中消毒剂的运用[J].贵州师范大学学报(自然科学版),2002,20(1):15-17.
[16]马兰珍,韦立秀,薛鹰,等.杂交松组织培养中外植体的灭菌方法[J].广西科学院学报,2005,21(1):37-39.
[17]方利娟.NAA对杂交松试管苗伸长生长的影响[J].百色学院学报,2008,21(3):71-73.
[18]常金财.湿加松无性系组培快繁技术研究[D].呼和浩特:内蒙古农业大学,2010.
(责任编辑:叶丽娜)
Study on Tissue Culture of Pinus elliottii×Pinus caribaea
ZHUWeiyin
(Fujian Forestry Science and Technology Test Center,Zhangzhou,Fujian 363600)
The best explantmaterial is the scion bud stem of half lignification,key technology was developed contrast for tissue culture of Pinus elliottii×Pinus caribaea.Through the different experiment of disifection method,medium type,plant hormone on the induction,proliferation,differentiation and rooting of shoots were studied with semi wood of scion stem segment explants of Pinus elliottii×Pinus caribaea.The results showed that the optimal disinfection method was 8 min for sterilizing net,10 s for 75%alcohol and 8 min for 0.1% HgCl2,or 8 min for sterilizing net,15 s for 75%alcohol and 6min for 0.1%HgCl2.Adventitious buds grew fast and proliferation multiple reached 3.2,when grown in themodified MS adding 0.5 mg·L-16-BA,0.8 mg·L-1ZT and 0.3 mg·L-1IBA.With 1/2 the modified MS added 0.8mg·L-1IBA and 0.1mg·L-1NAA,the rooting effectwas the best,and the rooting ratewas 36.7%.
Pinus elliottii×Pinus caribaea;tissue culture;basicmedium;hormone;rooting rate
S722.347
A
1674-2109(2016)06-0014-07
2016-04-13
朱尾银(1979-),女,汉族,工程师,主要从事林木和花卉组培研究。
