酵母细胞壁中β-葡聚糖在水产养殖中的研究进展
2016-11-08易建华杨凡聂琴戴晋军胡骏鹏
易建华,杨凡,聂琴,戴晋军,胡骏鹏
(安琪酵母股份有限公司,湖北宜昌443003)
酵母细胞壁中β-葡聚糖在水产养殖中的研究进展
易建华,杨凡,聂琴,戴晋军,胡骏鹏
(安琪酵母股份有限公司,湖北宜昌443003)

酵母细胞壁中β-葡聚糖已广泛应用于各种水产饲料,能提高水产动物的免疫力,减少应激反应。本文综述了酵母细胞壁中β-葡聚糖的作用机理及其在水产动物上应用效果。
酵母细胞壁;β-葡聚糖;水产动物
控制鱼病的方法主要有三种,分别为化学药物疗法、疫苗接种和使用免疫增强剂。化学药物治疗虽然是鱼病的主要防治方法,但化学试剂和抗生素的大量使用往往导致药物残留和耐药性的产生,污染水环境,并对人类健康造成潜在威胁。疫苗接种是控制鱼病的最直接有效的方法,但由于免疫反应的特异性,一种疫苗只能特异性地预防相应的某种疾病,所以实际作用也非常有限。使用免疫增强剂是近几年新兴的增强免疫力的方法,其具有性能多样、资源丰富、天然、抗药性不显著、毒副作用小、可降解等优点。
酵母细胞壁中β-葡聚糖是目前研究和应用最多的免疫增强剂之一,它能提高动物自身免疫力,增强自身对细菌、真菌、病毒及寄生虫的抵抗力,减少不良应激,提高动物的生产性能。酵母细胞壁在水产动物中的使用具有安全、高效、低毒、无残留、无耐药性、低成本等优点,因此对水产养殖业的健康发展具有重大意义。
1 酵母细胞壁中β-葡聚糖的作用及机理
酵母细胞壁中β-葡聚糖是一种具有特殊结构的多糖,通常由10~20个单糖组成,分子量约为6500~7500,大多数为水不溶性或胶质颗粒。酵母细胞壁中β-葡聚糖的单糖之间以β-1,3键和β-1,6键相连。由于特殊的键结方式和分子氢键的存在,β-葡聚糖呈螺旋形分子结构,其特殊的构型对动物的免疫系统具有较强的刺激作用。
β-葡聚糖能直接与单核细胞、巨噬细胞、中性粒细胞、自然杀伤细胞(NK)的表面特定受体(SR、TLRs、Dectin-1、CR3)结合,并激活巨噬细胞的吞噬作用,释放特定的细胞因子(IL-1、IL-6、GMCSF、干扰素)以及抗体,这些细胞因子能刺激新的白细胞的形成,从而诱导机体产生一系列的细胞免疫和体液免疫反应,增强机体非特异性免疫力。此外,酵母细胞壁多糖可通过补体系统的替代途径,激活C3、C4等补体活性,从而使机体产生一系列的炎症应答或免疫黏附反应。与鱼类不同的是,在甲壳类和贝类的血清中存在能与β-葡聚糖结合的受体——β-葡聚糖结合蛋白,二者结合后能促进淋巴颗粒细胞释放丝氨酸,丝氨酸又可以激活酚氧化酶系统,并将酚氧化酶原(proPO)氧化成酚氧化酶,酚氧化酶能将酚氧化成醌,并最终在体内合成黑色素,醌与黑色素等活性物质均可直接参与甲壳动物和贝类一系列免疫防御反应。
2 β-葡聚糖在水产养殖中的应用
β-葡聚糖在水产养殖中的应用较为广泛,其中酵母源的β-葡聚糖报道最多。研究表明,来自于酵母细胞壁的β-葡聚糖不仅能提高机体的免疫能力,还能改善水生动物的生长性能。
2.1增强免疫力关于β-葡聚糖的研究报道大部分集中在对其免疫功能的探讨。β-葡聚糖提高水生动物的免疫功能主要通过以下几个途径实现。
2.1.1提高水生动物溶菌酶活性溶菌酶是一类成抗生性物质的水解酶,主要分布在血清、黏液、巨噬细胞和单核细胞的胞质中。溶菌酶能破坏细菌细胞壁黏肽中N-乙酰胞壁酸和N-乙酰氨基葡萄糖间的1,4-糖苷键,因此能溶解革兰氏阳性菌,与补体结合后可以溶解部分革兰氏阴性菌。目前研究表明,β-葡聚糖可提高多数鱼类的溶菌酶活性,如南亚野鲮(Misra等,2006)、大黄鱼(Ai等,2007)、石斑鱼(Bagni等,2005)等,但对部分鱼类(Sealey等,2008)的溶菌酶活性影响不大,可能与添加剂量和方式有关(表1)。
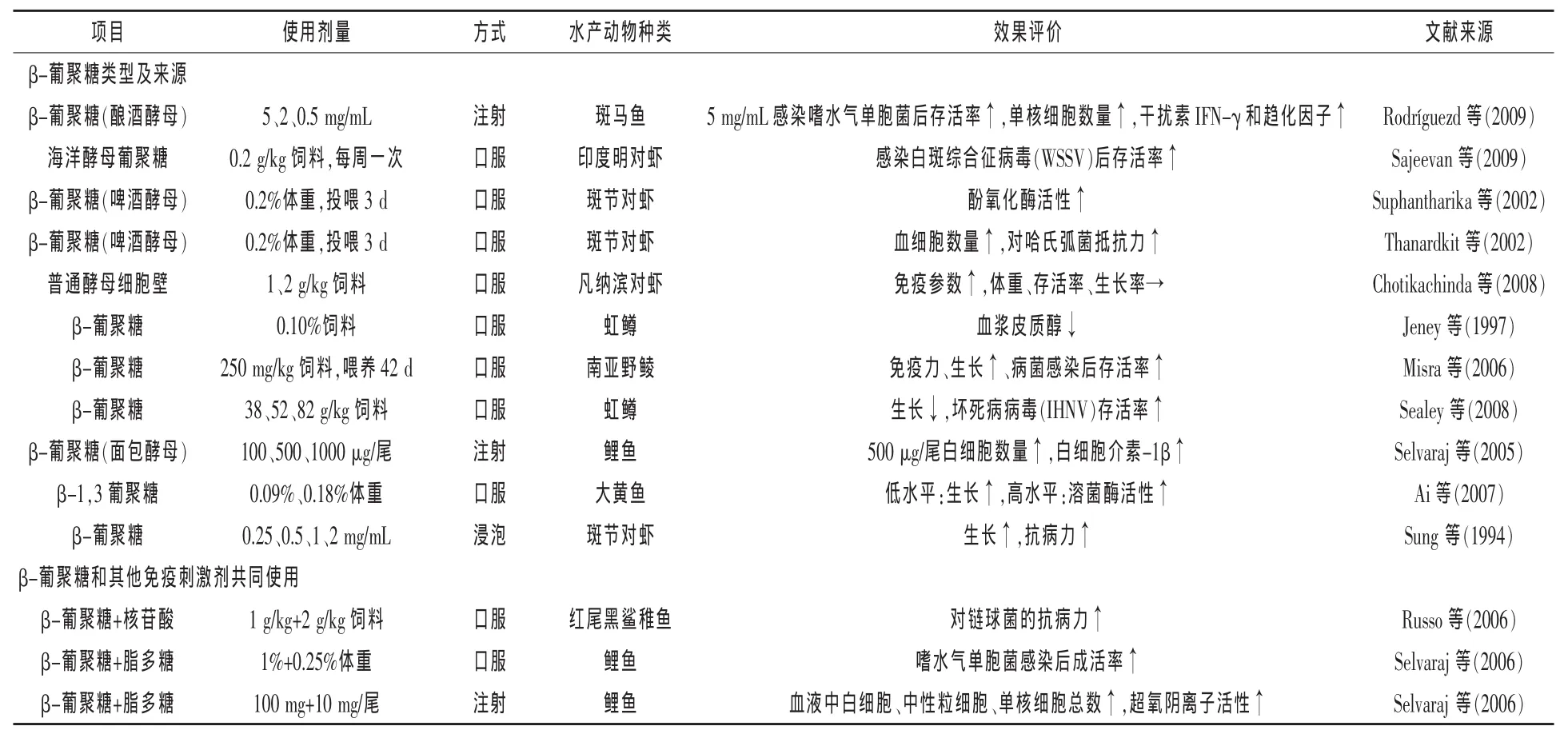
表1 β-葡聚糖在水产养殖中的应用剂量及效果
2.1.2激活补体活性补体是一类具有酶活性的球蛋白,C3是补体系统的主要成分,可以通过经典或旁路途径激活。对南亚野鲮多重注射(间隔2周1次,重复4次)β-葡聚糖的研究发现,在第一次和第二次注射后的补体活性明显增加,且注射浓度为10 mg/kg时第二次注射补体活性最高(Misra等,2006)。在石斑鱼的研究中也发现β-葡聚糖投喂组血清中的补体活性要明显高于对照组(Bagni等,2005)。
2.1.3激活吞噬细胞的吞噬活性吞噬细胞表面含多个β-葡聚糖受体(SR、TLRs、Dectin-1、CR3)能与β-葡聚糖结合而激活吞噬细胞的吞噬活性。研究表明,β-葡聚糖可以提高吞噬细胞的吞噬率和吞噬指数。用浓度10 mg/kg的β-葡聚糖多重注射南亚野鲮的研究发现,处理组吞噬细胞的吞噬率明显提高(P<0.05)(Misra等,2006)。用不同浓度(0、0.09%、0.18%)β-葡聚糖饲喂大黄鱼时发现,0.09%处理组的吞噬率要显著高于对照组(Ai等,2007)。亚洲鲶鱼饲喂含β-葡聚糖的饲料时,吞噬细胞的吞噬率和吞噬指数均显著增加(Kumari和Sahoo,2006)。
2.1.4提高吞噬细胞呼吸爆发活力吞噬细胞呼吸爆发活力是先天性免疫的重要组成部分,过程中产生活性氧O2-能杀死入侵的微生物。研究报道β-葡聚糖能促进南亚野鲮(Misra等,2006)、大黄鱼、鲤鱼和亚洲鲶鱼吞噬细胞O2-的产生。用浓度10 mg/kg的β-葡聚糖多重注射南亚野鲮能显著提高O2-的产生。不同浓度的β-葡聚糖(0、100、500、1000 μg/尾)腹腔注射鲤鱼时,处理组O2-的产生明显高于对照组,而500和1000 μg/尾的处理组要显著高于100 μg/尾的剂量(Selvaraj等,2006)。
2.1.5提高抗体水平和抗病能力抗体是体液中特异的免疫因子,是机体受外源性物质刺激后产生的特异性结合蛋白。β-葡聚糖能提高水生动物的抗体水平已在多个研究中得到证实。Misra等(2006)在南亚野鲮的研究发现,注射适量的β-葡聚糖能提高南亚野鲮对爱德华氏菌和嗜水气单胞菌的抗体效价。饲喂β-葡聚糖的虹鳟在感染坏死病病毒后有较高的成活率,表明β-葡聚糖在一定程度上能提高虹鳟的抗病能力(Sealey等,2008)。
2.1.6提高甲壳动物血清中酚氧化物酶活性研究证实,β-葡聚糖能结合甲壳动物血清中受体——β-葡聚糖结合蛋白,激活酚氧化物酶原。Chang等(2003)的研究发现,攻毒前饲喂斑节对虾一定量的β-葡聚糖能提高酚氧化物酶的活性,并有助于攻毒后酚氧化物酶的活性的恢复。许国焕等用2 g/kg的β-葡聚糖的饲料饲喂南美白对虾可以明显提高酚氧化物酶活性。
2.2改善生长性能研究表明,β-葡聚糖在促进鱼类生长、提高饲料转化率上有一定作用。在红鲷上的研究发现,饲料中添加一定量的β-葡聚糖能促进红鲷的生长(Cook等,2003)。同样的现象在南亚野鲮(Misra等,2006)、大黄鱼(Ai等,2007)、花鲈(吴春玉等,2013)、暗纹东方鲀(王永宏,2013)、赤鳍笛鲷(Cook等,2003)、鲤鱼(Kühlwein等,2014)、秘鲁笛鲷(Navarrete和Tovar-Ramírez,2014)均有发现。在虾料中添加β-葡聚糖同样对虾类的生长也有一定的促进作用。研究发现,饲料中添加β-葡聚糖对南美白对虾具有促进生长的作用并且能够降低饲料系数(陈云波等,2002);日粮中添加β-葡聚糖也能显著影响凡纳滨对虾的生长和成活率(杨福刚等,2005)。宋理平等(2005)研究表明,在日粮中同时添加维生素C和β-葡聚糖能够显著促进中国明对虾的生长,且高于只添加维生素C的试验组。但部分研究表明,β-葡聚糖对水生动物的促生长作用不太明显(Sealey等,2008),且β-葡聚糖促生长的机制尚不明确,可能与剂量和效应时间有关,有待进一步研究。
2.3β-葡聚糖的添加剂量和方式β-葡聚糖作为免疫刺激剂其剂量对水生动物的免疫反应有重要影响。合适的剂量和添加方式能使水生动物达到最佳的免疫效果(Meena等,2013)。将每100 g含0.5 g β-1,3/1,6-葡聚糖的饲料投喂虹鳟1周,然后用耶尔森氏鼠疫杆菌疫苗浸泡免疫,结果发现血清中特异性抗体分泌细胞(ASC)的数量和Ig水平增加,因此β-1,3/1,6-葡聚糖可以增加耶尔森氏鼠疫杆菌疫苗的免疫效力(Siwicki等,2004)。然而,饲喂虹鳟含0.1%β-葡聚糖的饲料4周,经2 h的运输应激后,处理组的非特异性免疫反应(吞噬作用和氧化自由基的产生)得到提高,并能减缓运输应激带来的负面影响,增强对柱状屈挠杆菌的抵抗力,饲喂含0.1%β-葡聚糖饲料的处理组在运输应激下的皮质醇和血糖含量均为最低的(Jeney等,1997)。在南亚野鲮上的研究发现,250 mg/kg的β-葡聚糖添加量是最佳的,其免疫参数(白细胞总数、吞噬率、吞噬细胞指数、溶菌酶活性、补体活性和血清杀菌活性)在投喂42 d时上升至最高(Misra等,2006)。
不同添加方式(腹腔注射、浸泡、口服)的效果在不同的鱼类是不一样。在对嗜水气单胞菌感染鲤鱼的研究中发现,腹腔注射不同浓度的β-葡聚糖和脂多糖(LPS)后的相对成活率均为100%,口服方式下高浓度组(1%β-葡聚糖+LPS)有较高的相对成活率,而浸泡对相对成活率无改善作用。但剂量和添加方式对白细胞介素-1β的mRNA表达和补体活性均无显著影响(Selvaraj等,2006)。面包酵母细胞壁β-葡聚糖也使用上述三种添加方式,按照每尾100、500、1000 μg的浓度饲喂鲤鱼,结果发现,每尾腹腔注射500 μg能提高相对成活率,而浸泡和口服方式对相对成活率无影响;处理7 d后三种β-葡聚糖浓度均能增加白细胞、中性粒细胞和单核细胞数量,提高白细胞介素-1β的mRNA表达(Selvaraj等,2005)。被免疫和未被免疫的尼罗罗非鱼饲喂不同浓度的β-葡聚糖(0、50、100、200 mg/kg饲料)14周,发现β-葡聚糖免疫与否以及二者组合均对生长和成活率无影响,但是100、200 mg/kg的β-葡聚糖浓度组的饲料转化率均要低于50 mg/kg β-葡聚糖浓度组(Whittington等,2005)。
3 β-葡聚糖在水产养殖中的应用及研究前景
在水产饲料中适量地添加酵母源的β-葡聚糖可以提高水产动物的机体免疫力,增强水产动物在不良环境下的应激反应,减少疾病的发生率,从而为水产动物的健康养殖提供保障。酵母细胞壁的β-葡聚糖作用机理在不同养殖环境中和水产养殖品种上有所不同,一些深层次的问题还没有研究清楚,但其应用范围和效果已得到广泛证实。β-葡聚糖是酵母细胞壁多糖的主要功能性成分之一,其有效含量与生物学功能与酵母菌种来源、培养条件及酵母细胞壁的加工工艺均密切相关。相信在未来新型免疫增强剂的开发过程中,随着酵母细胞壁的深加工工艺的不断改进,酵母源β-葡聚糖将有更深入的研究和更广阔的应用前景。
[1]陈云波,周洪琪.饲料中添加β-葡聚糖对南美白对虾的生长,存活及饲料系数的影响[J].淡水渔业,2002,32(5):55~56.
[2]宋理平,黄旭雄,周洪琪,等.Vc,β-葡聚糖和藻粉对中国对虾幼虾生长,成活率及免疫酶活性的影响[J].上海水产大学学报,2005,14(3):276~281.
[3]王永宏.B-葡聚糖对暗纹东方鲀非特异性免疫及生长性能的影响[D].华东师范大学.2013.
[4]吴春玉,曹俊明,黄燕华,等.饲料中添加,β-葡聚糖对花鲈生长性能,体成分,血清生化指标和抗氨氮应激能力的影响[J].动物营养学报,2013,25(12):3033~3040.
[5]许国焕,梁友光,吴月嫦,等.酵母葡聚糖对南美白对虾免疫功能的影响[J].饲料工业,2003,24(10):53~54.
[6]杨福刚,周洪琪,黄旭雄.不同β-葡聚糖对凡纳滨对虾稚虾生长及非特异免疫功能的影响[J].上海水产大学学报,2005,14(3):263~269.
[7]Ai Q,Mai K,Zhang L,et al.Effects of dietary β-1,3 glucan on innate immune response of large yellow croaker,pseudosciaena crocea[J].Fish&shellfish immunology,2007,22(4):394~402.
[8]Bagni M,Romano N,Finoia M,et al.Short-and long-term effects of a dietary yeast β-glucan(macrogard)and alginic acid(ergosan)preparation on immune response in sea bass(dicentrarchus labrax)[J].Fish&shellfish immunology,2005,18(4):311~325.
[9]Chang C-F,Su M-S,Chen H-Y,et al.Dietary β-1,3-glucan effectively improves immunity and survival of penaeus monodon challenged with white spot syndrome virus[J].Fish&shellfish immunology,2003,15(4):297~310.
[10]Chotikachinda R,Lapjatupon W,Chaisilapasung S,et al.Effect of inactive yeast cell wall on growth performance,survival rate and immune parameters in pacific white shrimp(litopenaeus vannamei)[J].Sonklanakarin Journal of Science and Technology,2008,30(6):687.
[11]Cook M T,Hayball P J,Hutchinson W,et al.Administration of a commercial immunostimulant preparation,ecoactivaTMas a feed supplement enhances macrophage respiratory burst and the growth rate of snapper(pagrus auratus,sparidae(bloch and schneider))in winter[J].Fish&shellfish immunology,2003,14(4):333~345.
[12]Jeney G,Galeotti M,Volpatti D,et al.Prevention of stress in rainbow trout(oncorhynchus mykiss)fed diets containing different doses of glucan[J]. Aquaculture,1997,154(1):1~15.
[13]Kühlwein H,Merrifield D,Rawling M,et al.Effects of dietary β-(1,3)(1,6)-d-glucan supplementation on growth performance,intestinal morphology and haemato-immunological profile of mirror carp(cyprinus carpio l.)[J].Journal of animal physiology and animal nutrition,2014,98(2):279~289.
[14]Kumari J,Sahoo P.Non-specific immune response of healthy and immunocompromised asian catfish(clarias batrachus)to several immunostimulants[J].Aquaculture,2006,255(1):133~141.
[15]Meena D,Das P,Kumar S,et al.Beta-glucan:An ideal immunostimulant in aquaculture(a review)[J].Fish Physiology and Biochemistry,2013,39(3):431~457.
[16]Misra C K,Das B K,Mukherjee S C,et al.Effect of long term administration of dietary β-glucan on immunity,growth and survival of labeo rohita fingerlings[J].Aquaculture,2006,255(1):82~94.
[17]Navarrete P,Tovar-Ramírez D.Use of yeasts as probiotics in fish aquaculture[J].2014.
[18]Rodríguez I,Chamorro R,Novoa B,et al.B-glucan administration enhances disease resistance and some innate immune responses in zebrafish(danio rerio)[J].Fish&shellfish immunology,2009,27(2):369~373.
[19]Russo R,Yanong R P,Mitchell H.Dietary beta-glucans and nucleotides enhance resistance of red-tail black shark(epalzeorhynchos bicolor,fam. Cyprinidae)to streptococcus iniae infection[J].Journal of the world aquaculture society,2006,37(3):298~306.
[20]Sajeevan T,Philip R,Bright Singh I.Dose/frequency:A critical factor in the administration of glucan as immunostimulant to indian white shrimp fenneropenaeus indicus[J].Aquaculture,2009,287(3):248~252.
[21]Sealey W,Barrows F,Hang A,et al.Evaluation of the ability of barley genotypes containing different amounts of β-glucan to alter growth and disease resistance of rainbow trout oncorhynchus mykiss[J].Animal feed science and technology,2008,141(1):115~128.
[22]Selvaraj V,Sampath K,Sekar V.Adjuvant and immunostimulatory effects of β-glucan administration in combination with lipopolysaccharide enhances survival and some immune parameters in carp challenged with aeromonas hydrophila[J].Veterinary immunology and immunopathology,2006,114(1):15~24.
[23]Selvaraj V,Sampath K,Sekar V.Administration of yeast glucan enhances survival and some non-specific and specific immune parameters in carp(cyprinus carpio)infected with aeromonas hydrophila[J].Fish&shellfish immunology,2005,19(4):293~306.
[24]Siwicki a K,Glabski E,Terech-Majewska E,et al.The effect of beta-1.3/1.6-glucan in diets on the effectiveness of anti-yersinia ruckeri vaccinean experimental study in rainbow trout(oncorhynchus mykiss)[J].Polish journal of food and nutrition sciences,2004,13(2):59~61.
[25]Sung H,Kou G,Song Y.Vibriosis resistance induced by glucan treatment in tiger shrimp(penaeus-monodon)[J].1994.
[26]Thanardkit P,Khunrae P,Suphantharika M,et al.Glucan from spent brewer's yeast:Preparation,analysis and use as a potential immunostimulant in shrimp feed[J].World Journal of Microbiology and Biotechnology,2002,18(6):527~539.
[27]Whittington R,Lim C,Klesius P H.Effect of dietary β-glucan levels on the growth response and efficacy of streptococcus iniae vaccine in nile tilapia,oreochromis niloticus[J].Aquaculture,2005,248(1):217~225.■
The β-glucan of yeast cell wall was widely used in a variety of aquatic feed,which can improve immunity of aquatic animals,reduce the stress response to a hostile environment.This paper reviewed the mechanism and application of β-glucan of yeast cell wall in aquaculture.
yeast cell wall;β-glucan;aquatic animal
10.15906/j.cnki.cn11-2975/s.20161410
S816.7
A
1004-3314(2016)14-0041-04
