浓缩果汁中耐热霉菌的分析及鉴定
2016-11-07黄庭轩周帼萍
童 迅,高 雯,黄庭轩,周帼萍
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
浓缩果汁中耐热霉菌的分析及鉴定
童迅,高雯,黄庭轩,周帼萍*
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
目的:检测15 个批次浓缩果汁中的耐热霉菌并对其进行鉴定。方法:80 ℃、30 min热处理后涂布平板菌落计数法分离和计数浓缩果汁中的耐热霉菌,分离纯化后观察其显微形态和菌落形态,再采用28S rDNA序列分析鉴定霉菌的种属。结果:这15 批次浓缩果汁中有8 个样品检出耐热霉菌,检出率达53.3%;检出的耐热霉菌以正青霉(Eupenicillium)和篮状菌(Talaromyces)为主,还有少量白耙齿菌、栓菌和座囊菌属。结论:进口或国产浓缩果汁都存在耐热霉菌污染,其中尤其值得注意的是检出了既耐热又能产生真菌毒素的正青霉和篮状菌。
浓缩果汁;耐热霉菌;检测与鉴定;正青霉;篮状菌
果汁富含多种营养素,是健康食品,广受人们的青睐[1]。由于果汁的pH值很低,多数在2.4~4.2之间,属于高酸性饮料;此外果汁中富含糖分,这种高渗条件对很多微生物有抑制作用,因而能在果汁中生长繁殖的只有一些酵母、霉菌和极少数的细菌[2]。
为保持营养,果汁饮料一般是采用巴氏杀菌工艺采用80~90 ℃时间为15 s到数分钟[3-4],杀菌后发生浑浊变质多数是由耐热霉菌造成。所谓的耐热霉菌一般是指能够耐受75 ℃、30 min或更高温度及更长时间的霉菌。真菌能够耐受这样高温是因为具有特殊构造,包括子囊孢子、某些厚垣孢子、厚壁菌丝或菌核。近些年来由这些耐热真菌引起的食品变质事件越来越多,多变拟青霉(Paecilomycesvariotii)、尖孢镰刀菌(Fusarium oxysporum)、丝衣霉(Byssochlamysfulva和B. nivea)、篮状菌(Talaromyces trachyspermus)、新萨托菌(Neosartorya)和布氏正青霉(Eupenicillium brefeldianum)在巴氏杀菌果汁,乳制品和软饮料中经常有检出[5]。
这些耐热真菌能产生多种有毒的次生代谢产物,如:丝衣霉毒素A、丝衣霉酸、致癌物、棒曲霉素、震颤素、烟曲霉震颤素A/C、疣孢青霉原及Fischerin[5]。我国目前对耐热霉菌的检测等研究偏少[6-10],但是已经有不少关于耐热真菌毒素的检测方法研究[11-17]。
本研究分析了某企业提供的15 批次浓缩果汁中耐热霉菌的含菌量,对这些分离株进行分析和鉴定,以分析耐热霉菌在浓缩果汁中的潜在危害,并制定适合企业的耐热霉菌检测方法和技术。
1 材料与方法
1.1材料与试剂
样品某饮料厂提供的15 份浓缩果汁样品,详见表1。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、麦芽汁肉汤(malt extract broth,MEB)培养基北京陆桥技术责任有限公司。
Premix Taq(TaKaRaTaq Version2.0 plus dye) 日本TaKaRa公司;Ezup柱式基因组DNA(真菌)抽提试剂盒生工生物工程(上海)公司。
1.2仪器与设备
Thermal Cycler T100型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;DYY-6C型稳压电泳仪 北京市六一仪器厂;Centeifuge 5424R型高速离心机 德国Eppendorf公司;GeneGenius全自动凝胶成像系统 美国Syngene公司;Eclipse 80i显微镜日本Nikon公司。
1.3方法
1.3.1样品中微生物的检测与计数
采用稀释涂布平板法进行样品中真菌的检测与计数。在超净工作台中取样品果汁25 mL于已灭菌的蓝盖瓶中,振荡后80 ℃水浴30 min,取1 mL涂布于PDA平板(直径120 mm)上,每个样做两个平行,再采用parafi lm封口的方法封口,于28 ℃培养14~21 d,每7 d观察计数1 次,同时,根据菌落的形状、大小和颜色等外观特征,挑取单菌落进行分离和纯化。计数(CFU)取2 个平行实验的平均值。
1.3.2菌落形态和显微形态观察[18]
在28 ℃恒温培养期间每7 d观察并记录1 次培养皿中霉菌生长情况及菌落形态,同时挑取单菌落,对单菌落进行小培养,在Eclipse 80i尼康显微镜系统下进行显微观察并拍照记录。
1.3.328S rDNA序列分析[6,19-20]
引物:采用约600 bp的28S rDNA基因片段的扩增引物NL-1 GCATCGATGAAGAACGCAGC和NL-4 GGTCCGT GTTTCAAGACGG。
DNA模板的制备:从PDA平板上挑取菌种到MEB液体培养基中振荡培养24~72 h获取足量菌丝球,采用液氮研磨法获取粗DNA样品,再用Ezup柱式基因组DNA(真菌)抽提试剂盒纯化DNA模板。
PCR体系和条件:50 μL PCR体系:Taq酶0.5 μL;10×PCR Buffer 8 μL;2.5 mmol/L的d NTP 4 μL;2 个10 mmol/L引物各2 μL;DNA模板10 μL;无菌MiliQ水23.5 μL。PCR条件:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火60 s(NL1-NL4),72 ℃延伸2 min,循环35 次;72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳分离,GoldView(GV)染色,凝胶成像分析仪观察PCR扩增结果。
PCR产物测序及序列比对:PCR产物,送苏州金唯智生物科技有限公司测序。在http://www.ncbi.nlm.nih. gov/上通过BLASTN比对。
2 结果与分析
2.1污染菌菌落及显微形态分析

图1 M-6正青霉的形态Fig.1 Morphology of E. crustaceum M-6
由图1A可见,M-6正青霉菌落在PDA上28 ℃培养10 d,直径40~50 mm,中心稍凹陷,有少量皱纹;质地絮状兼绒状,近于灰绿色,渗出液黄色。由图1B可见,呈扫帚状,帚状枝不规则;分生孢子梗发生于表面菌丝,孢子梗较短,具有三轮分生孢子梗;孢子链长且排列紧密,分生孢子呈椭球形。
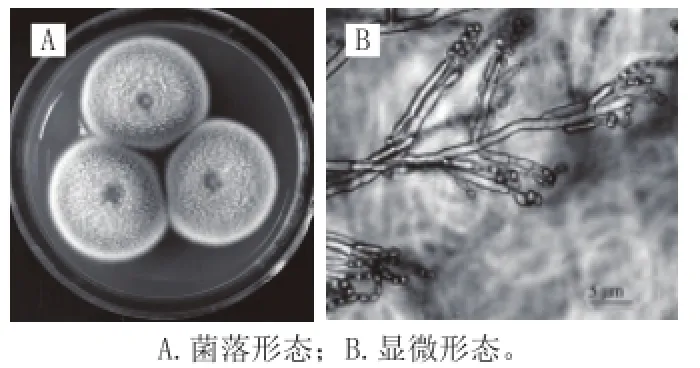
图2 M-15篮状菌的形态Fig.2 Morphology of T. funiculosus M-15
由图2A可见,M-15篮状菌菌落在PDA上28 ℃培养10 d,直径35~45 mm,中心凹陷,质地絮状,灰白色,渗出液缺乏。由图2B可见,具有典型的帚状枝,分生孢子梗发生于气生菌丝,孢梗茎较长,壁光滑;具有两轮分生孢子梗,分生孢子卵圆形,孢子链短且疏松。
2.2分离株DNA的28S rDNA序列分析

图3 分离株的28S rDNA扩增产物电泳图Fig.3 Electropherogram of PCR amplification products of 28S rDNA from some isolates
提取分离所得到的菌株的DNA模板,进行rDNA片段的PCR扩增,得到单一条带,如图3所示。再对扩增产物进行电泳检测以及测序。将测序所得结果通过BLAST进行比对。根据序列相似性加以鉴定。鉴定结果统计如表1所示。
从表1可见,15 份样品中共有8 个样品检出了耐热霉菌,检出率为53.3%,含菌量最高者达到3 CFU/mL。在耐热霉菌中最为常见的是篮状菌属T. funiculosus在6种不同样品中均有检出,包括脱色脱酸苹果汁、芒果汁、梨汁、进口和国产橙汁,检出率为40.0%;其次为正青霉E. crustaceum在3 种不同样品中均有检出,包括梨汁和进口橙汁,检出率为20.0%;有担子菌纲-白耙齿菌Irpex lacteus在国产梨汁和橙汁2 个样品中有检出,检出率为13.3%;另外有少量担子菌纲-拴菌属Trametes sp.和子囊菌门Dothideomycetes的枝孢菌属Cladosporium分别在脱色脱酸苹果汁和进口橙汁中有检出。
如表1和图4所示,经BLASTN和MEGA 6.0软件进行比对分析发现最初分离的15 个菌株实际只有5 个不同的属,分属T. funiculosus、E. crustaceum、Irpex lacteus、Trametes sp.。这15 个菌株与其对应的相似度最高的菌株相似度均达到98%以上,可以确定它们与相似度最高的菌株为同一种类。本实验鉴定结果中出现的主要的耐热真菌为正青霉属(Eupenicillium)和篮状菌属(Talaromyces)都是青霉的有性型属,属于子囊菌亚门(Ascomycotina),不整子囊纲(Plectomyces),散囊菌目(Eurotiales),发菌科(Trichocomaceae)[21]。同时,将测序结果提交至Genbank获得了对应的基因登录号。
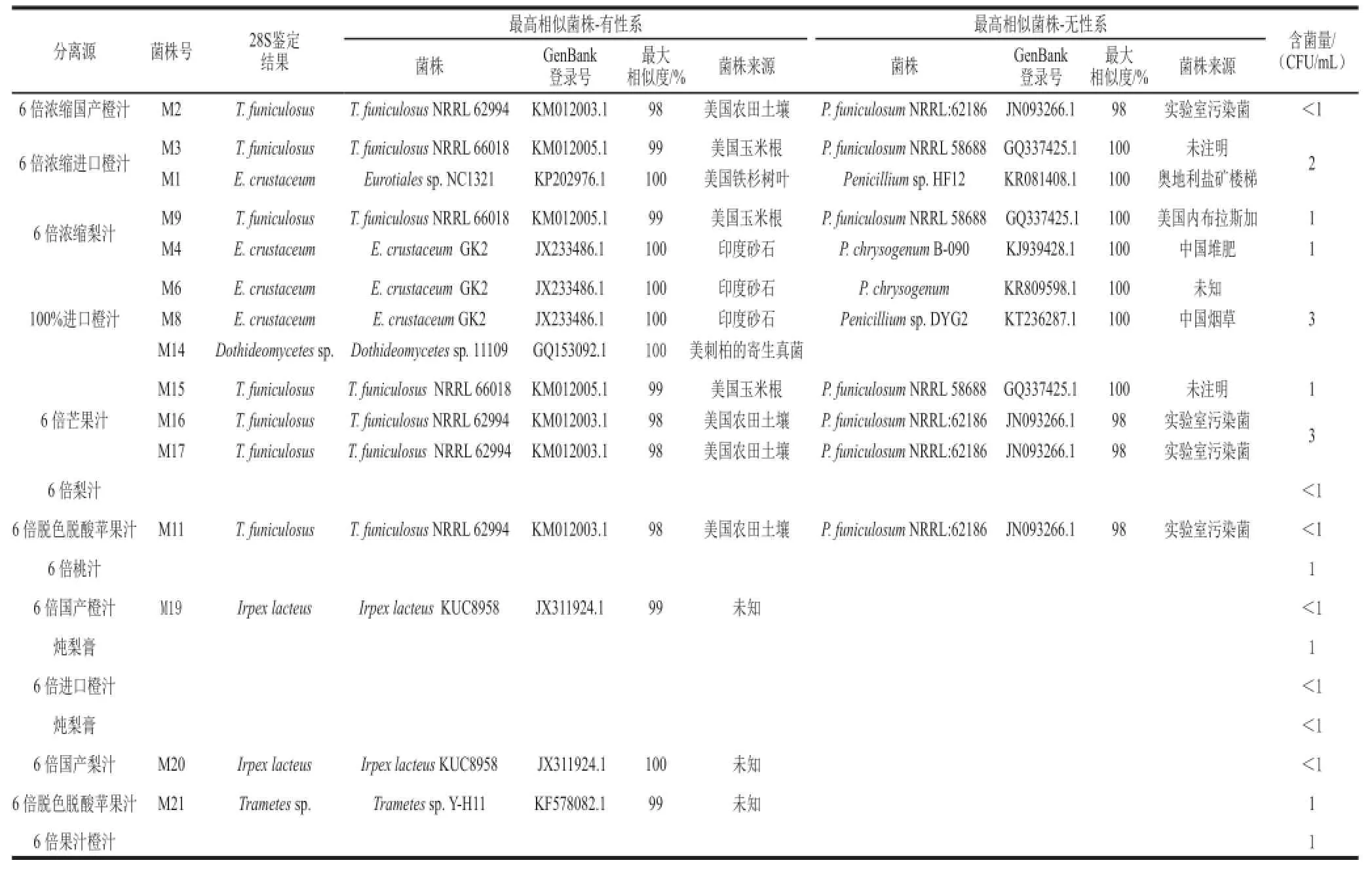
表1 浓缩果汁样品和分离株序列分析Table1 Summary of concentrated juice samples and 28S rDNA sequences analysis of the isolates from them

图4 耐热霉菌28S rDNA基因序列构建的系统发育树Fig.4 Phylogenetic tree based on 28S rDNA sequences of the isolated heat-resistant molds
3 讨 论
浓缩果汁的高酸高渗环境使微生物不能繁殖,多数以孢子等各种形式休眠,但是一旦还原为10%~100%等果汁产品,存活下来的耐热霉菌孢子就可以萌发、繁殖和产毒,所以即使少量耐热霉菌的污染也能带来后续加工的食品安全隐患。果汁中耐热真菌的检测方法目前还有很多争议,缺乏统一标准。在如何选择恰当培养基种类,合适的培养时间和采样量(体积)等各方面都存在诸多问题[5,22]。浓缩果汁则更复杂,因为6 倍高度浓缩后近乎浆状半固体,不易做均质和浇混等操作,但是一旦稀释后又减少了采样量提高了检测阈值。一些研究者建议采用浇混法计数,但是过于浓稠的浓缩果汁采用浇混法很难保证样品在皿中均匀分布,而且分布在培养基内部和底部的真菌由于缺氧等因素生长迟缓,也很难观察和取样进行后续分析。所以选用的是涂布法,采用12 cm的大皿,涂布1 mL样品,正置培养。检测时由于部分真菌生长慢,所以检测时间需要至少10~14 d,甚至更长,这就难免产生实验室室内霉菌污染和培养基干燥等问题。特别是污染问题令人头痛,很多研究者建议采用采样袋密封等方法[5,22],也不能完全避免污染。本实验采用了parafilm封口的方法,但是14 d左右长时间的保温封口膜也会发生干裂,出现裂隙。所以对凡是菌落中心出现在培养皿边缘的霉菌还是要考虑是否为污染菌的可能;另外凡是序列比对鉴定的结果中只有无性型真菌,也很可能是培养中的后污染。本实验中耐热真菌计数和鉴定结果中均排除了这两种情况下检出的霉菌。
青霉是常见真菌,广泛分布于土壤、空气、植物和室内等环境中。青霉的无性型也常常污染实验室,但是青霉的有性型篮状菌属和正青霉属的有性孢子并不常见,一般仅现于土壤中。所以果汁行业中这些耐热真菌的污染通常不是因空气带入,而是水果掉落或接近地面时带入,在后续果汁加工中这些有性孢子比无性孢子更为耐热,抗性强,不容易清除,能在成品中生长产毒,导致安全隐患,这已经引起了果汁行业的重视[23-24]。但是如何区分半知菌纲的青霉无性型和有性型有困难,青霉只在特定环境下才产生有性孢子,实验室一般情况下只能观察到其无性孢子及产孢结构,只能按无性型来鉴定。在这种情况下,分子生物学技术就体现出优势,直接跳过培养观察等步骤,准确地鉴定到属种还能鉴别到有性型[6]。
篮状菌属中多个种都被报道能产生耐热孢子,从而导致巴氏杀菌果汁和其他水果制品腐败变质,并能在食品中产生真菌毒素,所以在食品工业中有特殊地位。比如T. purpurogenus能产生一种肝毒素-红色青霉毒素Rubratoxin,曾有青少年因饮用含大量红色青霉毒素的大黄酒而急需肝移植的案例。T. islandicus则是大米储存中最有破坏性和有害的真菌之一,能产生大量肝毒性和致癌性的真菌毒素诸如环氯素、岛青霉毒素、红天精和黄天精[25]。
本实验检出的主要污染菌是篮状菌和正青霉,它们确实是果汁行业中经常检出而且危害很大的耐热真菌,但是也出现了以往很少报道的担子菌纲-白耙齿菌和拴菌,以及子囊菌门的枝孢菌属,它们也都有有性孢子,有文献报道某些枝孢菌能耐热,而且是果蔬腐败菌[26],鲜见关于果汁中检出耐热的白耙齿菌和拴菌的报道。虽然以丝衣霉、萨托氏菌、篮状菌和正青霉在果汁行业的危害已经广为人知,但是随着技术的发展一些相对罕见的耐热腐败真菌也不断被发现,如:钩囊菌Hamigera和嗜热子囊菌Thermoascus[4]。
目前国内外并未对果汁中耐热霉菌提出明确的限量要求,耐热霉菌检测周期长14~28 d,容易污染,操作不便可能是主要原因之一。耐热霉菌污染源头来自落果接触土壤带入,除了大型果汁生产企业能从水果采收等源头环节控制,一般企业只能在后续加工过程中注意控制储存加工条件抑制耐热霉菌的增殖和产毒。因此美国食品药品监督管理局是直接对真菌毒素提出限量要求,如苹果汁中棒曲霉毒素不得超过50 mg/kg[27]。但是果汁行业污染的真菌种类不少,每一种真菌又能产生多种毒素,要一一检测控制难度也不小。了解大宗果汁原料中耐热霉菌的数量和种类不仅对企业采购有帮助,对后续工艺参数的设定,特别是消杀参数设定有所助益。
[1] 夏晔. 果汁饮料的消费趋势分析[J]. 市场观察, 2005(5): 83-85.
[2] 李秀凤. 变质果汁中的微生物[J]. 食品与药品, 2005, 7(3): 61-62. DOI:10.3969/j.issn.1672-979X.2005.03.023.
[3] 胡夜明, 赵丽芹, 王婷. 超高压(UHP)技术在果汁灭菌中的应用[J]. 粮油加工(电子版), 2014(4): 76-77. DOI:10.3969/ j.issn.2095-6495.2014.04.018.
[4] SCARAMUZZA N, BERNI E. Heat-resistance of Hamigera avellanea and Thermoascus crustaceus isolated from pasteurized acid products[J]. International Journal of Food Microbiology, 2014, 168/169(1): 63-68. DOI:10.1016/j.ijfoodmicro.2013.10.007.
[5] HOUBRAKEN J, SAMSON R A. Standardization of methods for detecting heat resistant fungi[J]. Advances in Experimental Medicine and Biology, 2006, 571: 107-111. DOI:10.1007/0-387-28391-9_5.
[6] 郝天婷, 周帼萍. 2 例果汁饮料中污染真菌的鉴定分析[J]. 中国酿造, 2010, 29(9): 155-157. DOI:10.3969/j.issn.0254-5071.2010.09.050.
[7] 郭伟鹏, 吴清平, 张菊梅, 等. 果汁饮料中耐热霉菌的分离和鉴定研究[J]. 生物技术通报, 2008(增刊 1): 244-247; 257.
[8] 祝红昆. 耐热性霉菌引起果蔬汁饮料腐败问题的实验探讨[J]. 云南大学学报(自然科学版), 2008(增刊1): 359-362.
[9] 杨洋. 耐热性霉菌引起果蔬汁饮料腐败问题的探讨[J]. 四川食品工业科技, 1997(1): 19-20.
[10] 刘盼红. 贮藏苹果中展青霉素产生菌的分离鉴定和生长代谢特征研究[D]. 杨凌: 西北农林科技大学, 2008.
[11] 史文景, 赵其阳, 张耀海, 等. 超高效液相色谱结合分散液液微萃取同时测定果汁中的7 种真菌毒素[C]//第三届中国食品与农产品质量安全检测技术国际论坛. 2014.
[12] 史文景. 柑橘和果汁中链格孢霉毒素检测技术研究[D]. 重庆: 西南大学, 2014.
[13] 张小平, 李元瑞, 师俊玲, 等. 苹果汁中棒曲霉素控制技术研究进展[J]. 中国农业科学, 2005, 37(11): 1672-1676. DOI:10.3321/ j.issn:0578-1752.2004.11.015.
[14] 周俊, 乔坤云, 冯婷, 等. 番茄酱、果汁及果酒中棒曲霉素的检测与分析[C]//现代科学仪器. 乌鲁木齐: 中国科协2005年学术年会分会场: 农产品食品安全与品质检测技术学术研讨会, 2005: 113-114.
[15] 陈姗姗, 仇农学. 浓缩苹果汁中棒曲霉素的来源及检测[J].食品研究与开发, 2006, 27(2): 108-110. DOI:10.3969/ j.issn.1005-6521.2006.02.036.
[16] 李红光, 陈艳, 任磊. 果汁中展青霉素的高效液相色谱测定法[J]. 职业与健康, 2006, 22(14): 1076-1077. DOI:10.3969/ j.issn.1004-1257.2006.14.027.
[17] 苏青峰, 岳田利, 袁亚红, 等. 苹果汁中棒曲霉素主要产生菌的ITS序列分析鉴定[J]. 西北农林科技大学学报(自然科学版), 2005, 33(7): 131-134. DOI:10.3321/j.issn:1671-9387.2005.07.030.
[18] 周德庆, 徐德强. 微生物学实验教程[M]. 3版. 北京: 高等教育出版社, 2013: 23-25.
[19] TEHLER A, FARRIS J S, LIPSCOMB D L, et al. Phylogenetic analyses of the fungi based on large rDNA data sets[J]. Mycologia, 2000, 92(3): 459-474. DOI:10.2307/3761505.
[20] MARTIN K J, RYGIEWICZ P T. Fungal-specific PCR primers developed for analysis of the ITS region of environmental DNA extracts[J]. BioMed Central Microbiology, 2005, 5(1): 28. DOI:10.1186/1471-2180-5-28.
[21] 程池, 姚粟, 李金霞, 等. 青霉属及其相关有性型属菌种资源描述规范[EB/OL]. http://www.china-cicc.org/norm/%E9%9D%92%E9%9C %89%E5%B1%9E%E5%8F%8A%E5%85%B6%E7%9B%B8%E5% 85%B3%E6%9C%89%E6%80%A7%E5%9E%8B%E5%B1%9E%E8 %8F%8C%E7%A7%8D%E8%B5%84%E6%BA%90%E6%8F%8F% E8%BF%B0%E8%A7%84%E8%8C%83-250.html.
[22] RICO-MUNOZ E, HOUBRAKEN J, SAMSON R A. Detection and enumeration of heat-resistant molds[J]. Compendium of Methods for the Microbiological Examination of Foods, 2014, 21(5): 255-256. DOI:10.2105/MBEF.0222.027.
[23] JESENSKÁ Z, PIECKOVÁ E, BERNÁTD. Heat resistance of fungi from soil International Journal of Food Microbiology, 1993, 19(3):187-192. DOI:10.1016/0168-1605(93)90076-S.
[24] TOURNASV. Heat-resistant fungi of importance to the food and beverage industry[J]. Critical Reviews in Microbiology, 1994, 20(4):243-263.
[25] YILMAZ N, VISAGIE C M, HOUBRAKEN J, et al. Polyphasic taxonomy of the genus Talaromyces[J]. Studies in Mycology, 2014, 78(78): 175-341. DOI:10.1016/j.simyco.2014.08.001.
[26] BAO JU L I, LIU X M, PENG X W, et al. Screening of incompatible isolate of Cladosporium cucumernium with heat-resistance and its inducing disease-resistance in cucumber[J]. Acta Horticulturae Sinica, 2008, 35(3): 363-370.
[27] FDA. Guidance for industry: juice HACCP hazards and controls guidance first edition; final guidance[EB/OL]. (2004-03-03) [2016-01-19]. http://www.fda.gov/food/guidanceregulation/guidancedocumentsregul atoryinformation/ucm072557.htm.
Determination of Heat Resistant Mould in Concentrated Fruit Juice
TONG Xun, GAO Wen, HUANG Tingxuan, ZHOU Guoping*
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Objective: To detect and identify the heat resistant molds in 15 batches of concentrated fruit juice. Methods:After heat treatment at 80 ℃ for 30 min to kill the heat-sensitive fungi and activate the heat-resistant spores, we spread the concentrated juices on medium plates and counted the fungal colonies after 14-21 d culture. Secondly, the fungi were purifi ed, observed and identifi ed by 28S rDNA sequence analysis. Results: Heat resistant fungi were detected in eight out of 15 batches (53.3%) of concentrated fruit juice, consisting mainly of Eupenicillium and Talaromyces, together with a small number of Irpex lacteus, Trametes sp. and Capnodiales sp.. Conclusions: Heat resistant fungi were detected both in imported and domestic concentrated fruit juice, especially those Eupenicillium and Talaromyces can produce toxin as well.
concentrated juice; heat resistant mold; detection and identifi cation; Eupenicillium crustaceum; Talaromyces funiculosus
10.7506/spkx1002-6630-201620034
Q939.97
A
1002-6630(2016)20-0198-05
童迅, 高雯, 黄庭轩, 等. 浓缩果汁中耐热霉菌的分析及鉴定[J]. 食品科学, 2016, 37(20): 198-202. DOI:10.7506/ spkx1002-6630-201620034. http://www.spkx.net.cn
TONG Xun, GAO Wen, HUANG Tingxuan, et al. Determination of heat resistant mould in concentrated fruit juice[J]. Food Science, 2016, 37(20): 198-202. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620034. http://www.spkx.net.cn
2016-01-19
2015—2016武汉轻工大学大学生创新创业训练计划项目(CXXL20151004)
童迅(1993—),男,本科生,研究方向为生物工程。E-mail:594562513@qq.com
周帼萍(1971—),女,教授,博士,研究方向为食品微生物安全。E-mail:wjczgp@163.com
