复合PCR荧光检测方法检测转基因水稻品系
2016-11-07张明哲张晓峰徐莉莉陈笑梅尹文秀陈吴健李孝军
张明哲,张晓峰,徐莉莉,陈笑梅,周 圆,尹文秀,陈吴健,李孝军
(1.浙江省检验检疫科学技术研究院,浙江 杭州 310016;2.舟山出入境检验检疫局,浙江 舟山 316000)
复合PCR荧光检测方法检测转基因水稻品系
张明哲1,张晓峰1,徐莉莉1,陈笑梅1,周圆2,尹文秀1,陈吴健1,李孝军2
(1.浙江省检验检疫科学技术研究院,浙江 杭州 310016;2.舟山出入境检验检疫局,浙江 舟山 316000)
建立一种高通量的转基因复合聚合酶链式反应(polymerase chain reaction,PCR)荧光检测方法,该方法通过对转基因检测内源、外源及品系基因检测引物进行荧光标记,经复合PCR扩增和毛 细管电泳荧光检测,实现特异性强、高通量检测。结果表明,复合PCR荧光检测方法检测4 种转基因水稻品系特异性好,并且灵敏度达到0.1%,可以在进出口检验检疫、食品安全监测等领域进行应用。
复合聚合酶链式反应;毛细管电泳;转基因水稻;品系鉴定
近年来,全球转基因作物的商业化迅猛发展,种植面积由1996年的170万 hm2增加至2014年的1.8亿hm2,19 a中增加了近100 倍[1]。水稻是世界上最重要的粮食作物之一,在我国粮食生产中占有举足轻重的地位,转基因水稻研发进展也较为迅速,已经有多个转基因水稻优良品系进入环境释放阶段,申请商业化种植[2]。与此同时,转基因技术对环境和食品安全的潜在风险已引起全球的广泛关注[3-4],国际贸易纠纷时有发生。2012年初,欧盟委员会发布了《对中国出口大米制品中含有转基因成分采取紧急措施的决定》,欧盟将对中国25 种米制品采取强制性转基因成分检测,并依据检测结果采取退货和销毁处理措施,中国官方必须在向欧盟出口前提交米制品非转基因证明的检验报告,表明是否含有转基因成分。2006年以来,已有法国、德国、意大利和奥地利等7 个国家因为转基因大米污染对我国出口米制品采取了拒绝入境或撤架、召回等措施[5]。在此情况下,加强进出口领域转基因水稻品系检测成为必然趋势。
目前聚合酶链式反应(polymerase chain reaction,PCR)技术在转基因检测中得到了广泛的应用[6-8],如实时定量PCR技术[9-10]、环介导等温扩增技术[11-13]、重组酶聚合酶等温扩增技术[14-17]等,但是常用的PCR检测无法满足转基因高通量检测的需求[18-19]。因此,迫切地需要建立一种有效、快速的检测方法,而复合PCR荧光检测技术是解决这一问题的亮点。本研究建立了一种高通量的转基因复合PCR荧光检测方法,并应用于转基因水稻品系检测。该方法通过对转基因检测内源、外源及品系基因检测引物进行荧光标记,经复合PCR扩增和毛细管电泳荧光检测,实现高度特异性、高通量检测。
1 材料与方法
1.1材料与试剂
非转基因水稻、大豆和油菜籽 市购;转基因水稻品系Bt汕优63(Bt63)、科丰6号(KF6)、克螟稻(KMD) 中国检验检疫科学研究院;转基因水稻品系LLRICE62,转基因玉米品系GA21、Bt176、MIR604、Mon88017、Bt11,转基因大豆品系GTS-40-3-2、Mon89788、CV127,转基因油菜籽品系Ms8、Rf3、Rt73欧洲标准局。
Dneasy Plant Mini Kit试剂盒 德国Qiagen公司;引物和探针合成、普通PCR反应的试剂 宝生物工程(大连)有限公司;其他分析纯试剂购于美国Sigma公司。
1.2仪器与设备
PHILIPS cucina blender HR2860 荷兰Philips公司;Sorvall micro21R台式冷冻离心机、MAXQ6000摇床、Nano Drop 3300核酸测定仪 美国Thermo Fisher Scientific公司;S-1000PCR仪 美国Bio-Rad公司;Imager HP核酸电泳及凝胶成像系统 美国Alpha Innotech公司;数显恒温水浴锅 国华电器有限公司;XS104电子天平 瑞士Mettler Toledo公司;Pixsys5500点样仪 美国Cartesian Technologies公司;LS300 Scanner扫描仪 瑞士Tecan Group Ltd.公司;Milli-Q超纯水系统德国Merck公司;真空泵 天津奥特赛恩斯仪器有限公司;遗传分析仪 美国Applied Biosystems公司。
1.3方法
1.3.1材料制备
将水稻、大豆、油菜籽、玉米等材料研磨至粉末状(0.2 mm左右),在转基因样本中按比例加入非转基因样本,分别获得1%、0.1%、0.01%含量的转基因样品。
1.3.2DNA提取
DNA提取都使用QIAGEN Dneasy Plant Mini Kit试剂盒进行,DNA浓度由核酸测定仪检测得到。
1.3.3引物
实验所用引物设计时通过GeneBank中的BLAST功能考虑引物扩增特异性,由于采用的是复合PCR扩增体系,每组PCR的引物之间在混合体系中将存在一定的干扰,因此引物设计时考虑复合PCR的多组引物之间的干扰和平衡,调整引物。其中选择两条引物中的一条引物的5'端采用6-FAM、HEX、TAMRA中一种进行标记,且各组之间的标记色均不相同。以水稻品系Bt63为例,引物如表1所示。

表1 水稻品系Bt63引物序列Table1 Primer sequences for transgenetic rice event Bt6
1.3.4复合PCR扩增
以转基因样品提取的DNA为模板,同时加入多对引物进行复合PCR扩增,对复合PCR各引物添加量、TaqDNA聚合酶用量进行优化,建立优化的反应体系。PCR反应体系为:Reaction Mix 10 μL;热启动C-Taq 1 μL;Primers 5 μL;模板DNA 1 μL(质量浓度30 ng/μL左右);补ddH2O至25 μL。引物扩增终浓度见表2。扩增程序为:95 ℃预变性2 min;94 ℃变性30 s,59 ℃退火50 s,72 ℃延伸50 s,30 个循环;72 ℃延伸10 min。
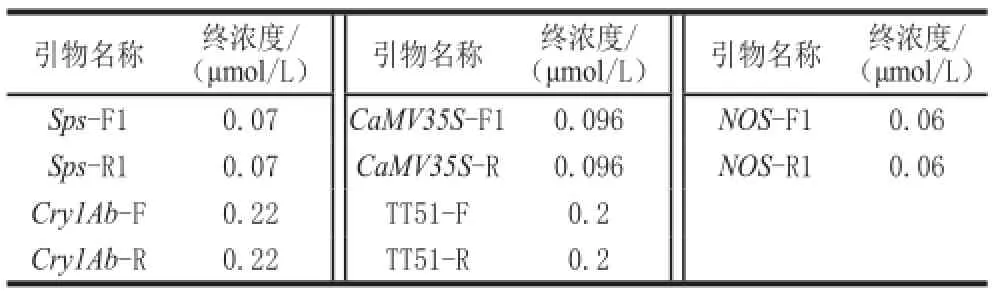
表2 引物扩增终浓度Table2 Final concentrations of primers
1.3.5荧光检测
由去离子甲酰胺与系统中分子质量内标AGCU Maker SIZ-500组成上样混合物[(0.5 µL AGCU Maker SIZ-500(制备方法参照专利CN101307226:用于寡核苷酸和蛋白标记的荧光染料及其制备方法和用途)×进样数+(12 µL去离子甲酰胺)×进样数]。将12.5 µL上样混合物与1 µL扩增产物混合,涡旋混匀后,2 000 r/min离心2 min,避免产生气泡。95 ℃变性3 min,冰浴3 min,并尽快采用多道或单道毛细管电泳进行检测,检测结果用遗传分析仪进行分析。
2 结果与分析
2.1检测基因选择与排布
转基因检测位点主要分为3 类,分别为内源、外源及品系基因。本研究中共检测27 个基因,包括大豆、玉米、油菜、水稻4 个内源基因、8 个外源基因以及15 个转基因品系,其中FAM色检测8 个外源基因,分别为NOS、Bar、Pat、CaMV35S、FMV35S、CP4-epsps、Cry1Ab、NPTII;HEX色检测玉米内源基因Zein及5 个转基因玉米品系GA21、MIR604、Mon88017、Bt176、Bt11;TAMRA色检测大豆内源基因Lectin、油菜内源基因Pe3-pepcase、水稻内源基因Sps,4 个转基因水稻品系Bt63、KF6、KMD、LLRICE62,3 个转基因油菜品系Ms8、Rf3、Rt73以及3 个转基因大豆品系GTS-40-3-2、Mon89788、CV127。具体排布位置见图1。
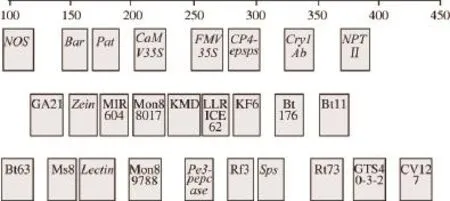
图1 转基因检测基因排布Fig.1 Gene loci configuration for GMO detection
2.2特异性分析
在本实验中,利用复合PCR荧光检测法对4 种转基因水稻品系进行检测,其中Bt63品系检测结果如图2A所示。出峰位点分别为终止子基因NOS、转基因水稻抗虫外源基因Cry1Ab、水稻转基因品系Bt63、基因水稻内源基因Sps,而其他基因位点未出峰。因此确定检测出转基因水稻Bt63品系,说明复合PCR荧光检测法进行转基因检测具有高度的特异性。

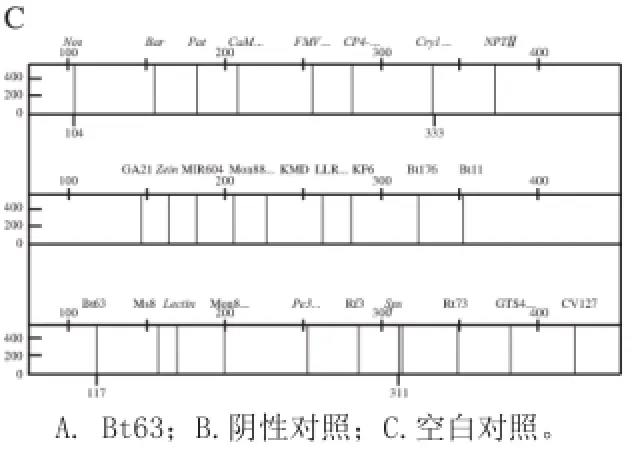
图2 转基因水稻Bt63扩增图谱Fig.2 Polymorphic fingerprints of genetically modified rice Bt63
2.3混合品系检测分析
在本实验中,利用复合PCR荧光检测法对转基因水稻Bt63、KF6、KMD的混合品系进行检测,结果如图3所示,出峰位点分别为终止子基因NOS、启动子CaMV35S、转基因水稻抗虫外源基因Cry1Ab、水稻转基因品系KMD、水稻转基因品系KF6、水稻转基因品系Bt63及水稻内源基因Sps,而其他基因位点未出峰。因此我们确定检测出转基因水稻KMD、KF6、Bt63的混合品系。

图3 转基因水稻混合品系扩增图谱Fig.3 Polymorphic fingerprints of mixed genetically modified rice events
2.4灵敏度分析
在本实验中,利用复合PCR荧光检测法对不同含量的转基因水稻进行检测灵敏度分析,检测结果显示,Sps基因扩增的信号值基本稳定,能有效满足芯片灵敏度检测的需要。外源基因CaMV35S、NOS、Cry1Ab及品系Bt63检测发现,1%、0.1%含量的转基因检测都有阳性信号出现(图4、5),而0.01%含量的转基因检测无阳性信号出现(图6)。3 次重复检测显示,0.1%含量的检测结果基本稳定,因此认为本实验中复合PCR荧光检测法进行转基因检测的灵敏度为0.1%。
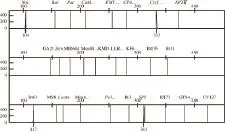
图4 转基因样本Bt63与非转基因水稻混合所占比例为1%时扩增图谱Fig.4 Polymorphic fingerprints of genetically modified rice Bt63 added with 1% non-genetically modified rice

图5 转基因样本Bt63与非转基因水稻混合所占比例为0.1%时扩增图谱Fig.5 Polymorphic fingerprints of genetically modified rice Bt63 added with 0.1% non-genetically modified rice
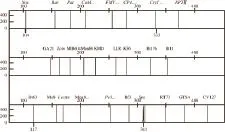
图6 转基因样本Bt63与非转基因水稻混合所占比例为0.01%时扩增图谱Fig.6 Polymorphic fingerprints of genetically modified rice Bt63 added with 0.01% non-genetically modified rice
3 讨 论
目前基于DNA的转基因检测通常使用对目标序列扩增的方法来进行检测,根据检测目标序列的不同可分为筛选检测(如35S启动子、NOS终止子等)、基因特异性检测(外源基因)、构建特异性检测和品系特异性检测(转化事件)。其中品系特异性检测[20]是通过分析外源插入载体与植物基因组的连接区序列实现的,每一个转基因植物品系,都具有特异的外源插入载体与植物基因组的连接区序列,并且连接区序列是单拷贝的,所以品系特异性检测方法具有非常高的特异性和准确性。品系特异性检测是目前转基因植物及其产品检测的最准确和最特异的核酸检测方法,并将为国际检测标准和国际各检测实验室所采用。
目前,已建立了以PCR技术为代表的一系列水稻品系检测方法,如Bt63[21]、LLRICE62[22]、科丰6号[23]等。但是这些方法都是以单品系检测为基础的,随着转基因品系的不断增多,迫切需求高通量、高灵敏度和高特异性的检测方法。综上所述,本研究建立的转基因复合PCR荧光检测方法具有高特异性、高灵敏度以及高通量等特点,可以在进出口检验检疫、食品安全监测等领域进行广泛应用。
[1] JAMES C. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2015, 35(1): 1-14. DOI:10.13523/j.Cb.20150101.
[2] 李黎红, 叶卫军, 郭龙彪. 我国转基因水稻研究进展和商业化前景分析[J]. 中国稻米, 2012, 18(6): 1-4. DOI:10.3969/ j.issn.1006-8082.2012.06.001.
[3] 贾士荣. 转基因作物的环境风险分析研究进展[J]. 中国农业科学, 2004, 37(2): 175-187. DOI:10.3321/j.issn:0578-1752.2004.02.004.
[4] 贾士荣. 未来转基因作物的环境风险分析[J]. 中国农业科学, 2004, 37(4): 484-489. DOI:10.3321/j.issn:0578-1752.2004.04.004.
[5] 张明哲, 陈吴健, 张晓峰, 等. 酶连接探针杂交芯片特异性检测转基因水稻品系[J]. 食品科学, 2014, 35(8): 222-225. DOI:10.7506/ spkx1002-6630-201408044.
[6] GACHET E, MARTIN G G, VIGNEAU F, et a1. Derection of genetically modified organisms (GMOs) by PCR: a brief review of methodologies available[J]. Trends in Food Science and Technology, 1999, 9: 380-388. DOI:10.1016/S0924-2244(99)00002-3.
[7] 邱良焱, 肖有玉, 刘佳, 等. 多重PCR法检测转Bar、Bt基因双抗稻米[J]. 食品科学, 2013, 34(6): 139-142. DOI:10.7506/spkx1002-6630-201306030.
[8] 王媛, 葛毅强, 陈颖, 等. 大豆加工食品中转基因成分多重PCR检测体系的建立[J]. 食品与发酵工业, 2004, 30(10): 117-121. DOI:10.3321/j.issn:0253-990X.2004.10.025.
[9] CHAOUACHI M, MALKI R E, BERARD A, et al. Development of a real-time PCR method for the differential detection and quantification of four solanaceae in GMO analysis: potato, tomato, eggplant and pepper[J]. Journal of Agricultural and Food Chemistry, 2008, 56(6):1818-1828. DOI:10.1021/jf073313n.
[10] WENG H B, YANG L T, LIU Z L, et al. Novel reference gene, highmobility-group protein I/Y, can be used in qualitative and realtime quantitative PCR detection of transgenic canolas cultivars[J]. Journal of Aoac International, 2005, 88(2): 577-584.
[11] GUAN X Y, GUO J C, SHEN P, et al. Visual and rapid detection of two genetically modified soybean events using loop-mediated isothermal amplification method[J]. Food Analytical Methods, 2010, 3(4): 313-320. DOI:10.1007/s12161-010-9132-x.
[12] CHEN L L, GUO J C, WANG Q D, et al. Development of the visual loop-mediated isothermal amplification assays for seven genetically modified maize events and their application in practical samples analysis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11):5914-5918. DOI:10.1021/jf200459s.
[13] CHEN X Y, WANG X F, JIN N, et al. Endpoint visual detection of three genetically modified rice events by loop-mediated isothermal amplification[J]. International Journal of Molecular Sciences, 2012, 13(11): 14421-14433. DOI:10.3390/ijms131114421.
[14] BOYLE D S, LEHMAN D A, LILLIS L, et al. Rapid detection of HIV-1 proviral DNA for early infant diagnosis using recombinase polymerase amplification[J]. MBio, 2013, 4(2): 49-52. DOI:10.1128/ mbio.00135-13.
[15] EULER M, WANG Y J, NENTWICH O, et al. Recombinase polymerase amplification assay for rapid detection of Rift valley fever virus[J]. Journal of Clinical Microbiology, 2012, 54(4): 308-312. DOI:10.1016/j.jcv.2012.05.006.
[16] EULER M, WANG Y J, OTTO P, et al. Recombinase polymerase amplification assay for rapid detection of Francisella tularensis[J]. Journal of Clinical Microbiology, 2012, 50(7): 2234-2238. DOI:10.1128/jcm.06504-11.
[17] 徐潮, 李亮, 金芜军, 等. 荧光RPA技术检测转基因水稻科丰6号[J].分子植物育种, 2014, 12(5): 875-880.
[18] 许文涛, 杨蓉, 陆姣, 等. 转基因玉米59122品系的特异性检测[J]. 食品科学, 2011, 32(4): 139-142. DOI:10.3969/ j.issn.0439-8114.2011.24.065.
[20] BERDAL K, HOLST-JENSEN A. Roundup ready soybean eventspecific real-time quantitative PCR assay and estimation of the practical detectionand quantification limits in GMO analyses[J]. European Food Research and Technology, 2001, 213: 432-438. DOI:10.1007/s002170100403.
[21] 吴志毅, 张明哲, 陈曦, 等. 大米和米制品Bt63转基因检测PCR方法的灵敏度研究[J]. 浙江农业科学, 2009, 21(6): 549-554. DOI:10.3969/j.issn.1004-1524.2009.06.004.
[22] DING J Y, JIA J W, YANG L T, et al.Validation of a rice specific gene, sucrose phosphate synthase, used as the endogenous reference gene for qualitative and real-time quantitative PCR detection of transgenes[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3372-3377. DOI:10.1021/jf049915d.
[23] REITING R, GROHMANN L, MADE D. A testing cascade for the detection of genetically modified rice by real-time PCR in food and its application for detection of an unauthorized rice line similar to KeFeng6[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit, 2010, 5(2): 185-188. DOI:10.1007/s00003-010-0573-3.
Establishment of a High-Throughput Fluorescence Multiplex PCR Method for Detection of Genetically Modified Rice Events
ZHANG Mingzhe1, ZHANG Xiaofeng1, XU Lili1, CHEN Xiaomei1, ZHOU Yuan2, YIN Wenxiu1, CHEN Wujian1, LI Xiaojun2
(1. Zhejiang Academy of Science and Technology for Inspection and Quarantine, Hangzhou 310016, China;2. Zhoushan Entry-Exit Inspection and Quarantine Bureau, Zhoushan 316000, China)
In this research, a high-throughput and specific method for the detection of genetically modified (GM) rice events was developed using fluorescence multiplex PCR and capillary electrophoresis based on fluorescence-labeled primers for endogenous, exogenous and event-specific genes. The fluorescence multiplex PCR method could specifically detect four GM rice events with a sensitivity of 0.1%. This method has the potential to be applied in the inspection and quarantine of import and export genetically modified commodities and in food safety detection.
multiplex PCR; capillary electrophoresis; genetic modified rice; identification of genetically modified events
10.7506/spkx1002-6630-201620032
Q789
A
1002-6630(2016)20-0187-04
张明哲, 张晓峰, 徐莉莉, 等. 复合PCR荧光检测方法检测转基因水稻品系[J]. 食品科学, 2016, 37(20): 187-190.
DOI:10.7506/spkx1002-6630-201620032. http://www.spkx.net.cn
ZHANG Mingzhe, ZHANG Xiaofeng, XU Lili, et al. Establishment of a high-throughput fluorescence multiplex PCR method for detection of genetically modified rice events[J]. Food Science, 2016, 37(20): 187-190. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620032. http://www.spkx.net.cn
2016-02-01
浙江省重大科技专项(2011C12023);国家质检总局科技计划项目(2011IK249);浙江省公益技术项目(2011C22065;2014C32004)
张明哲(1982—),男,高级农艺师,博士研究生,研究方向为分子生物学和植物检疫。
E-mail:mzzhang429@163.com
