携带HPV11基因组的HaCaT细胞APOBEC3s表达及α干扰素的调控
2016-11-06王永芳李新宇宋莎莎孙洋
王永芳 李新宇 宋莎莎 孙洋
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所药物研究室
携带HPV11基因组的HaCaT细胞APOBEC3s表达及α干扰素的调控
王永芳 李新宇 宋莎莎 孙洋
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所药物研究室
目的 探讨携带HPV11基因组的HaCaT细胞(HPV11.HaCaT)中载脂蛋白B信使RNA编辑酶催化多肽样蛋白3家族(APOBEC3s,A3s)mRNA表达、主要A3蛋白在细胞内的表达、分布,以及外源性α干扰素对其调节。方法 qRT-PCR检测HPV11.HaCaT细胞中A3A、A3B、A3C和A3H mRNA的基础表达水平,并与正常HaCaT细胞作比较;分别用不同浓度的重组人IFN-α2b(rhIFN-α2b)作用于HaCaT、HPV11.HaCaT、Hela细胞6、24、48 h后,qRT-PCR检测A3A、A3B、A3C和A3H mRNA表达水平。细胞免疫荧光染色法观察rhIFN-α2b刺激6 h时,A3A蛋白在3种细胞中的表达和分布情况。结果 HPV11.HaCaT细胞内A3A、A3B、A3C mRNA表达量均明显高于正常HaCaT细胞(P<0.05)。在不同浓度rhIFN-α2b刺激下,3种细胞4种A3成员mRNA表达趋势存在差异,其中A3A升高最为明显。与各自正常对照组相比,106IU/ml rhIFN-α2b刺激6 h时3种细胞的A3A mRNA表达明显升高,差异有统计学意义(HaCaT细胞35.77±5.01比1.00±0.05,P<0.05;HPV11.HaCaT细胞15.34±2.14比0.99±0.01,P<0.05;Hela 24.60±5.45比0.97±0.03,P<0.05),而A3B、A3C和A3H mRNA相对表达量均低于10倍。经106IU/ml rhIFN-α2b处理6 h后,3种细胞胞质和胞核中均可见到A3A蛋白的阳性染色增加。结论 HPV11进入HaCaT细胞后,可激活A3s(尤其是A3A)免疫系统。α干扰素诱导A3A的高表达可能是其发挥免疫调控功能的机制之一。
尖锐湿疣;干扰素α;角蛋白细胞;载脂蛋白B类;载脂蛋白B信使RNA编辑酶催化多肽样蛋白3家族
尖锐湿疣(condyloma acuminata,CA)是常见的性传播疾病之一,主要由低危型人乳头瘤病毒(HPV)6/11感染引起,传染性强,病情反复发作,增加癌变的风险[1-3]。研究表明,HPV感染引起的皮肤黏膜病变甚至癌变是HPV持续感染和宿主免疫应答的联合作用而诱发的病理改变[4]。载脂蛋白B信使RNA编辑酶催化多肽样蛋白3家族(APOBEC3s,简称A3s)是固有免疫系统中最具代表性的一类家族蛋白,目前已发现至少7个成员(A3A~A3H),它们对HIV、HBV、HPV等多种病毒有抑制和超突变作用[5]。我们前期[6]研究中,用HaCaT细胞作为宿主细胞,通过基因转染技术,建立了携带HPV11基因组的HaCaT细胞(HPV11.HaCaT细胞),并发现外源性α干扰素(IFN)可抑制细胞中HPV11 DNA复制。已有报道,IFN-β通过诱导A3s高表达使得高危型HPV16 E2基因发生超突变[7],而IFN-α在角质形成细胞中抑制HPV11 DNA复制是否亦与A3s有关,尚未见报道。本研究首先通过检测HPV11.HaCaT细胞中A3s的表达水平,并与正常HaCaT细胞作比较,以了解HPV11进入宿主细胞后A3s的表达情况;其次通过外源性IFN-α处理后,观察IFN-α对HPV11.HaCaT细胞中A3s表达的调节及了解主要A3亚型在细胞内的分布情况,并同步观察IFN-α处理的HaCaT细胞和HPV18型转化的人宫颈癌细胞Hela株的A3s表达和主要A3亚型的分布,为深入探讨A3s与HPV11早期基因之间的相互作用以及IFN-α在其中的免疫调控机制打下基础。
资料与方法
一、资料
1.细胞株:人角质形成细胞永生化细胞株HaCaT细胞、HPV18型转化的人宫颈癌细胞株Hela由中国医学科学院皮肤病研究所药物研究室保存;HPV11.HaCaT细胞由本实验室通过脂质体介导法将HPV11全长DNA转染入HaCaT细胞后建立并保存[6,8],选用 10 代以内的细胞复苏备用。
2.主要试剂和仪器:注射用重组人IFNα2b(rhIFN-α2b,3× 106IU/ml)购自安徽安科生物工程股份有限公司。DMEM培养基、1640培养基(美国Gibco公司);新生牛血清(杭州四季青生物工程材料有限公司);Trizol(美国Invitrogen公司);GoScript反转录试剂盒(美国Promega公司);SYBR实时荧光定量PCR预混液(美国Applied Biosystems公司);APOBEC3A、APOBEC3B、APOBEC3C 和APOBEC3H引物(广州复能基因有限公司);TritonX-100(上海捷瑞生物工程有限公司);兔抗人APOBEC3A单克隆抗体(Anti-PHO1,美国Abcam公司);羊抗兔Alexa Flour 488免疫荧光染色试剂盒、4,6-二脒基-2-苯基吲哚二盐酸盐染色液(DAPI,5 mg/ml)、免疫染色封闭液(上海碧云天生物技术研究所)。DU800核酸蛋白分析仪(美国Beckman公司);GeneAmp 9700型PCR仪、ABI Prism 7300型荧光定量PCR(美国Applied Biosystems公司);FV1000型激光共聚焦显微镜(日本Olympus公司)。
二、方法
1.HaCaT细胞、HPV11.HaCaT细胞、Hela细胞培养与传代:HaCaT细胞和HPV11.HaCaT细胞均用含10%新生牛血清的DMEM培养液,Hela细胞用含10%新生牛血清的1640培养液,3种细胞均于37℃、5%CO2条件下培养,每隔2~3天常规消化传代。
2.实时荧光定量反转录聚合酶链反应(qRTPCR)检测A3s家族基因表达情况:①HaCaT细胞、HPV11.HaCaT细胞内APOBEC3s的表达情况:取对数生长期细胞,常规消化后按4×105/孔细胞密度接种6孔板,培养24 h后提取HaCaT细胞、HPV11.HaCaT细胞总RNA;②IFN-α处理实验:取对数生长期细胞,常规消化后按4×105/孔、3×105/孔、2×105/孔细胞密度分别接种6孔板,培养24 h后,rhIFN-α2b 处理组各孔分别加入含 104、105、106IU/ml rhIFN-α2b的培养液2 ml,分别刺激HaCaT细胞、HPV11.HaCaT 细胞、Hela细胞 6 h、24 h、48 h 后提取总RNA,实验加设正常细胞对照(无rhIFN-α2b处理组)。总RNA提取按Trizol说明书进行。用核酸蛋白分析仪测定RNA纯度和浓度。反转录合成cDNA的反应条件为:25℃5 min;42℃55 min;70℃,15 min。PCR扩增体系包括cDNA模版1 μl,SYBR实时荧光定量PCR预混液10 μl,上游引物1 μl,下游引物 1 μl,ddH2O 7 μl。将其置于实时荧光定量PCR仪上进行PCR,反应步骤如下:95℃,10 min;再行 40个循环(95℃ 10 s、60℃ 20 s、72℃30 s)后,于每个循环延伸段收集荧光信号。以β肌动蛋白作为内参照,采用2-△△Ct法计算,对特异性扩增目的基因进行相对定量。
3.免疫荧光染色:取对数生长期HaCaT细胞、HPV11.HaCaT细胞、Hela细胞,常规消化后按1×105/孔细胞密度接种在预先铺好盖玻片的6孔板,培养24 h。rhIFN-α2b处理组各孔分别加入含104、106IU/ml rhIFN-α2b的培养液2 ml继续培养6 h。实验加设正常对照组(无rhIFN-α2b处理组)。取出细胞爬片,用PBS洗3 min×3次,用4%甲醛固定15 min,0.1%Triton-X-100-TBS液洗3次。免疫染色封闭液室温孵育1 h,再滴加按1∶250稀释的APOBEC3A抗体。放入湿盒中,4℃孵育过夜。次日用0.1%Triton-X-100-TBS液洗3次,再滴加按1∶400稀释的荧光标记二抗(Alexa Flour 488羊抗兔IgG抗体)。37℃避光孵育1 h,TBS冲洗3次,滴加DAPI染色液对核进行复染 5min(避光,37℃)。TBS洗3次,加入抗荧光淬灭剂封片。用激光共聚焦显微镜高倍镜(×400)观察样品,Alexa Flour 488和DAPI两种染料分别由氩离子激光器495 nm、364 nm激发,发射波长519 nm和454 nm。
4.统计学分析:实验重复3次,用SPSS17.0统计软件对数据进行处理,qRT-PCR结果以±s表示,两组之间比较用t检验,P<0.05为差异有统计学意义。
结 果
一、携带HPV11基因组的HaCaT细胞中A3s的mRNA表达水平
HPV11.HaCaT细胞组内APOBEC3s mRNA表达量均有不同程度的升高,A3A、A3B、A3C mRNA 表达水平(2-△△Ct)分别为5.18±1.58,1.51±0.14,2.55±0.02,与正常 HaCaT 细胞组相比,差异有统计学意义(P<0.05),其中以A3A的变化最为明显。见图1。
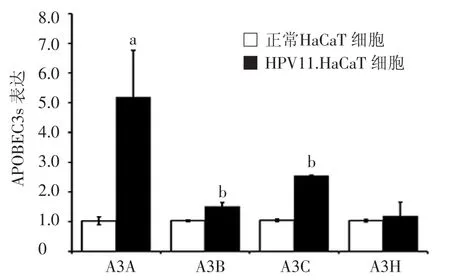
图 1 qRT-PCR检测 HaCaT细胞、HPV11.HaCaT细胞内APOBEC3s的表达情况 APOBEC3s:载脂蛋白B信使RNA编辑酶催化多肽样蛋白 3 家族;A3A:APOBEC3A;A3B:APOBEC3B;A3C:APOBEC3C;A3H:APOBEC3H;a:与正常 HaCaT 细胞组比较,P<0.05;b:与正常HaCaT细胞组比较,P<0.01
二、IFN-α 对 HaCaT 细胞、HPV11.HaCaT 细胞、Hela细胞 A3A、A3B、A3C、A3H mRNA表达水平的影响
qRT-PCR分析结果显示,在无rhIFN-α2b(0 IU/ml)刺激下,3 种细胞内A3A、A3B、A3C、A3H均有一定的基础表达水平。在不同浓度rhIFN-α2b刺激下,3种细胞4种A3亚型mRNA表达趋势及表达峰值时间存在差异,其中A3A升高最为明显。与各自正常对照组比较,不同浓度(105、106IU/ml)的 rhIFN-α2b 对 3 种细胞 A3A mRNA表达均有上调作用,3个刺激时间点中以6 h时相对表达量最高(P<0.05);随着刺激浓度的增加,rhIFN-α2b对 HaCaT细胞、HPV11.HaCaT 细胞A3A mRNA表达的上调作用亦明显增加,而Hela细胞仅在刺激6 h时A3A mRNA表达随rhIFN-α2b浓度的增加而明显增强。A3B、A3C、A3H的mRNA表达随着rhIFN-α2b浓度的升高亦有升高趋势,但其相对表达量均<10倍,变化幅度没有A3A大。见表1~3。参照本实验结果,选择变化最为明显的A3A进行后续实验。
表1 不同浓度rhIFN-α2b在不同时间对HaCaT细胞APOBEC3s mRNA相对表达水平的影响(±s)

表1 不同浓度rhIFN-α2b在不同时间对HaCaT细胞APOBEC3s mRNA相对表达水平的影响(±s)
注:n=3。APOBEC3s:载脂蛋白B信使RNA编辑酶催化多肽样蛋白3家族。对应时间点无rhIFN-α2b处理组为对照组,a:与对照组比较,差异有统计学意义(P<0.05)
APOBEC3s 时间(h)α 干扰素浓度(IU/ml)0 104 105 106 APOBEC3A 6 1.00±0.05 1.68±0.45 4.67±0.99a 35.77±5.01a APOBEC3B 6 1.13±0.14 1.95±0.82 2.92±1.17a 3.06±1.50 APOBEC3C 6 0.94±0.11 1.09±0.38 1.69±0.79 2.59±0.54a APOBEC3H 6 1.06±0.05 1.15±0.34 3.17±0.64a 7.75±2.34a APOBEC3A 24 1.06±0.08 2.06±0.49a 3.53±1.21a 10.18±3.41a APOBEC3B 24 1.03±0.03 1.16±0.14 1.61±0.52 3.07±0.13a APOBEC3C 24 1.04±0.04 1.61±0.11a 1.38±0.09a 1.73±0.04a APOBEC3H 24 1.03±0.05 1.41±0.11a 1.92±0.79 2.50±0.74a APOBEC3A 48 1.10±0.11 1.08±0.07 1.42±0.09a 3.22±0.50a APOBEC3B 48 1.05±0.16 1.41±1.19 2.04±0.78 6.14±1.60a APOBEC3C 48 1.02±0.05 1.96±0.08a 1.67±0.11a 6.71±0.65a APOBEC3H 48 0.96±0.09 2.21±0.67a 1.91±1.06 3.16±0.83a
表2 不同浓度rhIFN-α2b在不同时间对HPV11.HaCaT细胞APOBEC3s mRNA相对表达水平的影响(±s)

表2 不同浓度rhIFN-α2b在不同时间对HPV11.HaCaT细胞APOBEC3s mRNA相对表达水平的影响(±s)
注:n=3。APOBEC3s:载脂蛋白B信使RNA编辑酶催化多肽样蛋白3家族。对应时间点无rhIFN-α2b处理组为对照组,a:与对照组比较,差异有统计学意义(P<0.05)
APOBEC3s 时间(h)α 干扰素浓度(IU/ml)0 104 105 106 APOBEC3A 6 0.99±0.01 1.49±0.86 2.63±0.28a 15.34±2.14a APOBEC3B 6 1.02±0.03 1.00±0.29 1.82±0.61 9.69±2.13a APOBEC3C 6 1.09±0.68 1.17±0.38 1.18±0.32 1.31±0.27 APOBEC3H 6 1.01±0.19 0.98±0.44 1.86±0.36a 2.92±0.52a APOBEC3A 24 1.10±0.28 1.73±1.07 2.15±0.32 8.71±3.44a APOBEC3B 24 0.96±0.09 0.93±0.06 0.99±0.05 1.07±0.26 APOBEC3C 24 1.05±0.05 1.00±0.25 1.68±0.02a 1.63±0.08a APOBEC3H 24 1.08±0.08 1.08±0.24 1.07±0.08 1.38±0.16a APOBEC3A 48 0.91±0.16 1.03±0.61 1.40±0.31 2.37±1.01 APOBEC3B 48 0.96±0.04 1.78±0.71 2.06±0.87 1.75±0.75 APOBEC3C 48 0.98±0.05 2.65±0.32a 3.09±0.05a 5.72±1.23a APOBEC3H 48 1.07±0.06 1.75±1.09 1.96±0.37a 2.13±1.85
表3 不同浓度rhIFN-α2b在不同时间对Hela细胞APOBEC3s mRNA相对表达水平的影响(±s)

表3 不同浓度rhIFN-α2b在不同时间对Hela细胞APOBEC3s mRNA相对表达水平的影响(±s)
注:n=3。APOBEC3s:载脂蛋白B信使RNA编辑酶催化多肽样蛋白3家族。对应时间点无rhIFN-α2b处理组为对照组,a:与对照组比较,差异有统计学意义(P<0.05)
APOBEC3s 时间(h)α 干扰素浓度(IU/ml)0 104 105 106 APOBEC3A 6 0.97±0.03 5.78±2.37a 6.29±0.59a 24.60±5.45a APOBEC3B 6 0.99±0.10 1.75±0.80 1.55±0.35 2.15±0.19a APOBEC3C 6 0.95±0.11 1.58±0.15a 1.76±0.64 2.03±0.59a APOBEC3H 6 1.08±0.10 1.73±0.47 3.88±0.97a 6.94±1.73a APOBEC3A 24 1.03±0.16 1.32±0.05a 1.14±0.21 1.15±0.08a APOBEC3B 24 1.00±0.12 3.06±0.48a 2.90±1.29 2.13±0.55a APOBEC3C 24 0.98±0.07 1.67±0.04a 1.99±0.71 2.58±0.72a APOBEC3H 24 0.97±0.03 1.89±0.32a 2.19±1.43 2.02±0.98 APOBEC3A 48 1.01±0.01 2.71±0.67a 1.36±0.29 1.73±0.18a APOBEC3B 48 1.01±0.19 1.90±0.26a 1.60±0.22a 2.63±1.20 APOBEC3C 48 0.91±0.08 1.12±0.71 0.99±0.11 1.23±0.50 APOBEC3H 48 0.97±0.03 1.36±0.50 1.20±0.05a 2.09±0.64a
三、HaCaT细胞、HPV11.HaCaT细胞、Hela细胞中A3A蛋白的表达以及IFN-α的影响
共聚焦显微镜检测结果见图2。细胞内A3A蛋白表达呈绿色荧光。rhIFN-α2b加入前,3种细胞A3A蛋白的基础表达量略有差异,正常HaCaT细胞中A3A蛋白表达较少,多分布于细胞质中,HPV11.HaCaT细胞中该蛋白表达量较HaCaT细胞多,而Hela细胞的基础表达量最高,且HPV11.HaCaT细胞和Hela细胞内A3A蛋白在胞质和胞核中均有分布。3种细胞经不同浓度的rhIFN-α2b刺激6 h后,A3A蛋白表达量均有所增加,尤其在106IU/ml rhIFN-α2b处理后,表达量明显增加,且在胞质和胞核中均可见到该蛋白的阳性染色增加。
讨 论
A3蛋白是固有免疫系统中重要的一类蛋白,作用于病毒双链DNA复制或转录过程中暴露出来的单链DNA,通过DNA脱氨基作用或非脱氨机制,限制病毒的转录与复制。A3s蛋白与HPV的相关研究较少,目前仅有数篇围绕A3s与高危型HPV早期基因间相互影响的相关报道,而A3s与低危型HPV间相互影响的研究更少。A3蛋白主要分布于角质形成细胞、淋巴细胞、卵巢和睾丸等多种细胞和组织中,其中角质形成细胞主要表达 A3A、A3B、A3C、A3H 亚型[7,9]。本研究结果显示,正常HaCaT细胞A3s mRNA基础表达水平较低,而HPV11.HaCaT细胞中表达水平较高,其中以A3A的变化最为明显,表明携带病毒(HPV11)基因组后,宿主细胞A3A表达升高。同样,HeLa细胞的研究结果也表明,HPV18转化的细胞表达较高水平的的A3A。宿主细胞感染病毒后是否能通过激活A3s(特别是A3A)免疫系统产生针对HPV11的免疫清除作用及HPV11反复感染是否诱导了A3A表达的长期失调,尚需深入的研究。
IFN-α和IFN-β由病毒感染的细胞分泌,具有广谱的抗病毒、抗肿瘤、提高免疫功能等作用[10]。已有研究报道,A3s蛋白在正常组织中一般只有痕量表达,但在IFN、肿瘤坏死因子等炎症因子的刺激下,表达可上调[11]。本研究发现,rhIFN-α2b能上调A3A基因的表达,说明rhIFN-α2b发挥的免疫调控作用可能与A3A基因的表达有关。此外,研究中HPV11.HaCaT细胞和HeLa细胞显示出在A3A表达水平,以及不同浓度rhIFN-α2b刺激组各时间点A3A的变化趋势不完全一致,延长rhIFN-α2b作用时间后并不能诱导A3A的持续高表达,推测该现象是否因为HPV可能通过病毒编码蛋白的免疫干扰作用而改变A3A的表达,具体机制有待进一步探讨。
A3A蛋白在细胞有丝分裂过程中大部分时期主要限制在胞质中发挥抗病毒作用,而当细胞处于有丝分裂末期,胞质和胞核中均有分布[12]。本研究通过激光共聚焦显微镜发现,正常HaCaT细胞中A3A蛋白主要分布于胞质中,携带HPV11的HaCaT细胞和HPV18转化的Hela细胞在胞质和胞核中均能见到A3A蛋白表达,尤其在处于分裂状的细胞能见到胞核中A3A蛋白分布明显增多,与文献报道一致[12];3种细胞中都能观察到rhIFN-α2b诱导的A3A蛋白表达增加,尤其在106IU/ml rhIFN-α2b刺激下,胞质和胞核中的A3A蛋白均增多。

图2 免疫荧光染色观察不同浓度rhIFN-α2b刺激6 h后APOBEC3A在HaCaT、HPV11.HaCaT、Hela细胞中表达情况(激光共聚焦显微镜×400) 106IU/ml rhIFN-α2b刺激组与空白对照组比较,A3A分布于胞质和胞核中,表达增加。蓝色为DAPI染色液标记,表示核区;绿色为Alexa Flour 488标记,表示APOBEC3A;两种荧光共聚焦重合后为浅蓝色,表示分布到核内APOBEC3A。2A:HaCaT细胞;2B:HPV11.HaCaT细胞;2C:Hela细胞
[1]Stanley MA.Genital human papillomavirus infections:current and prospective therapies[J].J Gen Virol,2012,93(Pt 4):681-691.DOI:10.1099/vir.0.039677-0.
[2]Nordenvall C,Chang ET,Adami HO,et al.Cancer risk among patients with condylomata acuminata[J].Int J Cancer,2006,119(4):888-893.DOI:10.1002/ijc.21892.
[3]Friis S,Kjaer SK,Frisch M,et al.Cervical intraepithelial neoplasia,anogenital cancer,and other cancer types in women after hospitalization for condylomata acuminata.J Infect Dis,1997,175(4):743-748.DOI:10.1086/513966.
[4]Goodman A.HPV testing as a screen for cervical cancer[J].BMJ,2015,350:h2372.DOI:10.1136/bmj.h2372.
[5]Sheehy AM,Gaddis NC,Choi JD,et al.Isolation of a human gene that inhibits HIV-1 infection and is suppressed by the viral Vif protein[J].Nature,2002,418 (6898):646-650.DOI:10.1038/nature00939.
[6]Wang Y,Li X,Song S,et al.Development of basal-like HaCaT keratinocytes containing the genome of human papillomavirus(HPV)type 11 for screening of anti-HPV effects[J].J Biomol Screen,2014,19(8):1154-1163.DOI:10.1177/1087057114536987.
[7]Wang Z,Wakae K,Kitamura K,et al.APOBEC3 deaminases induce hypermutation in human papillomavirus 16 DNA upon beta interferon stimulation[J].J Virol,2014,88(2):1308-1317.DOI:10.1128/JVI.03091-13.
[8]王永芳,李新宇,宋莎莎,等.携带HPV11型基因组细胞3维培养模型的建立及其衣壳蛋白L1的表达[J].中国艾滋病性病,2010,16(2):105-108.DOI:10.13419/j.cnki.aids.2010.02.003.Wang YF,Li XY,Song SS,et al.Establishing of three-dimensional culture model by HaCaT keratinocytes carrying HPV11 genome and expression of HPV11 major capsid protein L1 in the model[J].Chin J AIDS STD,2010,16 (2):105-108.DOI:10.13419/j.cnki.aids.2010.02.003.
[9]Vartanian JP,Guétard D,Henry M,et al.Evidence for editing of human papillomavirus DNA by APOBEC3 in benign and precancerous lesions[J].Science,2008,320 (5873):230-233.DOI:10.1126/science.1153201.
[10]Stifter SA,Feng CG.Interfering with immunity:detrimental role of type I IFNs during infection[J].J Immunol,2015,194(6):2455-2465.DOI:10.4049/jimmunol.1402794.
[11]Mohanram V,Sköld AE,Bächle SM,et al.IFN-α induces APOBEC3G,F,and A in immature dendritic cells and limits HIV-1 spread to CD4+T cells[J].J Immunol,2013,190(7):3346-3353.DOI:10.4049/jimmunol.1201184.
[12]Lackey L,Law EK,Brown WL,et al.Subcellular localization of the APOBEC3 proteins during mitosis and implications for genomic DNA deamination[J].Cell Cycle,2013,12 (5):762-772.DOI:10.4161/cc.23713.
Expressions of APOBEC3s in HaCaT keratinocytes carrying the genome of human papillomavirus type 11 and regulatory effects of interferon-alpha on the expressions
Wang Yongfang,Li Xinyu,Song Shasha,Sun Yang
Pharmacal Research Laboratory,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
ObjectiveTo investigate mRNA expressions of apolipoprotein B mRNA-editing enzyme catalytic polypeptide-like 3 family(APOBEC3s or A3s)as well as expressions and subcellular distribution of major A3 proteins in HaCaT keratinocytes carrying the genome of human papillomavirus type 11 (HPV11.HaCaT),and to evaluate regulatory effects of exogenous interferon-alpha (IFN-α)on the expressions of A3s.MethodsThe basal levels of A3A,A3B,A3C and A3H mRNA expressions were measured by real-time fluorescence-based quantitative PCR (qRT-PCR)in HPV11.HaCaT cells and normal HaCaT cells.Cultured HaCaT,HPV11.HaCaT and Hela cells were treated with recombinant human IFN-α 2b (rhIFN-α2b)at concentrations of 104,105and 106IU/ml for 6,24 and 48 hours separately,and those receiving no treatment served as the normal control groups.Then,qRT-PCR was performed to measure mRNA expressions of A3A,A3B,A3C and A3H in these cells.Immunofluorescence staining was conducted to observe the expression and distribution of A3A protein in cells after the treatment with rhIFN-α2b for 6 hours.ResultsAs qRT-PCR showed,the basal levels of A3A,A3B and A3C mRNA expressions were all significantly higher in HPV11.HaCaT cells than in normal HaCaT cells(allP<0.05).After stimulation,the mRNA expressions of the four A3 members increased to different extents with the increase in rhIFN-α2b concentrations,and the increase in A3A mRNA was the most significant.Compared with corresponding normal control groups,the mRNA expression of A3A was significantly increased in HaCaT cells(35.77±5.01 vs.1.00±0.05,P<0.05),HPV11.HaCaT cells(15.34±2.14 vs.0.99±0.01,P<0.05)and Hela cells(24.60±5.45 vs.0.97±0.03,P<0.05)after the treatment with rhIFN-α2b at 106IU/ml for 6 hours,while the increase in A3B,A3C and A3H mRNA expressions was no more than 9-fold in these cell lines after that.Enhanced staining for A3A was observed in nuclei and cytoplasm of the 3 cell lines after the treatment with rhIFN-α2b at 106IU/ml for 6 hours.ConclusionsHPV11 transfected into HaCaT cells can activate intracellular A3s,especially A3A.IFN-α may play an immunoregulatory role by inducing high levels of A3A expression.
Condyloma acuminata;Interferon-alpha;Keratinocytes;Apolipoproteins B;Apolipoprotein B mRNA-editing enzyme catalytic polypeptide-like 3 family
Li Xinyu,Email:xinyusli609@163.com
2015-07-16)
(本文编辑:吴晓初)
李新宇,Email:xinyusli609@163.com
10.3760/cma.j.issn.0412-4030.2016.02.003
北京协和医学院协和青年基金和中央高校基本科研业务费专项资金(33320140050)
Fund program:PUMC Youth Fund and the Fundamental Research Funds for the Central Universities(33320140050)
