水体中磺胺甲恶唑的存在及其毒性研究机理
2016-11-04卜兆宇俞世霖
卜兆宇,俞世霖
(1. 扬州市建筑设计研究院有限公司,江苏 扬州 225000, 2.河海大学,江苏 南京210008)
水体中磺胺甲恶唑的存在及其毒性研究机理
卜兆宇1,俞世霖2
(1. 扬州市建筑设计研究院有限公司,江苏 扬州 225000, 2.河海大学,江苏 南京210008)
通过实验对太湖水体中的磺胺甲恶唑进行研究,探究磺胺甲恶唑的存在浓度,并且结合静态暴露实验,研究磺胺甲恶唑对斑马鱼的代谢毒性作用,对水环境中磺胺甲恶唑的安全浓度设置具有重要的指导作用。
磺胺甲恶唑;浓度;斑马鱼;代谢毒性
抗生素类物质是目前使用较多的一种药物,并且在常规水体中被频繁检出,对生态环境与人类健康造成了巨大的威胁[1]。目前,抗生素类物质开始引起广大学者的广泛关注,在现有水环境中检出的抗生素类药物中,磺胺类药物的检出频率最高[2]。磺胺类药物是一种广泛使用的抗菌药,由合成氨苯磺胺类结构物质衍生而成,广泛应用于预防和治疗一类感染性疾病。由于磺胺类药物的大量使用,水体中磺胺类物质的浓度明显升高。在这类磺胺类药物中,磺胺甲恶唑的水环境检出浓度最高,能达到200 ng/L。目前针对中国太湖流域磺胺甲恶唑的浓度研究相对较少,并且针对磺胺甲恶唑进行毒性研究的资料更少。因此,针对水环境中的磺胺甲恶唑的存在浓度及生物毒性进行研究十分必要[3]。
本次实验针对江苏太湖水环境中的磺胺甲恶唑浓度进行研究,并且采用斑马鱼作为模式动物,在实验中进行静态染毒实验,综合研究磺胺甲恶唑对斑马鱼的代谢系统毒性作用。
1 材料与方法
1.1实验材料
本次实验所采用的斑马鱼为德国Tubingen品系,均由南京大学模式动物研究所斑马鱼实验室提供。在实验过程中,斑马鱼的养殖参照Westerfield在1995年所发表的斑马鱼饲养方法:斑马鱼养殖照明条件为14 h光照、1 h黑暗交替进行;养殖水温控制在28.5±1℃;水体每隔3 h进行曝气充氧,保证水体中的溶解氧量为5 mg/L以上;pH控制在7.02~7.25;总硬度采用德国度计,控制在8.02~8.15[4]。抗生素磺胺甲恶唑(符合国家标准物质)购买于中国药品检定所。在静态染毒实验中,斑马鱼的培养液参照Zebra fish Book进行配置[5]。其中,磺胺甲恶唑采用助溶剂DMSO助溶(终浓度<0.1%),斑马鱼的代谢酶(GST、MDA、CAT、SOD)采用代谢酶试剂盒进行测定,均购于南京建成生物工程研究所。
1.2实验方法
1.2.1水体中磺胺甲恶唑的检测方法
本次实验针对江苏太湖水体中的磺胺甲恶唑进行检测,采用定位检测的方法,针对太湖东西南北侧设定4个检测点进行取样检测,所取水样在48 h内进行测定,每个检测点采取三个平行样,每个样品进行三次检测,保证检测精度。
实验采用Waters公司Oasis HLB 6cc (500 mg, Waters, USA)对水样进行萃取浓缩,并且采用安捷伦公司超高清液相色谱仪(1260)与三重四级杆质谱仪(6460)对浓缩液中的磺胺甲恶唑进行检测,具体浓缩与检测步骤参照Yan等人的方法[6],检测回收率为84±2.1%,检测限为1.6 ng/L。磺胺甲恶唑检测条件如表1所示。

表1 磺胺甲恶唑检测条件
1.2.2静态染毒实验设计
考虑到大浓度下的暴露实验会放大生物毒性效应便于有毒物质的研究,在本次针对磺胺甲恶唑的静态染毒实验中,按照等比例区间进行浓度设置,在实验中设置五组浓度梯度与一组空白对照,即0、10 μg/L、50 μg/L、100 μg/L、500 μg/L、1 mg/L。实验中,在相同暴露条件下的特定检测时间段对6组中的斑马鱼酶活性进行检测。经研究,暴露期限为7 d,特定检测时间为暴露1 d后、暴露3 d后、暴露7 d后。
1.2.3代谢酶活性测定
本次实验酶活性均采用南京建成生物工程研究所酶活性试剂盒进行测定,具体操作参照试剂盒说明。其中,GST酶测定参照Habig的方法、MDA含量测定参照硫代巴比妥酸的方法、CAT酶测定参照Gott的方法、SOD酶测定参照Marklund的方法[7]。同时,采用综合酶活性统计法对四种酶活性进行加权统计,便于综合反应磺胺甲恶唑的生物毒性作用,具体统计步骤参照Beliaeff的方法[8]。
1.2.4数据分析
实验数据分析采用生物毒理学专用分析软件Graph pad Prism5.0进行。实验结果表示采用平均值±标准误差(Mean±SD)形式,数据用单尾检验法进行比较,p<0.05为显著差异。
2 结果与讨论
2.1水体中磺胺甲恶唑的存在浓度
为了检测太湖水中磺胺甲恶唑的存在浓度,我们在太湖东(E)西(W)南(S)北(N)四个方向进行取样,对水样中的磺胺甲恶唑进行检测,检测结果见图1所示。
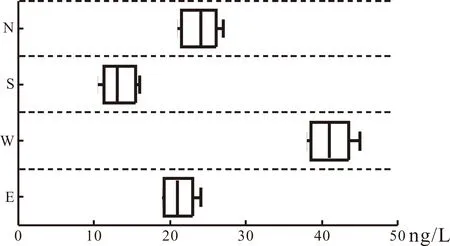
图1 不同取样点处磺胺甲恶唑的浓度
由图1可以看出:在太湖四个方向水样中的磺胺甲恶唑浓度各有差异。其中太湖西部水样中的磺胺甲恶唑的平均浓度为41 ng/L,最高检出浓度达到了最高达到了45 ng/L;太湖北侧水样,磺胺甲恶唑平均浓度为24 ng/L,最高检出浓度达到了27 ng/L;太湖东侧水样,磺胺甲恶唑平均浓度为21 ng/L,最高检出浓度达到了24 ng/L。检出浓度最低的是太湖南侧水样,磺胺甲恶唑平均浓度为13 ng/L,最高检出浓度达到了16 ng/L。
经调查发现,在太湖西侧,工业企业众多,且均有制药厂分布,大量的生产废水经内部小型污水处理装置收集处理后直接排入大湖中。由于常规处理工艺并不能对这类药物进行完全去除,因此造成了西部水体中的磺胺甲恶唑浓度较高。同时,采样点西部多为水湾地区,由于水湾的封闭性作用,并不能促进水体进行交换,从而导致水体中的磺胺甲恶唑累积,最终导致该处的磺胺甲恶唑浓度较高。
在太湖北部和东部,虽然工业企业较多,并且水湾较多。由于太湖北部有大量的水生植物生态修复区,水体中的水生植物有着发达的根系,会对水体中的抗生素进行吸收,起到水体净化作用,因此北部水体中磺胺甲恶唑的浓度比西部低。同时在太湖的东部地区,为了保证太湖水源质量,政府在太湖东部进行了引长江水进太湖水的工程,长江具有极强的水体流动性与交换性,大量的长江水引入会促进太湖东部地区水体发生交换,最终提高了东部的水质,降低了该地区的磺胺甲恶唑的浓度。
太湖南部,工艺企业较少,且与东部、西部、北部工业区相距较远,水体的流动性与稀释性导致此处的磺胺甲恶唑浓度相比其他三个地区最低,并且此处岸线平滑、少水湾、污染物累积作用较弱,因此该处的水质相对较好。
通过以上研究发现,太湖水体中的磺胺甲恶唑浓度最高出现在太湖西侧,最高达到了45 ng/L。同时,生态修复区的建立与引水工程的实施会对水体中的污染物进行净化,保证水体的优良水质。
2.2磺胺甲恶唑对斑马鱼单一代谢酶活性的影响
为研究磺胺甲恶唑对水体生物的代谢毒性作用,采用斑马鱼作为模式动物,研究静态暴露下的磺胺甲恶唑对斑马鱼的代谢酶的毒性作用,实验结果见图2。
由图2可以看出,随着暴露浓度与暴露的增加,斑马鱼体内的四种代谢酶活性均发生额了不同变化。GST酶产生了先上升后下降的趋势并且在第3天酶活性达到最大值;MDA含量也产生了先上升后下降的趋势并且在第3天酶活性达到最大值;CAT酶活性随着暴露时间与浓度的升高不断下降,并且在第7天达到最低值;SOD酶活性与GST、MDA酶趋势相同,并且在第3天酶活性达到最大值。
GST酶活性在生物代谢系统去除生物体内具有毒性、致突变、致癌性的亲电子时有着不可或缺的作用[9]。GST酶可以促进生物体内释放三肽谷胱甘肽,并且促进三肽谷胱甘肽与以内的外源性物质相互结合,最终促进这类物质排出生物体内。由图2可以看出,在暴露实验的第3天,GST酶达到最大值,随后浓度降低,这可能是因为在暴露第3天磺胺甲恶唑对斑马鱼代谢酶进行诱导,而在第7天斑马鱼体内适应了磺胺甲恶唑的代谢毒性。
MDA含量通常用来判断体内外源性物质对代谢系统的毒性作用,其可直接反应体内细胞膜受到的毒性作用[10]。由图2可以看出,MDA酶在第3天达到最大值,可能是因为在暴露第三天磺胺甲恶唑对斑马鱼的代谢毒性作用最大。而在暴露第7天MDA的含量降低,回归第一天的含量,可能是因为斑马鱼体内的代谢酶对磺胺甲恶唑产生了代谢作用,最终降低了磺胺甲恶唑对细胞的代谢作用。
CAT酶和SOD酶是同阶段的代谢酶,对外源性物质在斑马鱼体内产生的自由基有着重要的去除作用,并且两者之间具有重要的联系[11-12]。当斑马鱼体内产生自由基时,SOD酶会对斑马鱼体内的超氧化物阴离子自由基团产生歧化作用,转化为氧化作用相对较低的过氧化氢。随后,CAT酶会对过氧化氢发生作用,促进体内的过氧化氢转化为氧气和水,最终实现代谢系统内的自由基的去除。由实验结果可以看出:在暴露的第3天斑马鱼体内的SOD浓度明显上升,这是由于体内的自由基浓度上升对SOD酶产生了诱导作用,而在第7天SOD浓度下降,这是因为体内自由基被逐渐转化,浓度降低。而CAT酶一直处于降低的状态,这可能因为斑马鱼体内的过氧化氢浓度较高,CAT酶负荷过大,产生了抑制作用。
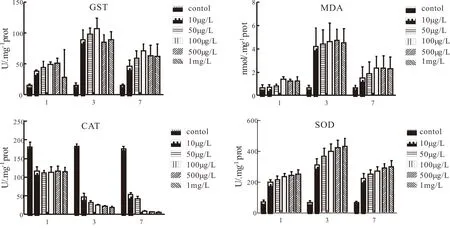
图2 磺胺甲恶唑对斑马鱼单一酶活性作用
2.3磺胺甲恶唑对斑马鱼综合代谢酶活性的影响

图3 磺胺甲恶唑对斑马鱼综合酶活性作用
为综合探究磺胺甲恶唑对斑马鱼代谢系统的综合毒性作用,对斑马鱼体内的单一代谢酶活性结果进行了综合统计分析,结果见图3。由图3可以看出:在暴露的7 d内,磺胺甲恶唑对斑马鱼的代谢毒性作用在暴露第3天最为强烈,且随着暴露的浓度增加,综合酶活性指标逐渐增加。磺胺甲恶唑对斑马鱼体内代谢系统的生物毒性作用随着暴露浓度的增加而增加,并且磺胺甲恶唑的代谢毒性在染毒第3天作用最为强烈,应该引起重视。
3 结论
(1)在太湖水样中,太湖西部水样中的磺胺甲恶唑浓度最高,太湖南部水样中的磺胺甲恶唑浓度最低,经研究发现生态修复工程与引水工程会降低水体中磺胺甲恶唑的浓度。
(2)通过代谢酶活性实验发现磺胺甲恶唑会对斑马鱼的代谢系统产生毒性作用,因此值得后期实验进行深入研究。
(3)通过综合酶活性分析发现,磺胺甲恶唑的代谢毒性作用在暴露的第3天作用最为强烈,并且随着暴露浓度的上升,综合活性指标逐渐变大。因此,磺胺甲恶唑的代谢毒性作用应当受到研究者重视。
[1]Sun Q,Li M H,Ma C.,et al.Seasonal and spatial variations of PPCP occurrence,removal and mass loading in three wastewater treatment plants located in different urbanization areas in Xiamen,China [J].Environ.Pollut,2016,208:371-381.
[2]Brown KD,Kulis J,Thomson B,et al.Occurrence of antibiotics in hospital,residential,and dairy,effluent,municipal wastewater,and the Rio Grande in New Mexico.[J].Sci Total Environ,2006,366:772-783.
[3]Daughton C G,Ternes T A,Pharmaceuticals and personal care products in the environment:agents of subtle change[J].Environ.Health Perspec.1999,107:907-938.
[4]Westerfield M.The zebrafish book.A guide for the laboratory use of zebrafish (Danio rerio).3rd Edition[M].Eugene:University of Oregon Press,1995.
[5]Hallare A,Nagel K,K hler HR.Comparative embryotoxicity and proteotoxicity of three carrier solvents to Zebrafish (Daniorerio) embryos [J].Ecotoxicol Environ Saf,2006,63(3):378-388.
[6]Yan Z H,Yang X F,Lu G H,et al.Potential environmental implications of emerging organic contaminants in Taihu Lake,China:comparison of two ecotoxicological assessment approaches.[J].Sci.Total Environ.2014,470-471:171-179.
[7]Yu S L,Lin T,Chen W,Tao H.The toxicity of a new disinfection by-product,2,2-dichloroacetamide (DCAcAm),on adult zebrafish (Danio rerio) and its occurrence in the chlorinated drinking water.[J].Chemosphere,2015,139:40-46
[8]Beliaeff B,Burgeot T.Integrated biomarker response:a useful tool for ecological risk assessment.Environ.Toxicol.[J].Chem.2002,21:1316-1322.
[9]Huang D J,Zhang Y M,Song G,et al.Contaminantsinduced oxidative damage on the carp Cyprinus carpio collected from the upper Yellow River,China.[J].Environ.Monit.Assess.2007,128:483-488.
[10]Yang F,Zhang J,Chu W H,Yin D Q,Templeton M R.Haloactamides versus halomethanes formation and toxicity in chloraminated drinking water.J.Hazard.Mater.[J].2014,274:156-163.
[11]Liu J C,Lu G H,Wang Y H,et al.Bioconcentration,metabolism,and biomarker responses in freshwater fish Carassius auratus exposed to roxithromycin.[J].Chemosphere 2014,99:102-108.
[12]Valavanidis A,Vlahogianni T,Dassenakis M,Scoullos M.Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants.Ecotoxicol.[J].Environ.Saf.2006,64:178-189.
Occurrence of sulfamethoxazole in aquatic environment and its toxicity on zebrafish
BO Zhao-yu1,YU Shi-lin2
(1.YangzhouArchitecturalDesign&ResearchInstituteCo.,Ltd,Yangzhou225000,China;2.HohaiUniversity,Nanjing210008,China)
This experiment studied the sulfamethoxazole concentration and the metabolic toxicity of sulfamethoxazole on zebrafish in Taihu.The results of this study would provide a better reference for safe concentration setting towards sulfamethoxazole.
sulfamethoxazole;concentration;zebrafish;metabolic toxicity
2016-04-07
卜兆宇(1982—),江苏扬州人,硕士,工程师。
1674-7046(2016)05-0078-05
10.14140/j.cnki.hncjxb.2016.05.014
X171. 1
A
