慢病毒介导过表达端粒酶逆转录酶的人口腔黏膜上皮稳定细胞系的构建
2016-11-04曾飒秦晓东何祥一车春晓张潇解斯羽孙贵军王立鹤
曾飒秦晓东何祥一车春晓张潇解斯羽孙贵军王立鹤
1.兰州大学口腔医学院;2.中国农业科学院兰州兽医研究所,兰州 730000
·基础研究·
慢病毒介导过表达端粒酶逆转录酶的人口腔黏膜上皮稳定细胞系的构建
曾飒1秦晓东2何祥一1车春晓1张潇1解斯羽1孙贵军1王立鹤1
1.兰州大学口腔医学院;2.中国农业科学院兰州兽医研究所,兰州 730000
目的 通过慢病毒法建立稳定表达外源性人端粒酶逆转录酶(hTERT)基因的口腔黏膜上皮细胞(OMECs),探索构建高效、稳定的永生化OMECs细胞系的方法。方法 提取293T细胞总RNA,应用聚合酶链反应(PCR)法扩增hTERT基因全长,构建重组慢病毒载体pLVX-puro-hTERT。包装慢病毒颗粒后感染人正常OMECs,经嘌呤霉素抗性筛选获得阳性克隆,采用实时荧光定量PCR法和Western blot法检测hTERT基因mRNA和蛋白的表达水平。结果成功构建了pLVX-puro-hTERT过表达慢病毒载体并感染到OMECs中;感染细胞与正常OMECs形态相似,呈铺路石样生长;实时荧光定量PCR和Western blot结果均显示,hTERT在感染细胞中高表达,与正常细胞相比差异有统计学意义(P<0.05)。结论 通过慢病毒法成功建立了过表达hTERT的OMECs稳定细胞系,为构建高效、稳定增殖的人永生化OMECs细胞系奠定了实验基础。
口腔黏膜上皮细胞; 人端粒酶逆转录酶; 慢病毒载体; 稳定表达; 永生化
大多数口腔黏膜疾病的病因复杂,致病机制不详。为进一步研究口腔黏膜上皮细胞(oral mucosa epithelial cells,OMECs)多因素、多步骤致病机制,建立人永生化OMECs细胞系是非常必要的。正常情况下,OMECs在体外仅能传代培养5~6代,无法满足研究需求。有学者[1]对人永生化OMECs细胞系进行了探索,如采用16型人乳头状瘤病毒E6和E7诱导培养永生化口腔黏膜上皮细胞系,但培养的细胞大小不均一,而且会出现双核、多核、畸形核细胞,结果不甚理想。
研究[2]证明,端粒酶激活及上调是细胞永生化和恶性转化的先决条件。外源性人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)在正常的OMECs中不表达或表达微弱,而在上皮发育不良及癌变过程中表达逐渐增强,提示hTERT可能是口腔黏膜上皮细胞癌变的标志物,导入外源性hTERT基因有可能使正常体细胞出现永生化[3]。相对于传统的永生化基因,端粒酶转染建立的永生化细胞是正常细胞而非转化细胞,具有正常的核型和生长速度[4-5]。研究[6]表明,利用逆转录病毒载体将外源性hTERT导入OMECs,可获得稳定增殖的永生化细胞系;但逆转录病毒载体侵染效率低,稳定性差[7-8]。随着基因技术的发展,建立一种高效细胞永生化载体成为口腔医学研究的迫切需求。
本研究旨在通过慢病毒介导法建立过表达hTERT基因的OMECs稳定细胞系,为构建高效、稳定增殖的人永生化OMECs细胞系奠定基础,进而为口腔黏膜疾病,尤其是癌变机制的研究提供体外可靠的实验模型。
1 材料和方法
1.1 材料和试剂
慢病毒表达载体pLVX-puro、慢病毒包装质粒pMD2.G、包膜蛋白质粒psPAX2、包装细胞293T细胞株均为中国农科院兰州兽医研究所保存。Rochel逆转录试剂盒(Rochel公司,美国),Platinum Pfx DNA Polymerase高保真DNA聚合酶和Zero Blunt TOPO聚合酶链式反应(polymerase chain reaction,PCR)平端克隆试剂盒(Invitrogen公司,美国),GeneJet PCR纯化、胶回收试剂盒(Thermo Scientific公司,美国),质粒小量提取试剂盒(OMEGA公司,美国),RNeasy Mini Kit试剂盒和Effectene Transfection Reagent转染试剂盒 (Qiagen公司,德国);EpiGRO™ Human Epidermal Keratinocyte Complete Medium Kit培养基、Dispase Ⅱ(Merck Millipore公司,德国),限制性内切酶(New England Biolab公司,美国),hTERT多克隆抗体(Proteintech公司,美国),胎牛血清(Gibco公司,美国)。上下游引物合成及DNA测序由北京华大基因公司完成。
1.2 pLVX-puro-hTERT重组慢病毒载体的构建
按照RNeasy Mini Kit试剂盒操作步骤从人293T细胞中提取总RNA。用Rochel逆转录试剂盒逆转录获得cDNA。根据NCBI(NM_198253.2)hTERT基因cDNA序列设计引物,上游引物:5’- CTAGGCTAGCATGCCGCGCGCTCCCCGCT-3’;下游引物:5’-CTAGAATTCTCAGTCCAGGATGGTCTTGAAGTCT-3’。在上游引物添加了NheⅠ酶切位点及保护碱基,在下游引物添加了EcoRⅠ酶切位点及保护碱基。参照高保真 DNA 聚合酶Platinum Pfx DNA Polymerase说明书,采用PCR法特异性扩增hTERT基因编码序列。1%琼脂糖凝胶电泳分析结果,得到大小约为3.3×103bp的条带,与平端克隆载体pCR™-Blunt Ⅱ-TOPO按比例连接,室温下反应5 min,连接产物转化Trans-T1感受态细胞,使用质粒小量提取试剂盒说明抽提质粒,用XhoⅠ酶切鉴定,并送往北京华大基因公司测序。将测序正确的质粒稀释后作为模板,上下引物分别加上酶切位点NheⅠ及EcoRⅠ,经PCR反应得到目的片段并纯化,用限制性内切酶NheⅠ和EcoRⅠ双酶切目的基因及慢病毒表达载体pLVX-puro,切胶回收后按比例连接,行双酶切初步鉴定,将鉴定为阳性的质粒送华大基因公司测序。
1.3 表达hTERT基因重组慢病毒质粒的获得
转染前1 d,将293T细胞传代于2个60 mm培养皿中,24 h后待细胞面积达培养皿的70%~80%时即可用于转染。2个培养皿分别用于转染pLVX-purohTERT和空质粒pLVX-puro。按照脂类转染剂Effectene Transfection Reagent说明书将载体质粒、慢病毒包装质粒pMD2.G、包膜蛋白质粒psPAX2共转染293T细胞进行病毒包装,48 h收集病毒。4 ℃下用800 r·min-1离心5 min,用0.45 µm滤器过滤分装后,于-80 ℃保存备用。
1.4 人正常OMECs的分离和培养
无菌条件下取唇裂整复术中切除的多余口腔黏膜组织 (患儿年龄为3个月,患儿家长知情同意)。用50 mL含1%双抗的PBS液反复冲洗5遍,用眼科剪除去黏膜下组织,剪成约2 mm×1 mm的小块,置于2.5 g·L-1DispaseⅡ酶中,4 ℃过夜消化18 h,用眼科镊分离上皮层,PBS冲洗上皮层,将上皮剪切成小片加入混合消化液中(0.25%胰酶与0.02%乙二胺四乙酸等体积混合液),37 ℃消化7 min,加胎牛血清终止消化,用吸管反复吹打至成单细胞悬液。800 r·min-1离心5 min,弃上清液,加入无血清培养基Human Epidermal Keratinocyte Complete Medium Kit,接种于25 cm2培养瓶中,倒置培养3 d,当原代细胞汇合率达70%~80%时,用0.25%胰蛋白酶与0.02%乙二胺四乙酸等体积混合消化液消化并以1∶2的比例传代。
1.5 慢病毒感染OMECs及抗性筛选
收获对数生长期的正常OMECs,于3个25 cm2培养瓶中将OMECs按1∶2的密度消化传代,待细胞长至占培养瓶面积的60%时,弃旧培养液,分别加入3 mL病毒上清液,轻混匀,12 h后更换新鲜培养基,同时加入5 g·mL-1嘌呤霉素进行抗性筛选,同时以转染空载体pLVX-puro的细胞和未转染细胞作为对照。3~4 d后,对照组细胞开始大面积死亡时,筛选浓度减半,约7 d后,转染组细胞形成细胞集落,将筛选出的阳性克隆转移至48孔板,然后逐步扩大培养。
1.6 实时荧光定量PCR检测hTERT mRNA相对表达量
提取P7代阳性细胞总RNA,用逆转录试剂盒逆转录为cDNA。基因引物设计如下。hTERT引物,上游引物:5’-TCTGGGATGCGAACGGGC,下游引物:TCCGGCTCAGGGGCAGC-3’;内参照磷酸甘油醛脱氢酶( glyceraldehyde phosphate dehydrogenase,GAPDH)引物,上游引物:5’-GGAGTCCACTGGCGTCTTC-3’,下游引物:5’-GCTGATGATCTTGAGGCTGTTG-3’。按照Thermo Scientific DyNAmo Flash SYBR Green qPCR Kit试剂盒说明进行实时荧光定量PCR扩增,与正常细胞组作对照。每个基因重复3次,其相对表达量均以GAPDH的量作为内参照,采用2-ΔΔCt法进行计算。
1.7 hTERT蛋白的Western blot检测
提取P7代阳性细胞总蛋白,同时以正常上皮细胞组为对照,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),转膜,于含5%脱脂乳的TBST中4 ℃封闭1 h,加入一抗hTERT(1∶1 000稀释),4 ℃培养过夜;使用TBST洗涤3次,再加入羊抗鼠二抗(1∶5 000 稀释),作用1 h,TBST洗涤3次,电化学发光( electrochemiluminescence,ECL)技术增强显色试剂盒显色,X线片曝光,扫描分析。
1.8 统计学分析
采用SPSS 13.0统计软件进行单因素方差分析,组间比较采用t检验,检验水准为双侧α=0.05。
2 结果
2.1 hTERT基因的克隆
采用PCR扩增目的基因片段hTERT,经1%琼脂糖凝胶电泳分析,可见3.3×103bp处有一条亮带,与目的条带大小基本一致(图1)。
2.2 hTERT基因重组质粒双酶切鉴定及测序结果
重组质粒pLVX-puro-hTERT经NheⅠ和EcoRⅠ双酶切鉴定后,可在3.3×103bp处得到一条亮带(图2),将测序结果与NCBI数据库hTERT(NM_198253.2)cDNA序列进行对比分析,与目的序列一致;表明重组慢病毒载体pLVX-puro-hTERT构建成功。

图 1 hTERT基因的扩增结果Fig 1 Amplification results of hTERT gene

图 2 pLVX-puro-hTERT的双酶切鉴定Fig 2 Identification of pLVX-puro-hTERT by double enzyme digestion
2.3 转染后细胞形态及表型
倒置相差显微镜下观察可见,转染hTERT后的OMECs与正常OMECs的形态相似,为多角形,呈铺路石状排列,具有典型的上皮细胞特征(图3A、B);转染空载体后的细胞形态较不规则(图3 C)。传代4~5代后,未转染细胞和转染空载体的细胞生长缓慢,逐渐死亡,而转染hTERT后的OMECs仍生长迅速,增殖稳定。
2.4 实时荧光定量PCR检测转染后OMECs中hTERT mRNA的相对表达量
实时荧光定量PCR检测结果显示,hTERT mRNA在转染细胞中高表达,其表达水平大约是对照组细胞的11倍,与正常OMECs中hTERT mRNA相对表达量的差异有统计学意义(P<0.05,图4)。该结果表明,慢病毒介导的hTERT 基因片段已稳定整合到OMECs的基因组中并高表达。

图 3 细胞的形态特征 倒置相差显微镜 × 100Fig 3 Morphological characteristics of cells inverted phase contrast microscope × 100
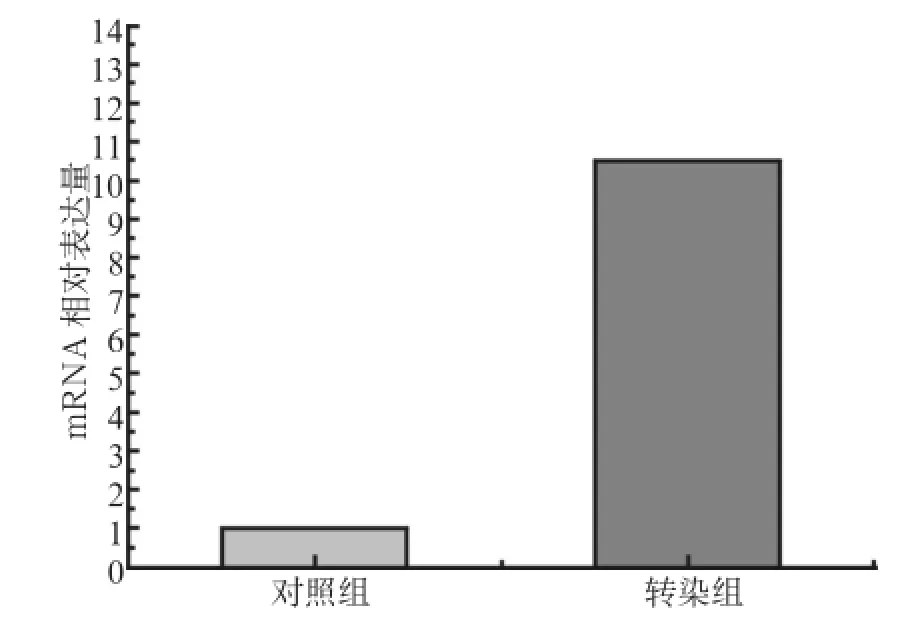
图 4 实时荧光定量PCR检测转染后OMECs中hTERT mRNA的相对表达量Fig 4 The relative expression of hTERT mRNA in infected OMECs by real-time fluorescent quantitative PCR
2.5 hTERT蛋白的Western blot检测结果
Western blot检测结果显示,在转染细胞组中hTERT蛋白成功表达,与正常细胞组的差异有统计学意义(P<0.05,图5);说明目的基因hTERT已成功整合入靶细胞的基因组并可进行翻译。

图 5 Western blot鉴定OMECs中hTERT蛋白的表达Fig 5 Identification of OMECs with stable expression of hTERT by Western blot
3 讨论
正常OMECs在体外培养困难,条件要求苛刻[9]。目前大多使用角化细胞培养液Keratinoeyte-SFM培养OMECs[10]。本研究用德国Merck Millipore公司提供的Human Epidermal Keratinocyte Complete Medium Kit无血清培养基培养,成功分离培养了原代OMECs,无成纤维细胞混杂,原代细胞接种3 d后即可长满培养皿,细胞形态均一,排列密集,呈铺路石样生长,符合上皮细胞体外培养的形态特征,且生长迅速。该结果证实了这一培养基可在短期内获得大量具有增殖能力的OMECs,能够满足后续实验需求。
OMECs永生化的难度较大。应用普通逆转录病毒载体介导的最主要缺陷在于无法感染非分裂期细胞,表达的目的基因常常随时间的延长而发生丢失;另外,还存在容纳外源基因片段小,难以兼容多个启动子,易受到转录沉默影响等缺点,导致感染效率较低,稳定性较差[7-8],这在很大程度上限制了其应用。
慢病毒载体是以人类免疫缺陷病毒-1为来源的一种新型病毒载体,携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞,实现外源基因在细胞或活体组织中的表达。Ramboer等[7]比较了各种永生化肝细胞的方法,发现采用慢病毒介导的方法可以解决普通逆转录病毒载体介导的缺点。其特点是,在高病毒滴度下可感染分裂期细胞和非分裂期细胞并且不会影响正常细胞表型;在感染能力方面,对一些较难转染的细胞(如原代细胞等),使用慢病毒载体,能将目的基因高效整合于宿主基因组内,从而实现外源基因长期、稳定的表达[11]。这些优点是腺病毒和其他普通逆转录病毒载体无法达到的。本研究利用慢病毒介导的优势,采用慢病毒法感染OMECs,为探索构建永生化OMECs打下了一定的基础。hTERT cDNA全长3 398 bp,且GC含量高,基因扩增难度较大。本研究对常规扩增方法加以改进,以293T细胞cDNA作模板,使用TOPO平端克隆技术,高效、快捷地获得了目的基因片段。重组质粒双酶切鉴定及测序结果对比证实,本研究成功构建了过表达慢病毒载体pLVX-puro-hTERT。
用包装成功的pLVX-puro-hTERT慢病毒感染正常OMECs,倒置相差显微镜下观察感染细胞形态及表型可见与正常OMECs无明显的差异,并且细胞生长活跃。实时荧光定量PCR和Western blot检测结果说明hTERT在感染细胞组中高表达,经反复冻存和复苏并且连续传代培养后的细胞仍然能够稳定表达hTERT,与正常细胞组相比的差异具有统计学意义(P<0.05),证实过表达hTERT的OMECs稳定细胞系构建成功。这进一步证实了外源性 hTERT 基因导入细胞后可提高细胞的端粒酶活性,延缓了细胞的衰老[12]。本研究中,细胞已经突破衰老危机,已连续传至10代,在一定程度上表明该细胞系具备了永生化潜能,本课题组后续还将对转基因细胞持续传代,并进行生物学性状检测和裸鼠成瘤等实验,以全面鉴定其永生化的生物特性。
总之,本研究采用高效且能稳定整合于宿主基因组的慢病毒载体作为骨架载体,成功建立了过表达hTERT基因的OMECs稳定细胞系,为构建高效、稳定增殖的人永生化OMECs细胞系奠定了基础,另外,这种方法也为永生化其他组织来源的细胞提供了便利,有良好的科研应用价值。
[1] 张志愿, 帕提曼·司地克, 曹俊, 等. 16型人乳头状瘤病毒E6、E7诱导的人永生化口腔上皮细胞系的建立[J]. 中华口腔医学杂志, 2002, 37(1):12-14.
Zhang ZY, Patima S, Cao J, et al. Establishment of human immortalized oral epithelial cell line HIO615 induced by HPV16 E6 and E7[J]. Chin J Stomatol, 2002, 37(1):12-14.
[2] Teral K, Yilmazer A. New surprises from an old favourite: the emergence of telomerase as a key player in the regulation of cancer stemness[J]. Biochimie, 2016, 121:170-178.
[3] Bodnar AG, Ouellette M, Frolkis M, et al. Extension of lifespan by introduction of telomerase into normal human cells [J]. Science, 1998, 279(5349):349-352.
[4] Cao H, Chu Y, Zhu H, et al. Characterization of immortalized mesenchymal stem cells derived from foetal porcine pancreas [J]. Cell Prolif, 2011, 44(1):19-32.
[5] Moffatt-Jauregui CE, Robinson B, de Moya AV, et al. Establishment and characterization of a telomerase immortalized human gingival epithelial cell line[J]. J Periodont Res, 2013, 48(6):713-721.
[6] 陈之锋, 吕标, 郑超群, 等. hTERT诱导永生化口腔黏膜上皮细胞株的建立[J]. 中国口腔颌面外科杂志, 2013, 11 (2):91-96.
Chen ZF, Lü B, Zheng CQ, et al. Establishment of immortalized oral mucosal epithelial cell strain by human telomerase reverse transcriptase[J]. Chin J Oral Maxillofac Surg, 2013, 11(2):91-96.
[7] Ramboer E, De Craene B, De Kock J, et al. Strategies for immortalization of primary hepatocytes[J]. J Hepatol, 2014, 61(4):925-943.
[8] Lois C, Hong EJ, Pease S, et al. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors[J]. Science, 2002, 295(5556):868-872.
[9] 石虹, 陈安玉. 人牙龈上皮细胞原代培养的实验研究[J]. 华西口腔医学杂志, 1994, 12(1):53-55.
Shi H, Chen AY. Primary culture of human gingival epithelial cells[J]. West Chin J Stomatol, 1994,12(1):53-55.
[10] 王翔, 高文信, 王莉, 等. 口腔黏膜上皮细胞体外培养的影响因素分析及改进方法[J]. 华西口腔医学杂志, 2007, 25(1):79-82.
Wang X, Gao WX, Wang L, et al. Influential factor analysis and improvement of cultural method of oral mucosal epithelial cells[J]. West Chin J Stomatol, 2007, 25(1):79-82.
[11] Kafri T, van Praag H, Gage FH, et al. Lentiviral vectors: regulated gene expression[J]. Mol Ther, 2000, 1(6):516-521.
[12] Chung SA, Wei AQ, Connor DE, et al. Nucleus pulposus cellular longevity by telomerase gene therapy[J]. Spine, 2007, 32(11):1188-1196.
(本文采编 王晴)
Construction of human mucosa oral epithelial cell lines overexpressing telomerase reverse transcriptase gene mediated by lentivirus
Zeng Sa1, Qin Xiaodong2, He Xiangyi1, Che Chunxiao1, Zhang Xiao1, Xie Siyu1, Sun Guijun1,Wang Lihe1.
(1. School of Stomatology, Lanzhou University, Lanzhou 730000, China; 2. Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730000, China)
Supported by: Natural Science Foundation of Gansu Province (1308RJZA248). Correspondence: He Xiangyi, E-mail: hexy@ lzu.edu.cn.
Objective To construct a cell line of oral mucosa epithelial cells that stably express human telomerase reverse transcriptase (hTERT) by lentiviral vectors, approaches for the establishment of stable and efficient immortalized oral mucosa epithelial cell lines were explored. Methods Whole RNA was extracted from 293T cells. The hTERT gene was amplified by polymerase chain reaction (PCR) and cloned into the lentiviral vector as pLVX-puro-hTERT. The lentivirus particles were successfully packaged and used to infect primary oral epithelial cells. The positive cell clones were selected by puromycin. Finally, the expression of hTERT was examined by real-time fluorescent quantitative PCR (qRT-PCR) and Western blot analysis. Results The sequencing results confirmed the construction of the recombinant lentivirus pLVX-puro-hTERT. The morphology of infected cells was similar to that of normal oral mucosal epithelial cells, with a cobble stone-like appearance. The qRT-PCR and Western blot results showed that hTERT was overexpressed in infected cells compared with the normal group (P<0.05). Conclusion The oral epithelial cell line with stable expression of hTERT was successfully established by the lentivirus, which provides an experimental basis for the establishment of a highly efficient and stable oral epithelial immortalized cell line.
oral mucosa epithelial cells; human telomerase reverse transcriptase; lentivirus; stable expression; immortalization
Q 813
A [doi] 10.7518/hxkq.2016.05.002
2016-04-15;
2016-07-12
甘肃省自然科学基金(1308RJZA248)
曾飒,硕士,E-mail:zengs13@lzu.edu.cn
何祥一,教授,博士,E-mail:hexy@lzu.edu.cn
