基于席夫碱键的可注射糖肽水凝胶的制备及性能
2016-11-03何婉莹段莉洁于双江高光辉
赵 麒, 何婉莹, 段莉洁, 张 瑜, 于双江, 高光辉
(1. 长春工业大学化学工程学院高分子化学与物理系, 长春 130012;2. 中国科学院长春应用化学研究所, 生态环境高分子材料重点实验室, 长春 130022)
基于席夫碱键的可注射糖肽水凝胶的制备及性能
赵麒1,2, 何婉莹1, 段莉洁1, 张瑜2, 于双江2, 高光辉1
(1. 长春工业大学化学工程学院高分子化学与物理系, 长春 130012;2. 中国科学院长春应用化学研究所, 生态环境高分子材料重点实验室, 长春 130022)
以氧化葡聚糖(ODEX)和聚赖氨酸-聚乙二醇-聚赖氨酸(PLL24-PEG-PLL25)三嵌段聚合物为前驱体, 通过ODEX中的醛基与PLL中的氨基之间的席夫碱键反应, 制备了ODEX/PLL24-PEG-PLL25水凝胶. 研究了其凝胶强度、 降解时间及对阿霉素(DOX)释放量的影响. 结果表明, 随着ODEX中醛基密度的增加, 凝胶强度逐渐增大, 最大强度为3100 Pa. 流变学研究结果表明, 由于ODEX中的醛基与DOX中的氨基存在席夫碱键作用, 导致凝胶强度从2160 Pa降至1730 Pa. 降解实验结果表明, ODEX/PLL24-PEG-PLL25水凝胶具有较长的降解时间, 最长时间达到29 d. 药物释放结果表明, ODEX/PLL24-PEG-PLL25水凝胶具有酶促降解释放药物的性能. 在Elastase溶液中, ODEX/PLL24-PEG-PLL25水凝胶所载DOX累积释放量达到最大值74.35%. 结果表明, ODEX/PLL24-PEG-PLL25水凝胶具有进一步应用于体内局部药物传输的潜力.
氧化葡聚糖; 聚赖氨酸; 酶响应; 可注射糖肽水凝胶; 控制释放; 席夫碱
化学交联凝胶是高分子链间通过共价键交联而形成的三维网络结构. 常见的化学交联方式包括光交联[1]、 自由基聚合[2~5]、 酶交联反应[6~9]及点击化学反应[10~13]. 但这类凝胶存在成胶速率较慢及凝胶引发剂有毒性等缺点, 限制了其在生物体内的应用. 近年来, 基于羰基与氨基缩合成亚氨键(席夫碱键)交联反应型凝胶的研究屡见报道[14~17]. 利用这种化学键的特性, Deng等[18]合成了三重醛基改性的2-(羟甲基)-2-甲基丙烷-1,3-二醇作为交联剂, 与聚乙二醇的酰肼衍生物(NH2NH-PEG-NHNH2)反应制得了具有良好可恢复特性的水凝胶. Patenaude等[19]分别合成了酰肼功能化和醛基功能化的聚N-异丙基丙烯酰胺(PNIPAM)寡聚物, 并将这2种功能化的PNIPAM以等质量比共混后, 形成的水凝胶在25~37 ℃之间具有良好的可恢复性. Wu等[20]分别合成了醛基功能化的四臂聚乙二醇(4-arm PEG-FA)和四臂-聚乙二醇-聚-L-赖氨酸星型嵌段共聚物(PPLL), 并将这2种聚合物以不同的体积比混合后形成水凝胶, 在pH值为7.4, 6.8和6.0的PBS溶液中具有不同的降解速率. 这类基于席夫碱的反应具有反应简单高效、 副产物为水及不需要额外引入引发剂等特点, 但关于凝胶的pH响应及温度响应报道较多, 而关于酶响应的报道较少.
葡聚糖是一类有良好生物相容性和可降解性的天然多糖[21,22], 糖环中含有大量—OH, 通过将部分—OH氧化为—CHO作为化学结合位点, 与聚合物中—NH2键合形成席夫碱键, 具有反应活性高及交联度精细可控的特点. Miano等[23]研究了氧化葡聚糖(ODEX)与聚乙烯亚胺(PEI)水凝胶在抗菌方面的应用效果, PEI是具有高电荷密度的有机大分子, 对化脓性链球菌具有很好的杀伤效果, 但高电荷密度使PEI具有很强的细胞毒性. 氧化葡聚糖具有良好生物相容性, 将ODEX与PEI通过席夫碱键合, 形成ODEX/PEI凝胶, 在降低PEI的毒性的同时具有很好的杀菌效果.
聚赖氨酸(PLL)是一种微生物代谢产物, 易溶于水, 可降解为赖氨酸. Wu等[24]设计了一种氨基酸基纳米凝胶注射型水凝胶作为药物传输体系, 带负电荷的聚乙二醇-b-聚谷氨酸(PPLG)与带正电荷的羟丙基壳聚糖/聚乙二醇-b-聚赖氨酸(HPCS/PPLL)通过离子交联; 同时带醛基的胆固醇修饰的氧化葡聚糖(OCDEX)纳米凝胶与带氨基的HPCS/PPLL间发生基于席夫碱键反应形成物理化学交联水凝胶; 通过担载白介素-2、 干扰素-γ和阿霉素进行肺癌的治疗, 实验结果表明, 这种载药体系可以更高效率地抑制肿瘤, 降低体内的药物副作用.
本文用聚赖氨酸(PLL)对聚乙二醇(PEG)侧基进行修饰, 得到PLL24-PEG-PLL25三嵌段型聚合物, 再与氧化葡聚糖(ODEX)共聚, 制备了具有化学交联的ODEX/PLL24-PEG-PLL25水凝胶; 考察了水凝胶的强度和降解时间及阿霉素在凝胶体系中的释放情况.
1 实验部分
1.1试剂与仪器
葡聚糖(Mw=100000, 分析纯)、 聚乙二醇(PEG,Mn=2000, 分析纯)、 盐酸阿霉素(DOX·HCl, 生物试剂)和噻唑蓝(MTT, 生物试剂), Sigma-Aldrich公司;N6-苄氧羰基-L-赖氨酸环内酸酐[L-Lys(CBZ)-NCA, 分析纯], 成都蒽莱生物科技有限公司; 高碘酸钠和盐酸羟胺(分析纯), 百灵威化学试剂; 对甲苯磺酰氯(PTSC, 分析纯), 国药基团化学试剂有限公司; 其它试剂均为分析纯, 北京化工厂.
德国Bruker公司Bruker AM-400M型核磁共振(1H NMR)仪, 分别将PLL24-PEG-PLL25和ODEX溶于氘代氯仿(CDCl3)或氘代重水(D2O)中, 以0.01%(体积分数)四甲基硅烷(TMS)为内标, 扫描84次; 美国Bio-Rad公司Bio-Rad Win-IR型傅里叶变换红外光谱(FTIR)仪, 溴化钾压片, 扫描范围4000~500 cm-1; 美国Micrion公司Micrion FEI PHILIPS型场发射扫描电子显微镜(SEM); 奥地利Anton Paar公司Anton Paar@Physica MCR 301流变仪, 将300 μL混合溶液置于流变仪底板上, 采用直径为25 mm平板转子, 在37 ℃下进行测试, 测试距离为0.5 mm, 应变幅度1%, 频率1 Hz.
1.2PLL24-PEG-PLL25, ODEX和ODEX/PLL24-PEG-PLL25水凝胶的制备
将40 g PEG用200 mL二氯甲烷充分溶解, 依次加入19.2 g对甲苯磺酰氯(PTSC)和5.6 g氢氧化钾, 搅拌72 h后倒入分液漏斗, 用50 mL蒸馏水洗涤, 分液后产物在二氯甲烷溶液中, 用MgSO4于室温干燥12 h, 用乙醚沉降, 室温下真空干燥12 h后得到聚合物CH3-Ph-SO2-PEG-SO2-Ph-CH3. 将20 g CH3-Ph-SO2-PEG-SO2-Ph-CH3用500 mL氨水充分溶解, 加入20 g氯化铵, 于25 ℃反应96 h后, 向反应液中加入200 g氯化钠, 用CH2Cl2萃取, 用MgSO4于室温干燥12 h后, 用乙醚沉降, 室温下真空干燥12 h得到聚合物NH2-PEG-NH2. 将1 g NH2-PEG-NH2加入100 mL干燥的甲苯中, 于130 ℃共沸除水2 h, 用真空泵抽干甲苯; 依次加入40 mL干燥的DMF和31 gL-Lys(CBZ)-NCA, 于30 ℃反应72 h后用乙醚沉降, 真空干燥得到浅黄色聚合物PLL24-b-PEG-b-PLL25; 将PLL24-b-PEG-b-PLL25用30 mL三氟乙酸(TFA)溶解后加入6 mL氢溴酸(HBr)反应1 h后, 装入透析袋中, 在去离子水中透析72 h后冻干, 得到PLL24-PEG-PLL25.
将10 g葡聚糖用200 mL二次蒸馏水充分溶解, 分别加入6.65, 4.44和3.33 g高碘酸钠(NaIO4), 蔽光室温反应1.5 h, 装入透析袋中, 在去离子水中透析72 h, 得到氧化度分别为51.8%, 36.6%和24%的ODEX, 分别命名为ODEX 1, ODEX 2和ODEX 3. ODEX的氧化度与醛基含量通过盐酸羟胺法测定[25], ODEX中醛基与盐酸羟胺反应, 生成化合物肟的同时释放一分子盐酸, 通过测定酸碱滴定测定pH值可以间接测出ODEX的氧化度和醛基含量.
将PLL24-PEG-PLL25和ODEX分别溶于PBS(pH=7.4)缓冲溶液中, 浓度均为200 mg/mL. 用1 mol/L HCl调节PLL24-PEG-PLL25的pH值为7.4. 凝胶总体积设定为500 μL, ODEX 1, ODEX 2, ODEX 3和PLL24-PEG-PLL25溶液体积比分别为362∶138, 400∶100和410∶90, 将2种溶液放入小玻璃瓶中混合, 通过涡旋仪振荡10 s后于37 ℃静置; 通过倒置法观察凝胶成胶时间, 3种凝胶成胶的时间分别为15, 130和256 s. 根据ODEX氧化度, ODEX/PLL24-PEG-PLL25凝胶分别命名为Gel1, Gel2和Gel 3. 将0.5 mg DOX加入88 μL(200 mg/mL) PLL24-PEG-PLL25溶液中, 充分溶解, 加入402 μL(200 mg/mL) ODEX溶液置于小玻璃瓶中, 用涡旋仪振荡10 s, 于37 ℃静止5 min, 得到载药凝胶Gel 3+DOX.
1.3体外降解实验
用Tris(pH=7.4)缓冲溶液溶解Elastase, 酶的活力为5 U/mL. 以Elastase溶液作为实验组, PBS(pH=7.4)缓冲溶液作为对照组, 各吸取5 mL分别加入到ODEX/PLL24-PEG-PLL25凝胶中, 在37 ℃及75 r/min的恒温摇箱中进行降解实验; 按照预定时间, 用滤纸吸干小玻璃瓶中降解后的溶液, 称重后加入相同体积降解溶液; 每组3个平行样. 凝胶质量剩余率(%)=(mt/m0)×100(其中,mt表示凝胶降解后净质量,m0表示凝胶初始质量).
1.4体外药物释放
用Tris(pH=7.4)缓冲溶液溶解Elastase和Proteinase K, 酶活力为5 U/mL. 分别以PBS(pH=7.4)、 Elastase溶液、 Proteinase K溶液(以下酶溶液均按上述方法配制)作为释放介质, 每个玻璃瓶加入量为5 mL. 将Gel 3+ DOX凝胶置于37 ℃及75 r/min的恒温摇箱中, 开始释放实验, 按照预定时间, 取出释放降介质3 mL, 加入相同体积新鲜释放介质. 阿霉素的释放浓度通过荧光光谱仪测定, 所有实验平行进行3次.
2 结果与讨论
2.1PLL24-PEG-PLL25, ODEX和ODEX/PLL24-PEG-PLL25的合成及表征
用NH2-PEG-NH2引发L-Lys(CBZ)-NCA的开环聚合, 得到了PLL24-b-PEG-b-PLL25嵌段聚合物, PLL24-b-PEG-b-PLL25在CF3COOH/HBr体系中脱去苄基, 得到PLL24-PEG-PLL25单体; 用高碘酸钠氧化葡聚糖, 得到ODEX, 合成路线如Scheme 1 所示.
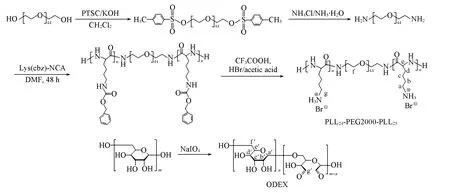
Scheme 1 Synthesis routes of PLL24-PEG2000-PLL25 and ODEX
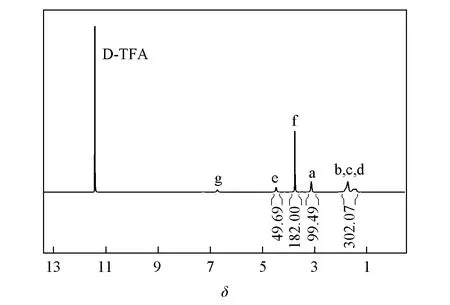
Fig.1 1H NMR of PLL24-PEG-PLL25
图1给出PLL24-PEG-PLL25的1H NMR谱. 由图1可见,δ3.64~3.72处为PEG亚甲基的吸收峰,δ3.18~3.42处为嵌段链中赖氨酸邻近氨基的亚甲基对应氢的特征吸收峰;δ1.48~1.91处为亚甲基对应氢的特征吸收峰. 对a和f特征峰进行积分, 可得到PLL聚合度为49, 由于PEG两端同时引发聚合, 因此PLL链节数分别为24和25, 表明合成了PLL24-PEG-PLL25.
图2给出ODEX的1H NMR谱图. 烷基氢谱呈单峰分布(δ4.72~4.89), 而糖环上其它氢谱以多重峰的形式出现(δ3.31~3.82); 醛基特征峰为δ9.54~9.69, 说明葡聚糖中羟基被氧化成醛基.
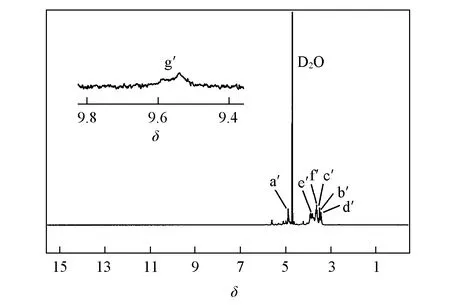
Fig.2 1H NMR of ODEX
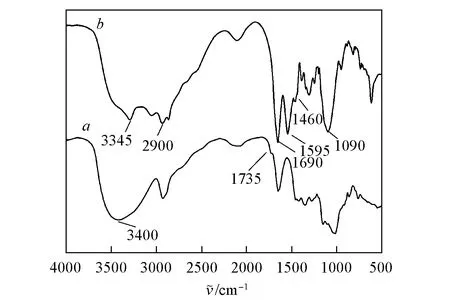
Fig.3 FTIR spectra of ODEX(a) and ODEX/PLL24-PEG-PLL25(b)
图3给出ODEX和ODEX/PLL24-PEG-PLL25的红外光谱. 图3谱线a中, 特征吸收峰分别为羟基(3400 cm-1)及非醛基上的羰基(1670 cm-1). 图3谱线b中, 2900, 1330和1460 cm-1处分别对应PEG上C—H 的伸缩振动吸收峰和弯曲振动吸收峰;在1090 cm-1处出现PEG醚键伸缩振动峰; 在3345, 1595 cm-1处出现PLL中N—H的伸缩振动峰和弯曲振动峰, 证明合成了PLL24-PEG-PLL25. 对比 ODEX/PLL24-PEG-PLL25和ODEX的红外光谱可知, ODEX/PLL24-PEG-PLL25中 1735 cm-1处的羰基特征吸收峰消失, 在1690 cm-1处出现亚胺基特征吸收峰, 说明凝胶单体通过席夫碱反应形成水凝胶. 由于凝胶所形成的交联网络限制了PLL24-PEG-PLL25分子链的运动, 导致反应不完全, 在3345和1595 cm-1处出现了氨基特征吸收峰.
2.2席夫碱键水凝胶的制备和表征
以ODEX和PLL24-PEG-PLL25为前驱体制备水凝胶, 通过计算使ODEX中醛基与PLL中氨基等摩尔混合, 形成水凝胶. 制备过程如Scheme 2所示.
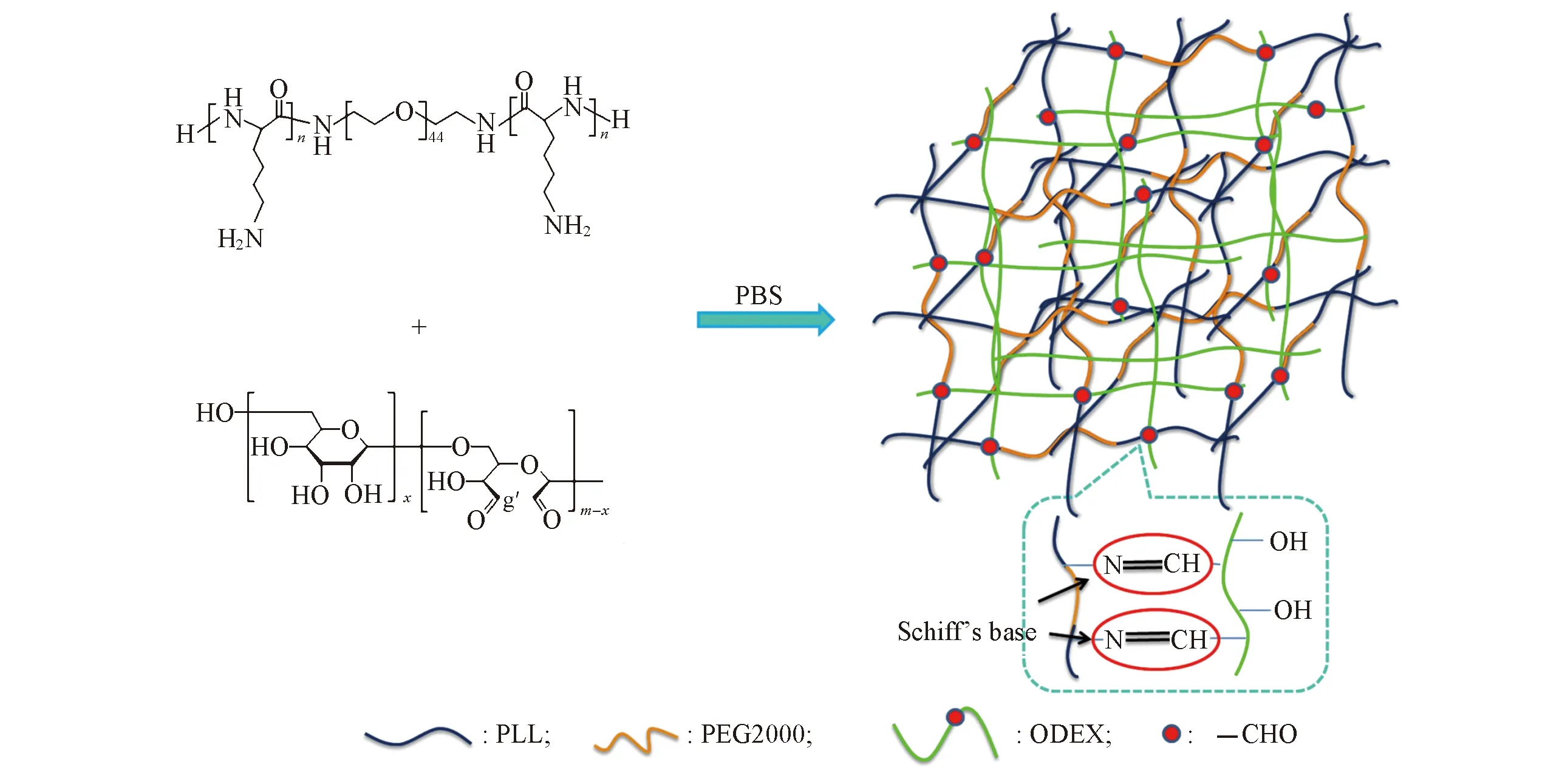
Scheme 2 Formation graphic statement of PLL24-PEG-PLL25/ODEX hydrogels
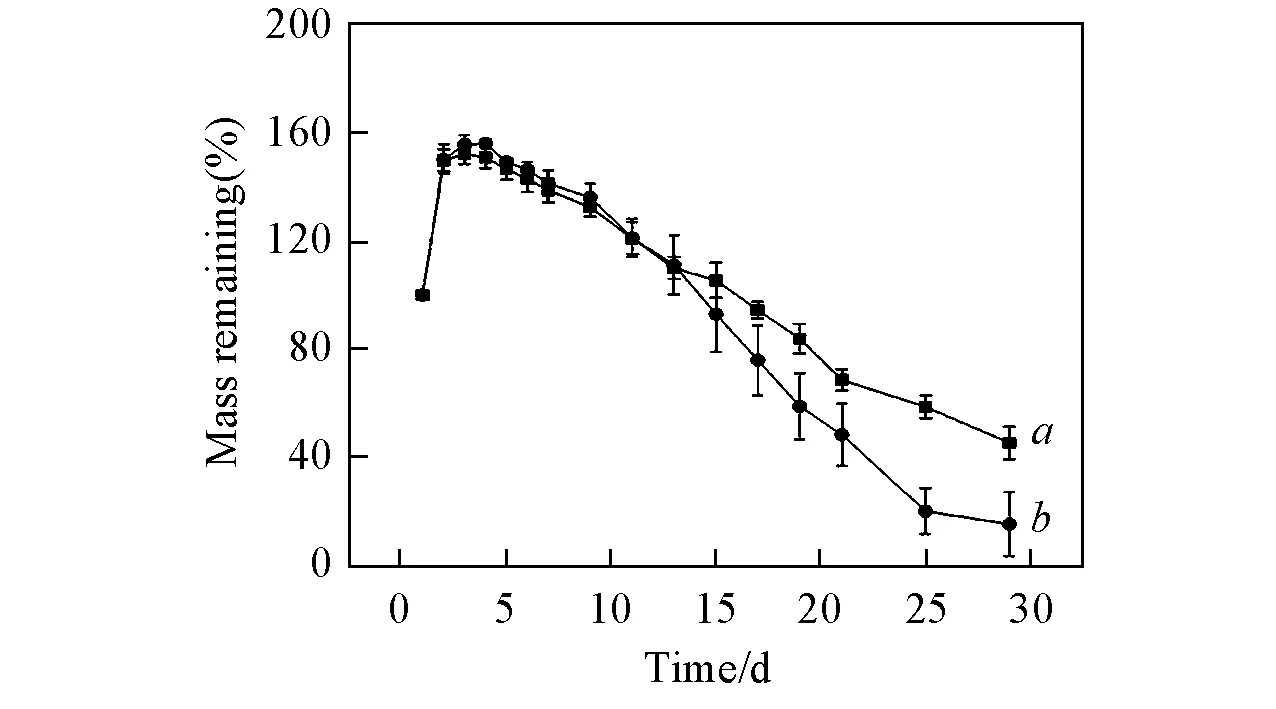
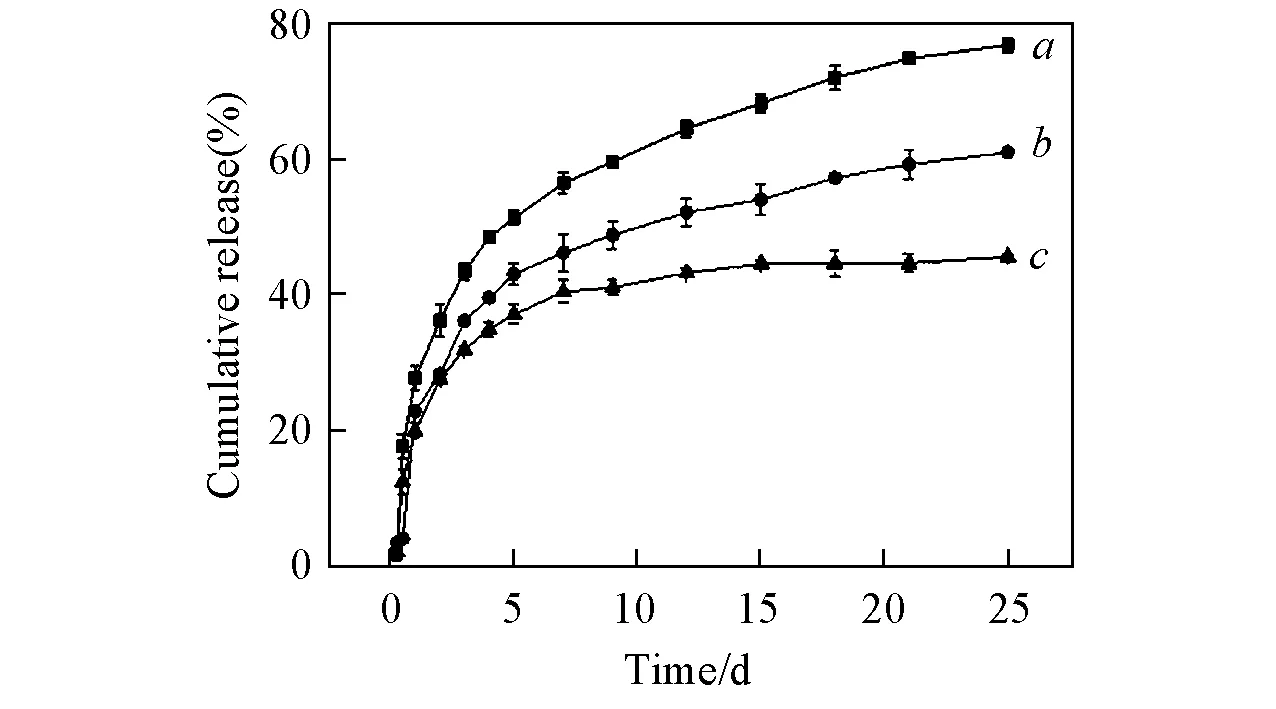
在ODEX制备过程中, 通过控制Dextran/NaIO4投料比, 制备了3种不同氧化度的ODEX. 在相同浓度下, 凝胶成胶时间逐渐减小, 即tGel 1 Fig.4 SEM images of Gel 3(A, C) and Gel 3+DOX(B, D) Insets:optical images of Gel 3(C) and Gel 3+DOX(D). 从图4(D)可见, 凝胶孔径变大, 尺寸在4 μm左右, 这是由于DOX中含有氨基, 与ODEX的醛基形成席夫碱键, 减小了PLL中氨基与ODEX中醛基接触概率, 导致凝胶孔径变大, 从图4(D)插图可以看出, Gel 3+DOX在常温状态下呈红色. 2.3席夫碱键水凝胶的流变学性能 Fig.5 Storage modulus G′ of gels a. Gel 1; b. gel 2; c. gel 3. Fig.6 Storage modulus G′(a, b) and loss modulus G″(c, d) of Gel 3(a, c) and Gel 3+DOX(b, d) 2.4Gel 3+DOX的降解性能 以Elastase溶液作为降解质溶液, PBS(pH=7.4)缓冲溶液作为对照组, 研究了Gel 3+DOX凝胶体外降解行为. Gel 3+DOX凝胶在降解过程中质量变化是其溶胀行为和降解行为共同作用的结果. 由图7可见, 凝胶呈现出高溶胀的特点, Gel 3+DOX凝胶在Elastase溶液中质量增长达到最大值, 质量变化率达到155%; 而Gel 3+DOX凝胶在PBS缓冲溶液中溶胀情况低于在Elastase溶液中溶胀情况, 质量变化率为152%; 在溶胀15 d时, Gel 3+DOX凝胶开始降解, 从质量剩余率可以推算出Gel 3+DOX凝胶Elastase溶液中降解速度快; 在溶胀29 d时, Gel 3+DOX凝胶质量剩余达到17%, 说明Gel 3+DOX凝胶具有酶促降解的特点. Fig.7 In vitro degradation test of Gel 3+DOX hydrogels carried out with PBS(a) and Elastase(b) at 37 ℃ Fig.8 Release profile of Gel 3+DOX from Elastase(a), Proteinase K(b), PBS(c) at 37 ℃ over 21 d 2.5药物的体外释放 分别采用Elastase和Proteinase K溶液作为体外模拟药物释放环境, 以PBS缓冲溶液为对照组, 进行模拟体外释放, 结果如图8所示. 实验结果证明, DOX在Elastase和Proteinase K溶液中累积释放量明显优于对照组PBS溶液中阿霉素的释放量. 25 d后, DOX的累积释放量分别达到74.35%, 69.30%及49.91%, 显示出Gel 3凝胶具有酶促降解的特点. 药物释放检测呈现出早期释放快, 后期释放慢的特点. 由于药物释放曲线受到分子扩散和网络降解两个因素控制, 释放初期, 部分药物未键合到ODEX中, DOX通过分子运动从凝胶孔隙扩散到降解质溶液中, 释放较快; 随着凝胶降解, DOX通过席夫碱键水解缓慢释放出来, 达到了缓慢控制释放的目的. 采用化学改性方法制备了ODEX与PLL24-PEG-PLL25聚合物, 通过席夫碱键键合作用, 在不外加交联剂的条件下制备ODEX/PLL24-PEG-PLL25水凝胶. 由于ODEX氧化度不同, 导致凝胶交联点数目不同, 因此凝胶成胶时间也不同. 当ODEX氧化度为24.0%时, 成胶时间为256 s, 满足体内注射条件. SEM结果显示凝胶孔完整性好, 孔壁厚, 孔径为20 μm. ODEX/PLL24-PEG-PLL25水凝胶对小分子药物DOX具有键合作用, 且这种载药水凝胶具有酶促降解释放药物的特性, 其中在Elastase溶液中DOX释放量最大, 累积释放量达到74.35%. 表明Gel 3水凝胶具有作为抗癌药物输送及缓释的优点, 有望作为抗癌药物载体获得应用. [1]Beebe D. J., Moore J. M., Yu Q., Liu R. H., Devadoss C., Jo B. H.,Nature, 2000, 404, 588—590 [2]Teixeira L. S. M., Feijen J., van Blitterswijk C. A., Dijkstra P. J., Karperien M.,Biomaterials, 2012, 33(5), 1281—1290 [3]Ferreira L., Vidal M., Geraldes C., Gil M.,CarbohydratePolymers, 2000, 41(1) , 15—24 [4]Giammona G., Pitarresi G., Cavallaro G., Spadaro G.,JournalofBiomaterialsScience,PolymerEdition, 1999, 10(9), 969—987 [5]Jun I., Park K. M., Lee D. Y., Park K. D., Shin H.,MacromolecularResearch, 2011, 19(9), 911—920 [6]Zhu K. Q., Wei H. L., He J. Y., Qian L. J., Hou D. D., Zhang A. Y., Feng Z. G.,Chem.J.ChineseUniversities, 2005, 26(11), 2160—2164(朱凯强, 魏宏亮, 何吉宇, 钱立军, 候丹丹, 张爱英, 冯增国. 高等学校化学学报, 2005, 26(11), 2160—2164) [7]Giammona G., Tomarchio V., Pitarresi G., Cavallaro G.,Polymer, 1997, 38(13), 3315—3323 [8]Fukuoka T., Uyama H., Kobayashi S.,Biomacromolecules, 2004, 5(3), 977—983 [9]Jin R., Hiemstra C., Zhong Z., Jan. F.,Biomaterials, 2007, 28(18), 2791—2800 [10]Lee F., Chung J. E., Kurisawa M.,SoftMatter, 2008, 4(4) , 880—887 [11]Crescenzi V., Francescangeli A., Taglienti A.,Biomacromolecules, 2002, 3(6), 1384—1391 [12]Mather B. D., Viswanathan K., Miller K. M., Long T. E.,ProgressinPolymerScience, 2006, 31(5), 487—531 [13]Polizzotti B. D., Fairbanks B. D., Anseth K. S.,Biomacromolecules, 2008, 9(4), 1084—1087 [14]Lin Y. W., Chen Q., Luo H. B.,Chem.J.ChineseUniversities, 2007, 28(1), 183—187(林友文, 陈庆, 罗红斌. 高等学校化学学报, 2007, 28(1), 183—187) [15]Xin Y., Yuan J.,PolymerChemistry, 2012, 3(11), 3045—3055 [16]Zhang H., Qadeer A., Chen W.,Biomacromolecules, 2011, 12(5), 1428—1437 [17]Gong C., Qi T., Wei X.,CurrentMedicinalChemistry, 2013, 20(1), 79—94 [18]Deng G., Tang C., Li F., Jiang H., Chen Y.,Macromolecules, 2010, 43(3), 1191—1194 [19]Patenaude M., Hoare T.,ACSMacro.Letters, 2012, 1(3), 409—413 [20]Wu X. L., He C. L., Wu Y. D., Chen X.S.,Biomaterials, 2016, 75, 148—162 [21]Klouda L., Mikos A. G.,EuropenJournalofPharmaceuticsandBiopharmaceutics, 2008, 68(1), 34—45 [22]Jeong B., Bae Y. H., Kim S. W.,JournalofControlledRelease, 2000, 63(1/2), 155—163 [23]Giano M. C., Medina S. H. Z. I., Sarhane K.A.,NatureCommunications, 2014, 5, doi:10.1038/ncomms5095 [24]Wu X. L., He C. L., Wu Y. D.,AdvancedFunctionalMaterials, 2015, 25(43), 6744—6755 [25]Ma S. D., Liu L., Liu B. G., Li M. C., Liang D. S., Yu F.,ChinaPrac.Med., 2008, 3(3), 14—15(马守栋, 刘莉, 刘邦国, 李明春, 梁东升, 俞发. 中国实用医药, 2008, 3(3), 14—15) [26]Ren K. X., He C. L., Cheng Y. L., Xiao C. S., Gao L., Chen X. S.,PolymerChemistry, 2014, 5(17), 5069—5076 (Ed.:W, Z) † Supported by the National Natural Science Foundation of China(No. 21204081). Fabrication and Characterization of Injectable Polysaccharide-polypeptide Hydrogel Based on Schiff’s Base† ZHAO Qi1,2, HE Wanying1, DUAN Lijie1*, ZHANG Yu2, YU Shuangjiang2, GAO Guanghui1 (1. Department of Polymer Chemistry and Physics, School of Chemical Engineering,ChangchunUniversityofTechnology,Changchun130012,China;2.KeyLaboratoryofPolymerEco-materials,ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun130022,China) The purpose of gel is applied to body with no toxic. Based on dextran, oxidized dextran(ODEX) with the different oxidation extent was prepared. At the same time, the tri-block polymers poly(lysine)-polyethylene glycol-poly(lysine)(PLL24-PEG-PLL25) was synthesized, which becomes hydrogels through the reaction between the dextran aldehyde groups and the poly-L-lysine amino groupsviaSchiff’s base formation. The storage modulus, degradation time of gel, and release of doxorubicin(DOX) were characterized. The results showed that gel strength increased gradually with the increasing density of aldehyde in ODEX, and the maximum storage modulus was 3100 Pa. The rheological test indicates that the storage modulus was reduced from 2160 Pa to 1730 Pa, due to the Schiff’s effect between ODEX aldehyde group and DOX amine group. The gel had a long degradation time up to 29 d. Drug release studies showed that DOX released from carrier gel was triggered by the enzyme. In Elastase solution, DOX release rate had reached up to 74.35%. The findings reveal that the hydrogel have promising applications in drug deliveryinvivo. Oxidized dextran; Polylysine; Enzyme response; Injectable polysaccharide-polypeptide hydrogel; Controlled release; Schiff’s base 10.7503/cjcu20160088 2016-02-02; 网络出版日期:2016-08-26. 国家自然科学基金(批准号:21204081)资助. O631 A 联系人简介:段莉洁, 女, 博士, 副教授, 主要从事生物医用高分子材料研究. E-mail:duanlijie@ccut.edu.cn
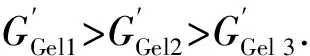
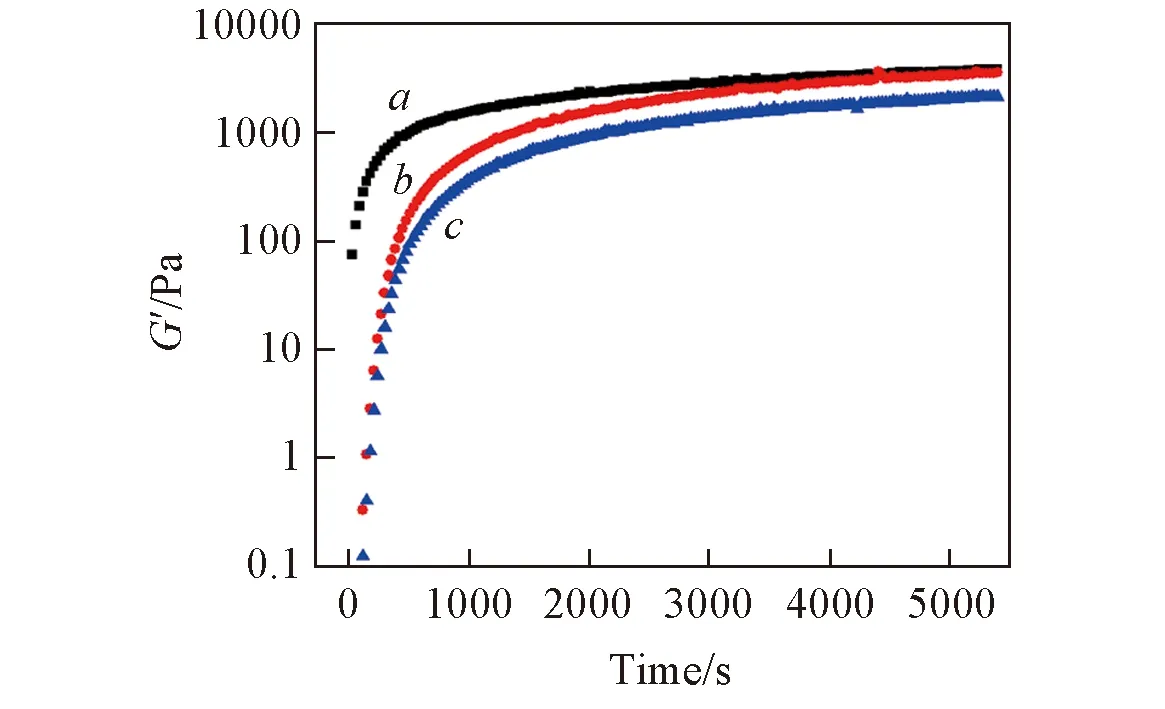
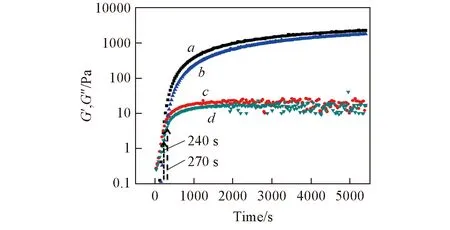
3 结 论
