Thermochromatiumtepidum外周捕光天线蛋白LH2在脂质体及表面活性剂胶束中的光谱性质
2016-11-03霍一林王秦玥李萝园于龙江张建平王征宇
霍一林, 石 莹, 王秦玥, 李萝园, 于龙江,王 鹏, 张建平, 王征宇
(1. 中国人民大学化学系, 北京 100872;2. 茨城大学理学部, 水户市 310-8512, 日本;3. 冈山大学自然科学学院, 冈山市700-8530, 日本)
Thermochromatiumtepidum外周捕光天线蛋白LH2在脂质体及表面活性剂胶束中的光谱性质
霍一林1, 石莹1, 王秦玥1, 李萝园1, 于龙江2,3,王鹏1, 张建平1, 王征宇2
(1. 中国人民大学化学系, 北京 100872;2. 茨城大学理学部, 水户市 310-8512, 日本;3. 冈山大学自然科学学院, 冈山市700-8530, 日本)
采用动态光散射、 透射电子显微镜、 紫外-可见吸收光谱和拉曼光谱对比研究了处于表面活性剂胶束和脂质体磷脂双分子层中的Thermochromatium(Tch.)tepidumLH2的光谱响应. 结果表明, 与在表面活性剂胶束中相比, 双分子层脂膜中LH2的Spirilloxanthin(一种含有13个共轭双键的类胡萝卜素)构象有明显差异; 表面活性剂及磷脂分子端基的荷电状态对B850-Qy吸收谱有显著影响; Ca2+结合导致B850 Qy吸收谱带红移和增色, 而H+结合则使该吸收谱带蓝移和减色. 对LH2脱辅基蛋白氨基酸序列的分析结果表明, Ca2+和H+的结合位点可能位于α脱辅基蛋白的C-端一侧. B850 Qy吸收谱带对Ca2+和H+的响应特性可能与Tch.tepidum适应其生存环境的能力有关.
Thermochromatiumtepidum; 外周捕光天线LH2; 表面活性剂; 脂质体
紫色光合细菌细胞质膜上存在3种跨膜色素-蛋白复合物:外周捕光天线LH2、 核心天线LH1及包裹在LH1内部的光合反应中心RC(后两者共同构成核心复合物LH1-RC). 它们和细胞质膜形成的二维阵列超分子结构是太阳光能高效吸收、 传递、 电荷分离及随后的环状电子转移发生的基础, 并最终由此形成跨膜电化学质子梯度, 腺嘌呤核苷三磷酸(ATP)的合成[1].
根据已知原子分辨率晶体结构, 外周捕光天线蛋白LH2具有高度对称的环形结构, 由8(或9)对跨膜脱辅基蛋白螺旋亚基αβ组成, 每对αβ亚基中包含3个叶绿素(根据其Qy吸收带位置分别定义为B800和B850)和一个类胡萝卜素[2,3].Thermochromatium(Tch.)tepidum是一种中等嗜热紫色硫细菌, 其LH2的脱辅基蛋白αβ亚基组成复杂, 多种共轭长度类胡萝卜素共存[4], B800吸收带裂分[5], 而该蛋白复合物的原子分辨率结构至今未知. 其LH2的B850电子吸收表现出对表面活性剂种类和浓度[6]、 二价金属离子[4]及温度[7]等环境因素变化敏感的特征, 可以作为一种潜在的光谱探针; 其光合膜核心复合物LH1-RC的光谱特征[8~10]、 激发态动力学[11]、 特别是高分辨晶体结构[12]的解析也将为LH2的相关研究提供重要参考.
对膜蛋白体外性质研究通常在天然膜体系(如光合膜碎片Chromatophore)、 表面活性剂的胶束溶液及由磷脂构成的脂质体(人工膜脂质体)中进行, 其中脂质体因可以模拟天然膜的二维阵列结构而被广泛使用[13~16]. 本文采用不同光谱技术对比了Tch.tepidumLH2在磷脂构成的脂质体中及2种表面活性剂[十二烷基麦芽糖苷(DDM)和十二烷基二甲基氧化胺(LDAO)]胶束溶液中的性质, 考察了Ca2+和H+离子对该蛋白复合物B850吸收的影响, 并讨论了表面活性剂(或磷脂)种类、 钙离子和质子对该光合膜蛋白光谱性质影响的结构机制.
1 实验部分
1.1试剂与仪器
三(羟甲基)氨基甲烷(纯度99%), 美国NOVON公司; 盐酸(质量分数37%, 分析纯), 北京化工厂; LDAO(30%水溶液), 日本Kao公司; DDM(纯度99%), 美国Acros Organics公司; 大豆卵磷脂[磷脂酰胆碱(PC)含量为14%~23%], 日本Wako公司; 无水氯化钙(CaCl2, 分析纯), 北京市通广精细化工公司; DEAE-纤维素(Whatman DE52)离子交换柱和透析袋(MWCO:3500), 上海百赛生物技术有限公司.
JEOL1230R透射电子显微镜(TEM, 日本JEOL公司); Zetasizer Nano ZS90纳米粒度电位仪(英国Malvern公司), Cary 50紫外-可见吸收光谱仪(美国Varian公司), Xplora Plus显微共聚焦拉曼光谱仪(日本Horiba公司).
1.2实验过程
1.2.1LH2的制备和纯化将紫色硫细菌Tch.tepidum在48 ℃、 无氧条件下光照(光照强度2000 lx)培养7 d, 离心后将菌体细胞在4 ℃下用超声法破碎, 超高速离心得到细胞质内膜碎片(又称载色体), 用匀浆法均匀悬浮于20 mmol/L的Tris-HCl缓冲溶液(pH=8.5)中, 制备成OD850 nm=50 cm-1的样品悬浮液, 再用0.35%(质量分数)的表面活性剂LDAO在黑暗中溶解60 min, 离心(145400g, 4 ℃, 100 min), 得到的上层清液为粗制的LH2, 再用DEAE-纤维素(Whatman DE52)离子交换柱进行纯化分离, 洗脱液为含0.05%(质量分数)DDM的不同浓度CaCl2溶液.
1.2.2LH2不同表面活性剂胶束溶液及与脂质体组装体系的制备将浓缩的LH2样品分别用含有0.1% LDAO的20 mmol/L Tris-HCl缓冲溶液(pH=8)和含有0.05%DDM的20 mmol/L Tris-HCl缓冲溶液(pH=8)溶解、 稀释, 制得不同表面活性剂胶束溶液样品.
LH2-lipsome体系的制备:配制1 mg/mL的大豆卵磷脂的氯仿溶液, 除氧, 保存于-20 ℃冰箱中. 取3 mL 卵磷脂氯仿溶液于微量离心管中, 用N2气吹干, 向其中依次加入100 μL 30% LDAO和2.4 mL 20 mmol/L的Tris-HCl 缓冲溶液(pH=8.0), 超声使样品完全溶解后, 加入500 μL LH2(OD798 nm=22.8 cm-1)溶液, 将所有样品混合均匀后转移到透析袋中, 透析液为20 mmol/L的Tris-HCl 缓冲溶液(pH=8.0), 在黑暗中于4 ℃下进行3次透析(时间依次为2, 2和19 h), 透析后的样品用孔隙为0.22 mm的过滤器反复过滤10次, 得到LH2-liposome. 制备带钙离子的样品时, 向透析液中加入200 mmol/L的CaCl2.
1.2.3LH2-liposome的尺寸和形貌表征将LH2-liposome或LH2表面活性剂的胶束溶液滴加在负载有多孔碳膜的铜网上, 再用1%的醋酸铀进行染色, 用滤纸将液体吸干, 进行TEM观测, 工作电压为100 kV.
动态光散射测定:将样品放入厚度为1 cm的塑料样品池中, 进行多次扫描, 取平均值.
1.2.4LH2在不同体系中的电子态结构测定LH2在各种体系中的电子态结构通过紫外-可见吸收光谱表征:1 cm光程石英样品池, 扫描范围为300~1000 nm, 所有实验均在室温下进行. 钙离子和不同表面活性剂溶液的配制方法如上所述, 低pH值(pH=3)样品的制备是在搅拌下向样品中滴加3 mol/L的盐酸溶液, 直至pH=3, 用pH计监测.
1.2.5LH2在不同体系中的类胡萝卜素构象将LH2的不同体系样品装入样品池中, 使用Xplora Plus显微共聚焦拉曼光谱仪测定拉曼信号, 激发波长为532 nm.
2 结果与讨论
2.1LH2-liposome和LH2-表面活性剂胶束的形貌与粒径
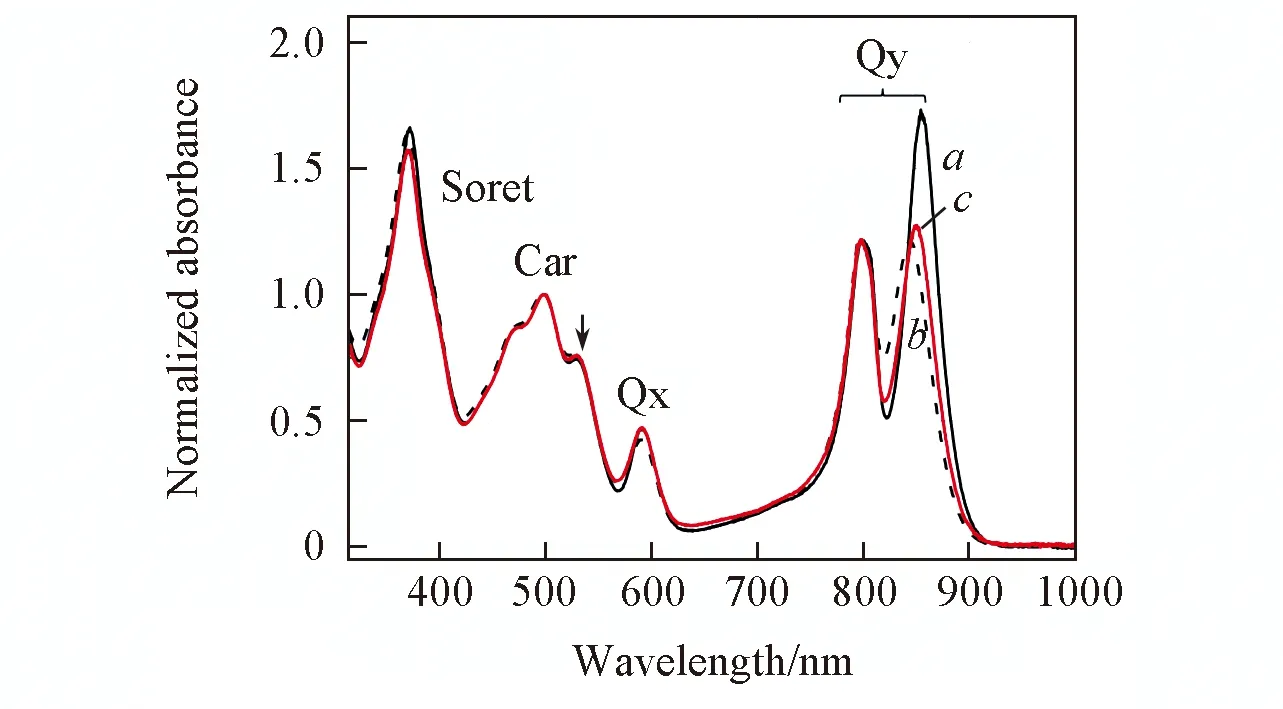
Fig.1 Absorption of LH2 from Tch. tepidum in various environments at pH=8a. in DMM; b. in LDAO; c. in liposome. The arrow shows the absorption of spirilloxanthin.
实验中所用的表面活性剂(DDM, LDAO)浓度接近可以充分溶解色素-蛋白复合物的最低浓度, LH2-liposome组装体呈颜色均一、 透明的稳定胶体溶液. 图1给出LH2生理pH值(pH=8)下在3种体系中的稳态吸收光谱. 可见, 经过散射背景的基线扣除和在类胡萝卜素吸收最大值处(500 nm)归一化, 3种体系吸收光谱的类胡萝卜素S2←S0吸收(400~550 nm)、 叶绿素的Soret带、 Qx带及B800叶绿素的Qy带基本重合, 说明相关色素电子态能级结构不受表面活性剂胶束或磷脂双层超分子结构影响; 而3种体系中B850叶绿素的Qy带吸收则显著不同:相比在脂质体中, 在DDM胶束中B850的Qy带吸收显著增强, 同时红移5 nm, 而在LDAO中则稍微减色并发生5 nm蓝移. 这一结果说明表面活性剂胶束(或磷脂脂质体)的超分子结构影响到B850叶绿素聚集体的电子态结构, 从而使其吸收光谱发生变化.

Fig.2 TEM images of LH2 from Tch. tepidum in liposome(A), DDM(B) and LDAO(C)The samples were negatively stained with 1% uranium acetate.
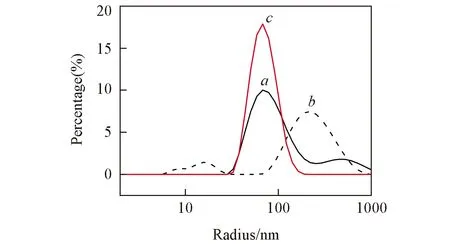
Fig.3 DLS data of the LH2 from Tch. tepidum in various detergents micelles or liposome systemsa. in DMM(106 nm/565 nm); b. in LDAO(14 nm/257 nm); c. in liposome(73 nm). The data in the corresponding parentheses are the Rh of the vesicles for each system.
图2(A)为LH2-liposome的TEM照片. 可见, LH2-liposome组装体呈球形, 尺寸大约在60~80 nm之间, 与天然的光合膜碎片载色体的尺寸相同[17]. 由图2(A)可见许多残破的组装体碎片, 这是因为TEM样品室的高真空使许多脂质体破裂所致. LH2在2种表面活性剂胶束中的TEM照片表现出平展的膜片或者萎缩坍塌的结构[图2(B), (C)], 可能是因为胶束结构不够坚固, 在TEM测量的高真空条件下无法稳定存在所致. 图3为采用动态光散射(DLS)技术测定的3种体系中胶体半径(Rh)的尺寸分布. 可见, LH2-liposome的主要粒径约为70 nm, 这与TEM观测到的结果一致, 粒径分布最集中, 颗粒分布系数(PDI)为0.20; 0.05%DDM的胶束溶液主要形成尺寸约100 nm的胶束, 还会形成少量尺寸约560 nm的大胶束, PDI为0.45; 0.1%的LDAO溶液主要形成尺寸约260 nm的胶束和少量尺寸约14 nm小胶束, PDI为0.64. 结果表明, LH2-liposome的结构比较均一和紧凑, 表面活性剂形成的胶束结构则较松散, 尺寸更随机; 从胶束大小到粒径分布系数上看, DDM形成的胶束比LDAO更接近于大豆磷脂形成的脂质体LH2-liposome.
2.2胶束或脂质体超分子结构对LH2中类胡萝卜素构象的影响
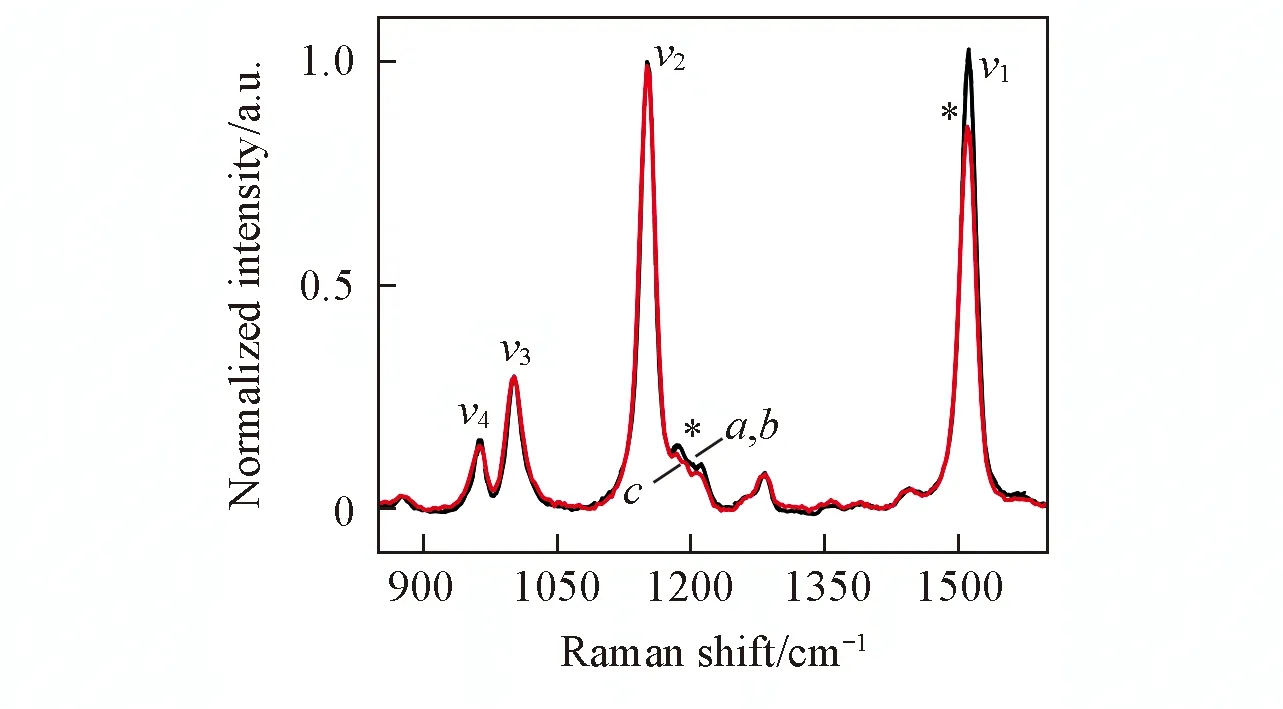
Fig.4 Resonance Raman spectra of LH2 from Tch. tepidum in various environments under the excitation at 532 nma. in DDM; b. in LDAO; c. in liposome.

2.3钙离子和pH值对LH2在不同体系中B850 Qy吸收带的影响
Tch.tepidum在自然界的生存环境中有大量钙离子存在, 研究发现, 其核心天线LH1的α,β脱辅基蛋白的C-端存在钙离子结合位点[12], 与钙离子结合导致LH1的Qy吸收带相对其它嗜温菌种红移约30 nm, 并显著提高色素-蛋白复合物的热稳定性[9]. Sekine等[4]发现, 二价碱土金属离子普遍能使该物种LH2的B850 Qy吸收带发生增色和红移, 而结构机制未知. 此外, 发生在光合膜中的光诱导电子转移导致光合膜两侧的质子梯度, 成为驱动ATP酶工作的动力[1]; 而高等植物的外周捕光天线中, 存在pH诱导的非光化学叶绿素荧光猝灭机制[21]. 本文主要研究质子(低pH值下)和钙离子在3种体系中对LH2的B850影响的结构机制.
图5为Tch.tepidumLH2在不同胶束或脂质体体系中、 不同pH值和钙离子浓度下的Qy吸收光谱, 所有光谱均在797 nm处归一化. 图5光谱特征的定量分析结果见表1. 相比于其它常见的嗜温菌种[Rhodobacter(Rba.)sphaeroides],Tch.tepidumLH2的B800 Qy吸收具有显著不同的特征(如图5所示), 具体表现为光谱峰显著展宽并在低温下可裂分成2个独立光谱组分[对应图5(A)中箭头所示处][5]. 这一现象在Tch.tepidum的类似物种Allochromatium(Alc.)vinosum的LH2中也存在, 但其确切结构机制未知[22]. 虽然3种体系中B800 Qy吸收形状有所不同(如图5所示), 但其相对强度受环境变化影响很小(如图1所示), 因此以下着重讨论B850 Qy吸收的变化.
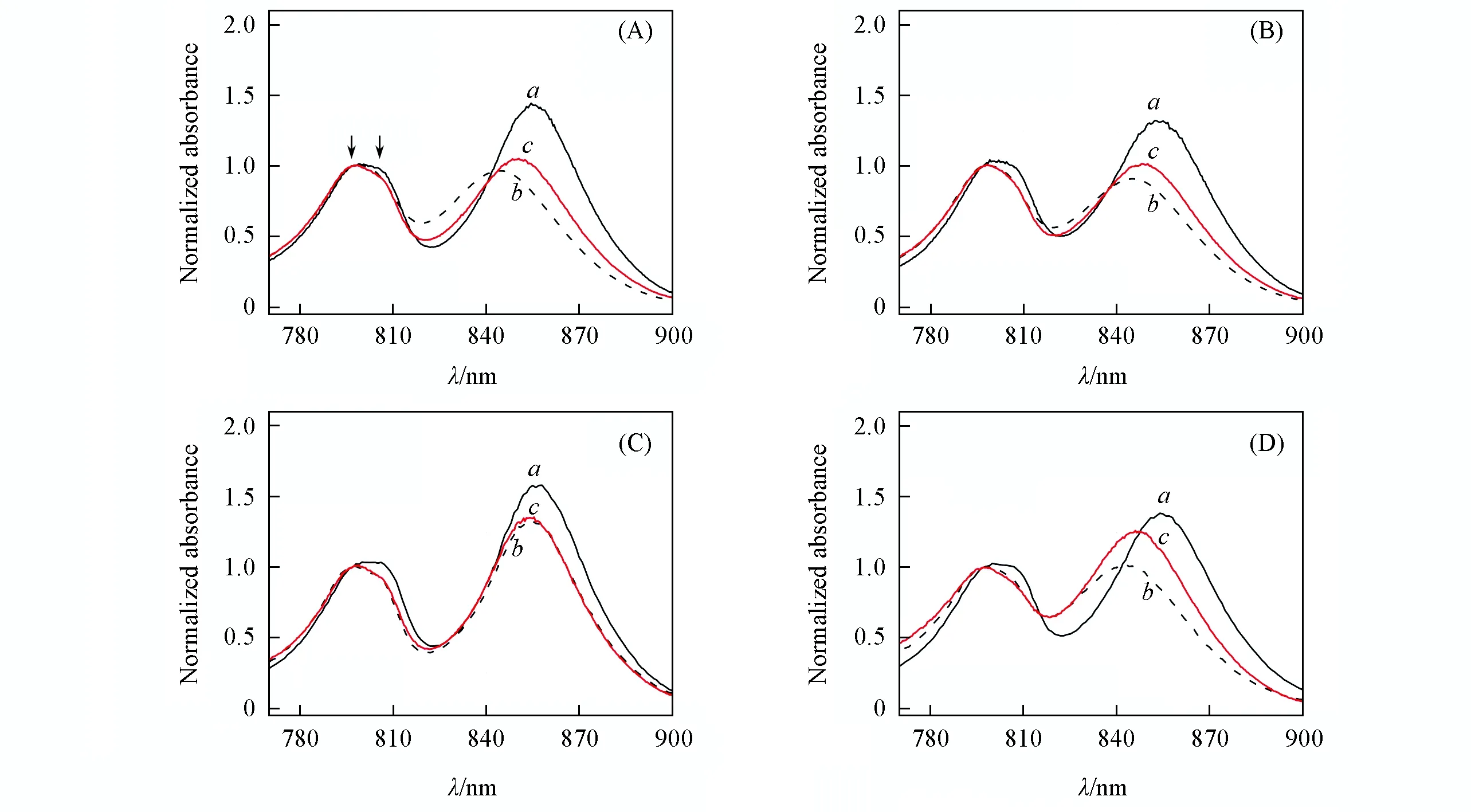
Fig.5 Qy absorption comparison of LH2 from Tch. tepidum in 0.05% DDM(a), 0.1% LDAO(b) and PC(c) liposome, under pH=8(A, C) and 3(B, D), and without Ca2+(A, B) or with 200 mmol/L Ca2+(C, D)(all the spectra are normalized at 797 nm), respectivelyArrows in (A) show the splitting peaks position of B800.
根据已知的高分辨晶体结构, 在LH2的每对αβ蛋白上, 通过每个脱辅基蛋白上固定位置Histidine的侧链与叶绿素中心镁离子的配位作用, 可以结合一对与细胞质膜平面垂直的细菌叶绿素分子, 它们共同构成了吸收在850 nm处的叶绿素聚集体, 被称为B850[2,3]. 相比B800,Tch.tepidum的B850 Qy吸收受环境因素影响很大, 本文用B850最大吸收位置(λmax, B850) 和B850与B800的吸收强度比值ODB850/ ODB800进行对比分析. 此外, 在天然光合膜碎片中的相应数据也列出以作对比(如表1所示, 相应光谱数据见图S1, 见本文支持信息).
由表1可见, 当没有钙离子存在且pH=8时, 在DDM和天然光合膜碎片载色体中,λmax, B850约为855 nm, ODB850/ODB800均为1.41; 在liposome和LDAO中,λmax, B850则分别蓝移5和10 nm, 而ODB850/ODB800约为1.0±0.05; 当pH=3时,λmax, B850的位置基本与pH=8下相应体系中一致, 或有1~2 nm的微小蓝移, ODB850/ODB800降低值在DDM, LDAO, Liposome和Chromatophore中依次为-0.13, -0.06, -0.04, -0.23, 即B850相对B800在低pH值下普遍减色.

Table 1 Qy absorption characteristics of LH2 from Tch. tepidum under various conditionsa
a. The data are summarized from Fig.4 and the relevant data in chromatophore are listed as reference;b. the spectra in chromatophore are shown in Fig.S1(see the supporting information of this paper).
由表1还可见, 在200 mmoL/L Ca2+存在时, pH=8下, B850相对于没有钙离子存在时普遍发生红移和增色效应, 其中在LDAO和Liposome中λmax, B850分别红移了9和4 nm, ODB850/ODB800值分别升高了在0.36和0.28; 在DDM中有2 nm的红移和0.12的增色; 在Chromatophore中虽有4 nm红移, 同时也有轻微减色(-0.03). pH=3时, 相对于有钙离子的pH=8条件下, 在LDAO和Liposome中B850均发生显著蓝移(分别为11和8 nm), 同时, 在DDM, LDAO, Liposome和Chromatophore中减色效应(ODB850/ODB800降低值)分别为-0.18, -0.30, -0.07和-0.06.
值得注意的是, 无论在任何pH值或者钙离子条件下, 在DDM和Chromatophore中B850均比在LDAO和liposome中的红移更大, 吸收能力更强.
综上可以得到如下结论:在对Tch.tepidumLH2 B850 Qy吸收影响方面, DDM形成的胶束和天然膜Chromatophore体系更相似, 而大豆磷脂形成的liposome和LDAO更相似; 钙离子的存在有助于提高B850在近红外(NIR)区的吸收能力(B850吸收红移及增色); 较高的氢离子浓度(低pH值)会降低B850在NIR区的吸收能力(B850吸收蓝移和减色).
2.4钙离子、 pH值及表面活性剂对Tch.tepidumLH2 B850 Qy吸收影响的结构机制
除掉Chromatophore中其它色素蛋白复合物(LH1-RC)的影响, 表面活性剂或磷脂分子的结构是影响被其包裹的膜蛋白性质的决定因素. 本文所用表面活性剂和磷脂分子的结构如图6(A)~(C)所示:LDAO是一种端基带电荷的表面活性剂; DDM的端基为中性的二糖片段; 大豆卵磷脂是3种磷脂的混合物, 其中23%PC(磷脂酰胆碱)端基为带电荷物种, 另外77%的PE(磷脂酰乙醇胺)和IP(磷脂酰肌醇)端基为中性极性官能团.Tch.tepidum的膜脂成分如图6(D)所示, 3种主要成分PE, PG(磷脂酰甘油)和cardiolipin(双磷脂酰甘油)的端基均为中性极性官能团. 由此可知, LDAO和大豆卵磷脂均含有带电荷的极性端基官能团, 而DDM和chromatophore膜脂端基均为中性极性官能团, 这可能是造成它们对B850性质影响不同的关键原因.
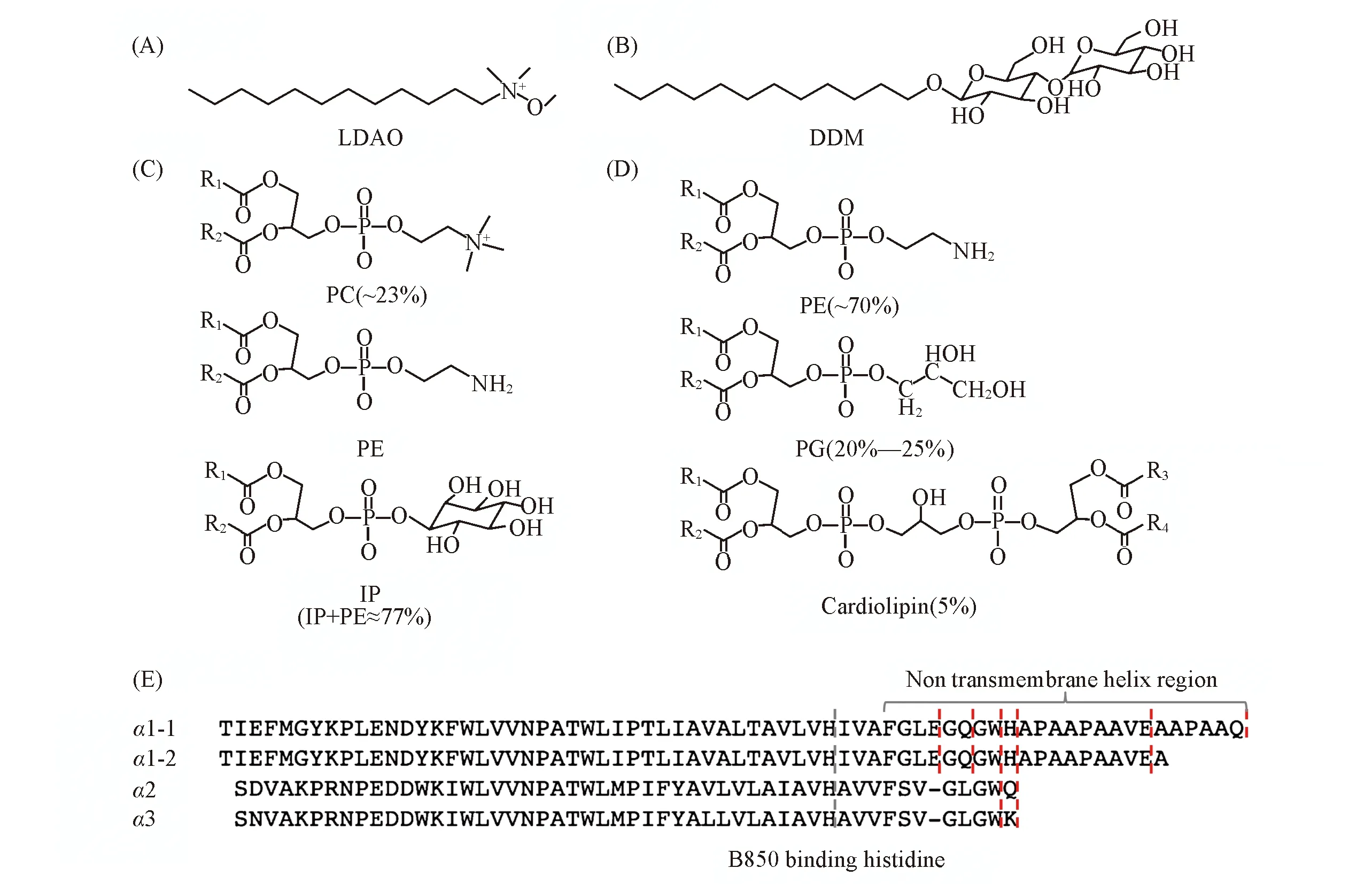
Fig.6 Molecular structure and components of detergents(A, B) or lipid(C), molecular structure and components of lipids of chromatophore from Tch. Tepidum(D) and the amino acid sequence of α-apoproteins of LH2 from Tch. Tepidum[4](E)R1—R4 are the aliphatic chain with various length and degree of unsaturation. The gray broken line indicates the B850 bacteriochlorophyll binding histidine, and the red broken line indicates the possible binding points for calcium ion or proton.
基因定点突变[23,24]和激光共振拉曼[25]等系列研究结果表明, 在影响B850 Qy吸收的诸多因素中[1], 细菌叶绿素C3位乙酰基的羰基与α-脱辅基蛋白上第44位和45位氨基酸(对于Rps.acidophila分别为酪氨酸和色氨酸)残基侧链之间的氢键是决定其850 nm吸收的关键. 从已知高分辨率晶体结构的2种LH2结构可知[2,3], 在靠近B850的周质侧(Periplasmic side), α脱辅基蛋白的C-端都含有一段超出跨膜螺旋区长度大约18或19个氨基酸的肽链, 会形成另一个独立的螺旋结构, 处于脂-水界面. 上述的第44位和45位关键氨基酸就处在这一非跨膜螺旋区, 因此很容易受到来自水相物质的影响. 此外, 已知Tch.tepidum核心天线LH1 Qy吸收位置受其生长环境中大量存在的Ca2+的调控[9], 晶体结构研究确定了在LH1脱辅基蛋白的C-端存在Ca2+的特异性结合位点, 主要由Ca2+α-49位的天冬氨酸(Asp)和α-50位的天冬酰胺(Asn)的侧链、α-46位的色氨酸(Trp)主链羰基、 相邻β-46位的亮氨酸(Leu)的C-端羧基上5个氧原子构成[12]. 虽然Tch.tepidumLH2的晶体结构未知, 但通常紫色光合细菌的光合膜蛋白复合物的结构具有很高的保守性[1], 因此可以认为Tch.tepidumLH2具有和已知LH2相似的结构, 对Tch.tepidumLH2的αβ脱辅基蛋白氨基酸序列解析结果表明, 4种α脱辅基蛋白中有2种C-端拥有较长的非跨膜区(19~24个氨基酸)[如图6(E)中α1-1和α1-2所示][4]. 该非跨膜螺旋区也应处于靠近B850侧的脂-水界面区. 考察该区域的氨基酸序列可以发现, 多种侧链可能作为钙离子配体(如谷氨酰胺Q、 谷氨酸E)或者对氢离子敏感(如赖氨酸K、 组氨酸H、 色氨酸W)的氨基酸. 特别应该指出的是, 这些氨基酸残基均具有和B850细菌叶绿素羰基氧原子形成氢键的可能性, 因此, 这些氨基酸残基不仅是Tch.tepidumLH2的B850吸收对钙离子和氢离子敏感的关键位点, 也可能是上述端基含带电荷极性官能团的表面活性剂或膜脂(如LDAO或卵磷脂中的PC)对B850造成减色和蓝移的关键位点. 具体机制可以推测为:钙离子通过和上述多种关键氨基酸残基形成多配位结构域, 从而使B850叶绿素聚集体采取可以导致B850红移和吸收增强的构型; 而氢离子和带电荷的表面活性剂(膜脂)端基可以破坏钙离子配位的空间构型, 即改变了相应非跨膜螺旋区的结构, 从而直接或间接影响到决定B850 Qy吸收的氢键结构或其它关键结构因素, 造成光谱的蓝移和减色.
3 结 论
采用吸收光谱、 TEM、 动态光散射及激光共振拉曼光谱技术对比了Tch.tepidum外周捕光天线LH2在2种表面活性剂胶束溶液及磷脂双分子层体系中的性质. 结果发现, 卵磷脂构成的liposome具有尺寸均匀、 结构紧凑的超分子结构, 可以导致其组装的LH2蛋白中类胡萝卜素spirilloxanthin(共轭双键数目为13)构象相对在其它2种表面活性剂的胶束溶液中发生明显变化; 表面活性剂及磷脂分子极性端基的荷电性质是其对B850 Qy吸收造成影响的关键, 钙离子的存在可以导致B850吸收普遍红移和增色, 而氢离子则导致相反的作用, 对该蛋白复合物脱辅基蛋白氨基酸序列分析及与LH1结构对比结果表明,α脱辅基蛋白C-端含有潜在的钙离子、 氢离子结合位点及氢键形成位点, 钙离子与该区域氨基酸残基的配位方式有利于B850聚集体采取导致Qy吸收增强和红移的构型, 而氢离子及表面活性剂带电荷极性端基则会破坏这一结构从而导致Qy吸收减色和蓝移. 这一由钙离子和氢离子调控的B850吸收变化的现象可能是该物种适应其生存环境的一种方式.
[1]Cogdell R. J., Gall A., Köhler J. Q.,Rev.Biophys., 2006, 39(3), 227—324
[2]Koepke J., Hu X., Muenke C., Schulten K., Michel H.,Structure, 1996, 4(5), 581—597
[3]Papiz M. Z., Prince S. M., Howard T., Cogdell R. J., Isaacs N. W.,J.Mol.Biol., 2003, 326(5), 1523—1538
[4]Sekine F., Horiguchi K., Kashino Y., Shimizu Y., Yu L. J., Kobayashi M., Wang Z. Y.,Photosynth.Res., 2012, 111(1/2), 9—18
[5]Van Dijk B., Nozawa T., Hoff A. J.,Spectrochim.ActaPartA, 1998, 54(9), 1269—1278
[6]Yang F., Yu L. J., Wang P., Ai X. C., Wang Z. Y., Zhang J. P.,J.Phys.Chem.B, 2011, 115(24), 7906—7913
[7]Shi Y., Zhao N. J., Wang P., Fu L. M., Yu L. J., Zhang J. P., Wang Z. Y.,J.Phys.Chem.B, 2015, 119(47), 14871—14879
[8]Ma F., Kimura Y., Yu L. J., Wang P., Ai X. C., Wang Z. Y., Zhang J. P.,FEBSJ., 2009, 276(6), 1739—1749
[9]Kimura Y., Yu L. J., Hirano Y., Suzuki H., Wang Z. Y.,J.Biol.Chem., 2009, 284(1), 93—99
[10]Kimura Y., Inada Y., Numata T., Arikawa T., Li Y., Zhang J. P., Wang Z. Y., Ohno T.,Biochim.Biophys.Acta, 2012, 1817(7), 1022—1029
[11]Ma F., Kimura Y., Zhao X. H., Wu Y. S., Wang P., Fu L. M., Wang Z. Y., Zhang J. P.,Biophys.J., 2008, 95(7), 3349—3357
[12]Niwa S., Yu L. J., Takeda K., Hirano Y., Kawakami T., Wang Z. Y., Miki K.,Nature, 2014, 508(7495), 228—232
[13]Dewa T., Sumino A., Watanabe N., Noji T., Nango M.,Chem.Phys., 2013, 419, 200—204
[14]Schubert A., Stenstam A., Beenken W. J. D., Herek J. L., Cogdell R. J., Pullertis T., Sundström V.,Biophys.J., 2004, 86(4), 2363—2373
[15]Zhou F., Liu S., Hu Z., Kuang T., Paulsen H., Yang C.,Photosynth.Res., 2009, 99(3), 185—193
[16]Sumino A., Dewa T., Noji T., Nakano Y., Watanabe N., Hildner R., Bösch N., Köhler J., Nango M.,J.Phys.Chem.B, 2013, 117(36), 10395—10404
[17]Frese R. N., Sieber C. A., Niederman R. A., Hunter C. N., Ottot C., Grandelle R. V.,Proc.Natl.Acad.Sci.USA, 2004, 101(2004), 17994—17999
[18]Tschirner N., Schenderlein M., Brose K., Schlodder E., Mroginski M. A., Thomsena C., Hildebrandt P.,Phys.Chem.Chem.Phys., 2009, 11(48), 11471—11478
[19]Niedzwiedzki D. M., Kobayashi M., Blankenship R. E.,Photosynth.Res., 2011, 107(2), 177—186
[20]Mukai-Kuroda Y., Fujii R., Ko-chi N., Sashima T., Koyama Y., Abe M., Gebhard R., Hoef I. V. D., Lugtenburg J.,J.Phys.Chem.A., 2002, 106(14), 3566—3579
[21]Ruban A. V., Johnson M. P., Duffy C. D. P.,Biochim.Biophys.Acta, 2012, 1817(1), 167—181
[22]Löhner A., Carey A. M., Hacking K., Picken N., Kelly S., Cogdell R., Köhler J.,Photosynth.Res., 2015, 123(1), 23—31
[23]Fowler G. J. S., Visschers R. W., Grief G. G., Grondelle R. V., Hunter C. N.,Nature, 1992, 355, 848—850
[24]Fowler G. J. S., Sockalingum G. D., Robert B., Hunter C. N.,Biochem.J., 1994, 299(3), 695—700
[25]Sturgis J.N., Robert B.,J.Phys.Chem.B, 1997, 101(37), 7227—7231
(Ed.:S, Z, M)
† Supported by the National Natural Science Foundation of China(Nos.21273282, 21173265) and the International Cooperation Project Between China and Russia(No.21411130185).
Spectroscopic Properties of LH2 fromThermochromatiumtepidumin Liposome and Detergent Micelles†
HUO Yilin1, SHI Ying1, WANG Qinyue1, LI Luoyuan1, YU Longjiang2,3,WANG Peng1*, ZHANG Jianping1, WANG Zhengyu2
(1. Department of Chemistry, Renmin University of China, Beijing 100872, China;2.FacultyofScience,IbarakiUniversity,Mito310-8512,Japan;3.FacultyofScience,OkayamaUniversity,Okayama700-8530,Japan)
By the use of dynamic light scattering(DLS), transmission electron microscopy(TEM), UV-Vis and resonance Raman spectroscopy, the properties of LH2 fromThermochromatium(Tch.)tepidumin two detergent micelles and in liposome were studied, respectively. The results show that in LH2-liposome the conformation of spirilloxanthin, an incorporated longer chain carotenoid, is obviously different from that in detergent micelles. The charge state of the terminal groups of detergents or lipids is the key factor affecting the B850 absorption. Generally, the calcium ions cause red-shift of the B850 absorption and hyperchromicity, while the proton has the opposite effect. Based on the amino acid sequence analysis, several amino acid residues on the C-terminus ofαapo-protein were proposed to constitute the potential binding site for the calcium ion and proton. Such Ca2+- and H+-regulated changes of B850 absorption might be an adaptive mechanism to the living environment for this species.
Thermochromatiumtepidum; Peripheral antenna complex LH2; Detergent; Liposome
10.7503/cjcu20160277
2016-04-25. 网络出版日期:2016-08-26.
国家自然科学基金(批准号:21173265, 21273282)和中-俄合作项目(批准号:21411130185)资助.
O641
A
联系人简介:王鹏, 男, 博士, 副教授, 主要从事天然光合体系能量转移动力学机制研究. E-mail:wpeng@iccas.ac.cn
