枯草芽孢杆菌与解磷细菌对猕猴桃园土壤及果实品质的影响
2016-11-01崔孟奇田霄鸿曹翠玲胡景江
邵 阳,崔孟奇,田霄鸿,曹翠玲,胡景江
(1.西北农林科技大学生命科学学院, 陕西 杨凌 712100;2.西北农林科技大学资源环境学院, 陕西 杨凌 712100)
枯草芽孢杆菌与解磷细菌对猕猴桃园土壤及果实品质的影响
邵阳1,崔孟奇1,田霄鸿2,曹翠玲1,胡景江1
(1.西北农林科技大学生命科学学院, 陕西 杨凌 712100;2.西北农林科技大学资源环境学院, 陕西 杨凌 712100)
在大田条件下,采用两因素两水平完全正交试验设计方案,从立体生态角度研究了在猕猴桃树体根围施用枯草芽孢杆菌和解磷细菌后对土壤理化性质、土壤微生物数量及果实品质的影响。结果表明,混合施用枯草芽孢杆菌和解磷细菌后,土壤速效磷、铵态氮含量及磷酸酶活性分别是对照的1.93倍、1.34倍及2.15倍;果实成熟后,其硬度、可溶性糖含量、VC含量分别是对照的1.21倍、1.06倍、1.18倍,可滴定酸含量降低,是对照的88%。多元回归统计分析表明,果实品质与土壤有机质、速效磷及磷酸酶活性相关性显著。混合施用枯草芽孢杆菌和解磷细菌可用来改良高龄猕猴桃果园土壤,且能提高果实品质。
猕猴桃;有益菌;土壤养分;改良分析
猕猴桃(ActinidiaChinensis)俗称阳桃、毛桃等,属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)植物,是原产于我国的古老野生木质藤本果树。猕猴桃口味鲜美、营养丰富,被誉为“水果之王”。随着人们生活水平的不断提高,对各种水果品质的改良也提上了日程,使用化学药剂虽能对其有一定程度的作用,但产生的负面影响也是不容忽视。例如在猕猴桃生产中使用较为普遍的膨大剂,有报道指出,这种猕猴桃不仅吃起来味淡,且不宜贮藏,要是大量食用,还可能造成体内由于激素蓄积而引起的病变[1]。因此寻找一种健康环保的改良方式就显得尤为重要。
土壤是猕猴桃树体生长的基础,土壤理化性状的优劣直接影响到树体的生长、果实品质和果园的可持续发展[2]。土壤微生物是土壤生态系统的重要组成部分,几乎所有的土壤过程都直接或间接地与土壤微生物有关[3],尤其是一些有益土壤微生物可直接或间接提高土壤养分有效性。如,自生固氮菌除固氮活性之外,还具有活化土壤无机磷的作用[4];解钾菌在土壤中除了解钾、解磷的作用外,还具有多方面的功能[5];有益菌枯草芽孢杆菌菌体可合成淀粉酶、蛋白酶等多种酶类,并且具有良好的促进植物生长的作用[6],解磷细菌能提高土壤有效磷含量、降低磷肥的投入,减少环境污染,具有极好的环保作用[7]。
目前枯草芽孢杆菌多应用于饲料及水质的研究,解磷细菌多应用于设施蔬菜种植相关的研究,关于枯草芽孢杆菌和解磷细菌对猕猴桃根围土壤及果实品质的研究比较少见。在对农户走访调查中发现,果园连年种植猕猴桃会产生多种种植问题,其中树势衰弱及猕猴桃产量下降的问题对农户影响最为严重,因此本文拟探究这两种菌单施及混施对土壤养分的影响及其对果实品质的影响。
1 材料与方法
1.1材料
枯草芽孢杆菌(300亿·g-1)为盐城市神微生物菌种科技有限公司出品。解磷细菌(菌株鉴定结果为杨氏柠檬酸杆菌,采用牛肉膏蛋白胨液体培养基培养24 h,81亿·g-1)为实验室分离菌株。
1.2植物及土壤材料
试验地位于陕西杨凌夏家沟。猕猴桃果园栽种品种为“海沃德”。 2014年4月14日随机选取12棵生长状况相似的植株,采用两因素两水平的正交试验设计,3棵为空白对照(CK),9棵为试验处理植株,分别为枯草芽孢杆菌(KC,500 g·株-1)、解磷细菌(JL,1.5 L·株-1)、枯草芽孢杆菌和解磷细菌配施(KJ)(用量为单施的一半,250 g+750 mL·株-1)。具体施用方法为:以树干为中心,0.5 m为半径,将表层约15 cm的土壤移开后,将菌剂或菌液均匀撒在土壤表面后,再用土覆盖。
2015年9月7日采集土样及果实样品,采用四点取样法对12棵果树采样,以主干为中心距其0.5 m处用土钻采集15~20 cm层土壤,弃去植物残体后,取1.0~2.0 kg样品,混合均匀装入无菌密封袋带回实验室进行土壤理化性质及微生物数量测定。
1.3测定指标与方法
1.3.1土壤微生物数量测定土壤微生物数量用新鲜土壤进行测定,细菌、放线菌及真菌数量测定分别采用牛肉膏蛋白胨培养基、高氏1号培养基及马丁氏培养基[8]。
1.3.2土壤理化性质测定方法土壤理化性质参考鲍士旦《土壤农化分析》[9],利用pH计测定土壤pH,以H2SO4-HClO4消解法测定土壤全磷含量,以钼锑抗比色法测定土壤速效磷含量,利用凯氏定氮仪测定土壤全氮含量,利用AA3型连续流动分析仪测定土壤硝态氮及铵态氮含量。
1.3.3土壤酶测定将6月24日带回的土壤,部分风干后过100目筛,参照关松荫[10]的方法测定土壤酶活性。蔗糖酶活性测定采用3,5—二硝基水杨酸比色法,以24 h后1 g土壤中葡萄糖的毫克数表示;脲酶活性测定采用苯酚钠比色法,以24 h后1 g土壤中NH3—N的毫克数表示;蛋白酶活性测定采用茚三酮比色法,以24 h后1 g土壤中甘氨酸的微克数表示;多酚氧化酶活性测定采用紫色没食子酸比色法,以每克土的红紫培精的毫克数表示;磷酸酶活性测定采用苯磷酸二钠法,以每百克土酚的毫克数表示。
1.3.4果实品质测定同时在取样的12棵树体中上部,分别于东、南、西、北采集生长状态适中的猕猴桃果实样品各4个,总计192个,带回实验室后立即用电子天平测定单果质量,用GY-1型果实硬度计测定果实硬度。当果实硬度达到1.0~1.2时,参考曹健康《果蔬采后生理生化实验指导》[11]用阿贝折光仪测定可溶性固形物(SSC)含量,采用蒽酮比色法测定果实总可溶性糖含量,采用NaOH滴定法测定果实可滴定酸含量,以碘酸滴定法测定果实抗坏血酸含量;参考张治安《植物生理学实验指导》[12]以乙醇萃取法测定果实叶绿素含量。
采用Excel和SPSS软件对土壤理化性状及果实品质数据进行统计分析。
2 结果与分析
2.1施用有益菌对果园土壤理化性质及酶活性的影响
猕猴桃土壤适宜在pH值7.5以下的地块栽培[13],表1显示,施用有益菌均能使20年龄果园的原弱碱性土壤pH略降低,但变化并不显著,这可能是因为石灰性土壤具有一定的缓冲作用,所以导致其pH变化幅度不大[14];从土壤养分看,速效磷、全氮及铵态氮含量均较CK组有显著提高,且在0.05水平下差异显著,尤其是KJ组效果最为显著;上述各养分均有利于猕猴桃品质的提高[2,15]。KJ组全磷量略有升高,可能是由于农户施肥所致。从表1可以看出,只有硝态氮含量有一定程度的下降。这可能是因为猕猴桃优先吸收了硝态氮[16]。

表1 根际土壤理化性质
注:表中标注小写字母为邓肯测验结果,不同字母表示在0.05水平下差异显著。
Note: Different lowercases is the result of Duncan’s multiple-range test, and they stands forP≤0.05.
土壤酶作为土壤组分中最活跃的有机成分之一[17],是评价土壤肥力高低、生态环境质量优劣的一个重要生物指标[18],土壤中磷酸酶、脲酶、蛋白酶、多酚氧化酶、蔗糖酶活性提高有利于植物生长[19-23]。表2表明,施用有益菌能提高上述酶的活性,且与对照在0.05水平下差异显著。表3显示,施用有益菌能提高土壤酶活性,进而提高土壤养分,并促进果树对硝态氮的吸收。

表2 根际土酶活性测定
注:表中标注小写字母为邓肯测验结果,不同字母表示在0.05水平下差异显著。
Note: Different lowercases is the result of Duncan’s multiple-range test, and they stands forP≤0.05.
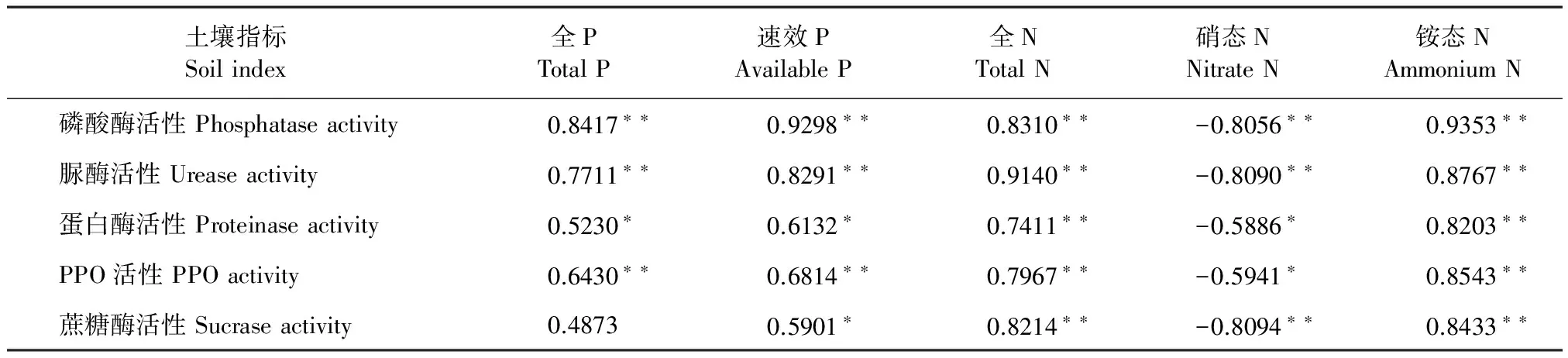
表3 土壤养分同土壤酶活的相关性分析
注: **为0.01水平显著相关,*为0.05水平显著相关。
Note: ** stands forP<0.01,* stands forP≤0.05.
2.2施用有益菌对果园土壤微生物数量的影响
土壤养分与土壤微生物数量极为密切[24],土壤理化性质改良后,更适合微生物生存与繁殖,进而可使其向土壤中分泌更多的酶。本试验结果(表4)证明,施用有益菌后,土壤真菌及放线菌数量无明显变化,但细菌数量明显增多,致真菌/细菌比值降低,且在0.05水平下差异显著。土壤中真菌数量以及真菌/细菌比值越低,土壤生态系统的稳定程度越高,土壤抑制病害能力越强[25-26]。所以施用有益菌能明显改良土壤理化性质及降低土壤真菌/细菌比值。
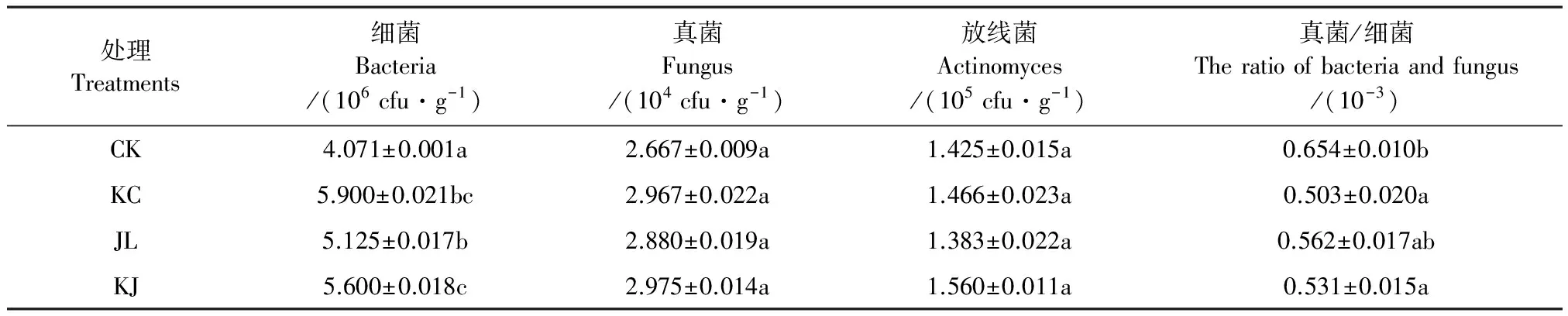
表4 土壤微生物数目测定
注:表中标注小写字母为邓肯测验结果,不同字母表示在0.05水平下差异显著。
Note: Different lowercases is the result of Duncan's multiple-range test, and they stands forP≤0.05.
2.3对果实品质的影响
表5表明,施用有益菌后,果实单果质量、硬度、可溶性糖含量、可滴定酸含量、叶绿素含量及VC含量较未处理健康果树都有不同程度的提高,尤其是枯草芽孢杆菌和解磷细菌配施的均在0.05水平下显著;可滴定酸含量较未处理果树有不同程度下降,且在0.05水平下显著,所以施用枯草芽孢杆菌和解磷细菌后猕猴桃果实品质均有一定程度的提高。
VC含量是猕猴桃果实品质的重要指标,为探究猕猴桃品质改良与土壤养分改良的关系,我们将猕猴桃果实VC含量同土壤理化指标进行了相关性分析。表6显示:VC含量同土壤指标显著相关,与硝态氮含量显著负相关,与其余指标显著正相关。在0.05且0.01水平下显著。由此可以看出,土壤养分对果实VC含量影响比较明显。土壤经有益菌处理后,土壤养分得到改良,果实VC含量同样受到影响,如表5数据所示,有益菌处理后的果实VC含量明显高于CK组。

表5 猕猴桃果实品质
注:表中标注小写字母为邓肯测验结果,不同字母表示在0.05水平下差异显著。
Note: Different lowercases is the result of Duncan's multiple-range test, and they stands forP≤0.05.
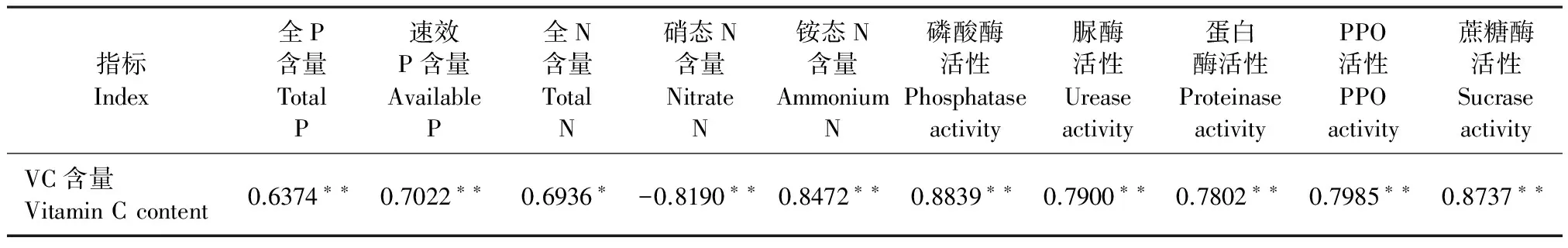
表6 果实Vc含量同土壤指标的相关性分析
注:**为0.01水平显著相关,*为0.05水平显著相关。
Note: ** stands forP<0.01,* stands forP≤0.05.
3 结 论
土壤是植物赖以生存的物质基础,同时又是植物-土壤-微生物生态系统中物质和能量交换的主要场所,猕猴桃生命活动所需的水分、无机营养及少量有机物质都是通过根系从土壤中吸收的[27],而土壤微生物可以将土壤中植物难以直接利用的物质加以分解或转化,使植物根系更容易吸收利用,有利于植物生长发育。
本试验结果表明,经有益菌处理后,20年龄的猕猴桃根围土壤真菌/细菌比值明显降低(与CK达显著差异),更适合微生物生长与繁殖,可以向土壤中分泌更多的酶,即磷酸酶活性、脲酶活性、蛋白酶活性、PPO活性、蔗糖酶活性均较对照有显著提高。且土壤酶活性与理化指标相关性分析证明,土壤相关酶活性的提高可对土壤速效磷、全氮及铵态氮含量的增加起很大作用。土壤营养成分有明显改善,速效P、全N、铵态N含量明显升高,硝态氮含量一定程度下降,可能是施用有益菌可以促进猕猴桃优先吸收硝态氮。
本试验证明,有益菌能够改良土壤质量,进而促进树体生理代谢,形成了良性的植物-土壤-微生物生态系统,进而提高果实品质。试验测定的猕猴桃果实硬度、单果质量、SSC含量、可溶性糖含量、可滴定酸含量、叶绿素含量、Vc含量等品质指标均佐证了这一点。施用了有益菌后,果园土壤养分及结构得到了改善,而果园产量和果实品质在很大程度上取决于果园土壤的养分状况[28-31]。结构好、养分协调的土壤,有利于果树根系生长及其对养分的摄取,有利于提高果树产量和果实品质[32]。因此通过向高龄猕猴桃园施用有益细菌,可以对土壤进行生物修复,更为可喜的是能够提高猕猴桃果实品质。对土壤进行生物修复是发展绿色农业必要措施。
[1]祝日耀.膨大剂会使猕猴桃味淡[J].农药市场信息,2005,(21):37.
[2]刘科鹏,黄春辉,冷建华,等.猕猴桃园土壤养分与果实品质的多元分析[J].果树学报,2012,29(06):1047-1051.
[3]周丽霞,丁明懋.土壤微生物学特性对土壤健康的指示作用[J].生物多样性,2007,(2):162-171.
[4]张亮,杨宇虹,李倩,等.自生固氮菌活化土壤无机磷研究[J].生态学报,2013,(7):2157-2164.
[5]党雯,郜春花,张强,等.解钾菌的研究进展及其在农业生产中的应用[J].山西农业科学,2014,(8):921-924.
[6]余贤美,侯长明,王海荣,等.枯草芽孢杆菌Bs-15在枣树体内和土壤中的定殖及其对土壤微生物多样性的影响[J].中国生物防治学报,2014,(4):497-502.
[7]Altomare C, Tringvoska I. Beneficial soil microorganisms, an ecological alternative for soil fertility management[J]. Genetics, Biofuels and Local Farming Systems, 2011,(7):161-214.
[8]林雁冰,薛泉宏,颜霞.覆盖模式及小麦根系对土壤微生物区系的影响[J].中国生态农业学报,2008,16(6):1389-1393.
[9]鲍士旦.土壤农化分析第3版[M].北京:中国农业出版社,2000.
[10]周礼恺,张志明.土壤酶活性的测定方法[J].土壤通报,1980,(5):37-38,49.
[11]赵玉梅,曹建康,姜微波.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[12]张治安.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004:160.
[13]满红.猕猴桃高效栽培技术关键[J].乡村科技,2014,(5):22.
[14]Linu M S, Stephen J, Jisha M S. Phosphate solubilizing Gluconacetobacter sp., Burkholderia sp. and their potential interaction with cowpea (Vigna unguiculata (L.) Walp.)[J]. Int. J. Agric. Res, 2009,4(2):79-87.
[15]刘科鹏.增加土壤有机质可提高猕猴桃品质[J].山西果树,2013,(5):55-56.
[16]禹婷,王永熙,刘航空.3种果树伤流液中氮素形态分析[J].西北林学院学报,2006,21(3):34-36.
[17]Marx M C, Wood M, Jarvis S C. A microplate fluorimetric assay for the study of enzyme diversity in soils[J]. Soil Biology and Biochemistry, 2001,33(12/13):1633-1640.
[18]刘善江,夏雪,陈桂梅,等.土壤酶的研究进展[J].中国农学通报,2011,(21):1-7.
[19]于群英.土壤磷酸酶活性及其影响因素研究[J].安徽技术师范学院学报,2001,(4):5-8.
[20]李东坡,武志杰,陈利军,等.长期定位培肥黑土土壤蔗糖酶活性动态变化及其影响因素[J].中国生态农业学报,2005,(2):102-105.
[21]杨梅,谭玲,叶绍明,等.桉树连作对土壤多酚氧化酶活性及酚类物质含量的影响[J].水土保持学报,2012,(2):165-169.
[22]叶家颖.土壤脲酶活性的研究[J].广西农业科学,1988,(3):29-31.
[23]郑洪元,张德生.土壤蛋白酶活性的测定及其性质[J].土壤通报,1981,(3):32-34.
[24]孙瑞莲,朱鲁生,赵秉强.长期施肥对土壤微生物的影响及其在养分调控中的作用[J].应用生态学报,2004,15(10):1907-1910.
[25]Ibekwe A M, Kennedy A C, Frohne P S, et al. Microbial Diversity along A Transect of Agronomic Zones[J]. FEMS Microbiology Ecology,2002,39(3):183-191.
[26]Doran J W, Sarrantonio M, Liebig M A. Soil health and sustainability[J]. Advances in Agronomy, 1996,56(8):1-54.
[27]杨妙贤,周玲艳,刘胜洪,等.猕猴桃果园土壤养分对果实品质的影响[J].林业科技开发,2014,(3):56-59.
[28]江泽普,韦广泼,谭宏伟.广西红壤果园土壤肥力演化与评价[J].植物营养与肥料学报,2004,(3):312-318.
[29]夏国海,陈英照,孙守如,等.黄河故道地区果园土壤和叶片营养特点研究[J].果树科学,1998,(3):207-211.
[30]魏钦平.苹果丰产优质土壤营养含量和比例优化方案研究[J].山东农业大学学报,1993,(1):7-14.
[31]王仁玑,庄伊美,陈丽璇,等.水涨龙眼丰产园营养状况的研究[J].中国果树,1991,(3):13-16.
[32]郗荣庭.果树栽培学总论(第3版)[M].北京:中国农业出版社,2000:35-78.
Bacillus subtilis and phosphobacteria effects on soil and fruit quality in kiwifruit orchards
SHAO Yang1, CUI Meng-qi1, Tian Xiao-hong2, CAO Cui-ling1, HU Jing-jiang1
(1.College of Life Sciences, Northwest A&F University, Yangling, Shaanxi 712100, China;2.CollegeofNaturalResourcesandEnvironment,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
The reaserch was to explore the effects of Bacillus Subtilis and Phosphobacteria, which supplied to the rooting zone of Kiwi fruit, on soil physical, chemical and microbial population in the rhizosphere soil and the fruit quality by orthogonal experiment of two factors and two levels in the field. The physical, chemical and microbial population of soil, leaves and fruits were measured respectively. Results showed that the trees dealt with both of Bacillus Subtilis and Phosphobacteria to the rooting zone had the best signification. The soil available P, ammonium N contents and phosphatase activity was 1.93, 1.34 and 2.15 times the amount of the unprocessed. The firmness, soluble sugar and Vitamin C content was 1.21, 1.06, 1.18 times the amount of the unprocessed. The unprocessed titratable acid was 88% of the trees dealt with both of Bacillus Subtilis and Phosphobacteria.The data being analyzed, fruit quality had a signification positive correlation with organic matter, available P contents and phosphatase activity. It is considerable to use both of Bacillus Subtilis and Phosphobacteria to improve the soil characteristic and the fruit quality.
Kiwi fruit; soil nutrients; fruit quality; improved analysis
1000-7601(2016)05-0180-05
10.7606/j.issn.1000-7601.2016.05.27
2015-11-20
西北农林科技大学创新与成果转化专项(XNY2013-49);杨凌示范区科技局科技计划项目(2014NY-40)
邵阳(1990—),女,辽宁鞍山人,硕士研究生在读,主要从事植物逆境生理研究。 E-mail:81754222@qq.com。
曹翠玲,E-mail:cuilingcao@163.com。
S663.4
A
