适应海南热带海洋环境产脂肪酶菌株的筛选及产酶条件研究
2016-11-01郭聪吴海武郭伟良朱彦博黄捷畅周永灿王世锋谢珍玉
郭聪,吴海武,2,郭伟良,朱彦博,黄捷畅,周永灿,王世锋,谢珍玉
(1.海南大学 海洋学院 海南省热带生物资源可持续利用重点实验室 海南省水生生物技术重点实验室,海南 海口570228;2.海南省农业科学院,海南 海口 571100)
适应海南热带海洋环境产脂肪酶菌株的筛选及产酶条件研究
郭聪1,吴海武1,2,郭伟良1,朱彦博1,黄捷畅1,周永灿1,王世锋1,谢珍玉1
(1.海南大学海洋学院海南省热带生物资源可持续利用重点实验室海南省水生生物技术重点实验室,海南海口570228;2.海南省农业科学院,海南海口571100)
从海南热带海水中分离筛选得到10株产脂肪酶菌,其中菌株LD-1302产脂肪酶活性最高。根据16S rDNA序列分析和生理生化试验结果,鉴定该菌为地衣芽孢杆菌Bacillus licheniformis。对该菌株的产酶条件进行优化,在pH 8、温度37℃、盐度32的条件下,经橄榄油诱导,起始浓度为3.75×105CFU/mL的LD-1302摇瓶发酵48 h时产脂肪酶活最高,脂肪酶活可达(34.97±1.45) U/mL。
脂肪酶;地衣芽孢杆菌;筛选;产酶条件
海南管辖海洋面积200多万km2,海洋资源丰富;不过,当前海水养殖产生的含大量残饵、动物残体的养殖废水及其它来源油脂性污水的任意排放,造成了该海区海洋环境的存在脂肪污染,严重影响当地海洋生态环境的健康(周永灿等,2013;Nejidat,2005)。因此,安全有效清除海南热带水产养殖和海洋环境中的脂肪是热带海洋生态环境修复和可持续利用的重要前提。脂肪酶是催化长链脂肪酸甘油酯水解和合成的羧酸酯酶,广泛存在于动植物和微生物,其中以微生物脂肪酶资源最为丰富;因其广泛的底物特异性、在有机溶剂中稳定性好、易于大规模生产及纯化等优点而成为当代酶工业最受瞩目的酶种之一(李鑫玲等,2011;彭立凤等,2006;闫云君等,2006),也是环境中脂肪降解的主要原动力。
海南为我国唯一的热带沿海地区,在长期自然进化过程中,海南地区形成了独特的微生物群落结构,存在丰富的产脂肪酶芽孢杆菌资源,为安全解决海南热带水产养殖和海洋环境中脂肪污染问题奠定了重要基础(朱彦博,2013;吴海武,2014)。不过,有关产脂肪酶芽孢杆菌的海南土著菌种的相关研究迄今尚未见报道。为此,本文试图从海南热带海洋环境中筛选产脂肪酶芽孢杆菌并阐述其产酶条件,这对于应用脂肪酶生物技术处理被油脂污染的热带海洋水体特别是热带养殖水体以及可持续发展热带海洋经济具有重大意义。
1 材料与方法
1.1材料
样品:从海南省乐东县球港、陵水县新村港、东方市板桥和三亚市南山等地的热带海水养殖环境中采集10份水样。
主要试剂:蛋白胨、橄榄油(主要脂肪酸链长为C16-C18)、椰子油(主要脂肪酸链长为C8-C20)、葵花籽油(主要脂肪酸链长为C16-C22)、聚乙烯醇、蔗糖、4%聚乙烯醇(PVA)溶液、1 mg/mL罗丹明B溶液和橄榄油乳化液(4%PVA溶液:橄榄油=3:1,v/v)。
主要仪器:PCR仪 (型号:5331,德国Eppendorf股份公司);冷冻离心机(型号:5180,德国Eppendorf股份公司);食品匀浆机(型号:HFJ-10,上海楚定分析仪器有限公司);倒置荧光相差微分数码显微镜(型号:DM2500,德国Leica仪器有限公司)。
1.2培养基
改良富集液体培养基:(NH4)2SO42 g/L,MgSO4·7H2O 0.5 g/L,K2HPO41 g/L,蛋白胨5 g/L,橄榄油乳化液100 mL/L,灭菌海水定容至1 L,pH 7.0,121℃灭菌20 min。
改良罗丹明B显色初筛培养基:(NH4)2SO42g/L,MgSO4·7H2O 1 g/L,K2HPO41 g/L,蛋白胨5 g/L,琼脂15 g/L,橄榄油乳化液100 mL/L,灭菌海水定容至1 L,pH 7.0,121℃灭菌20 min;灭菌后冷却至60℃加入6 mL罗丹明B溶液。
改良复筛固体培养基:蛋白胨10 g/L,MgSO4· 7H2O 1 g/L,K2HPO41 g/L,橄榄油乳化液100 mL/L,琼脂15 g/L,灭菌海水定容至1 L,pH 7.0,121℃灭菌20 min。
生长培养基:(NH4)2SO42 g/L,MgSO4·7H2O 1 g/L,K2HPO41 g/L,蛋白胨5 g/L,橄榄油乳化液100 mL/L,灭菌海水定容至1 L,pH 7.0,121℃灭菌20 min。
计数固体培养基:蛋白胨10 g/L,酵母膏5g/L,琼脂15g/L,灭菌海水1L,pH7.0,121℃灭菌20min。
改良产酶发酵培养基:蛋白胨10g/L,(NH4)2SO41 g/L,K2HPO41.5 g/L,MgSO4·7H2O 2 g/L,橄榄油10g/L,pH7.0,灭菌海水定容至1L,pH7.0,121℃灭菌20 min。
1.3产脂肪酶菌株的筛选
吸取10mL水样至100mL灭菌海水中,180r/min、30℃振荡10 min;并在80℃下水浴15 min,取出、静置。吸取10 mL上清菌液至100 mL富集液体培养基中,在180 r/min、30℃下培养。2 d后,吸取5 mL富集培养菌液至100 mL新鲜的富集液体培养基中,进行二次富集,如此连续富集培养3次。吸取1 mL第3次富集培养菌液至9 mL灭菌海水中,依次倍比稀释至10-4;吸取100 μL稀释度为10-4的菌液在罗丹明B显色初筛培养基上涂布,挑选在罗丹明B显色初筛培养基上水解圈较大且在350 nm紫外灯下橙黄色荧光亮斑较大的菌落为筛选分离菌株。挑取菌落继续于罗丹明B显色初筛培养基上重复3次划线分离培养,直到菌落形态一致。挑取罗丹明B显色初筛培养基上的单菌落至复筛固体培养基上重复划线培养,直至单菌落不再染上罗丹明B显色剂。挑选在复筛固体培养基上的单菌落至改良产酶发酵培养基中,于200 r/min、30℃下振荡培养48 h,测定筛选得到菌株的产脂肪酶活性,以最优产脂肪酶活性的菌株为目的菌株。
1.4菌株鉴定
1.4.1菌落形态及镜检
挑取纯化单菌落于计数固体培养基上划线,参照沈萍等的方法进行革兰氏染色、芽孢染色(沈萍等,2005)。
1.4.216S rDNA序列测定和分析
单菌落振荡培养18 h后,按照北京艾德莱生物科技有限公司的细菌基因组DNA快速提取试剂盒的说明提取目的菌株DNA,对菌株进行16S rDNA序列的 PCR扩增与测序 (徐先栋 等,2012)。
1.4.3生理生化鉴定
挑取纯化单菌落,参照东秀珠的方法进行VP测定、丙酸盐、淀粉水解、明胶水解、V-P培养物终pH>7、柠檬酸盐、55℃、pH 5.7、pH 6.8、NaCl 5%、NaCl 7%等理化指标试验(东秀珠等,2001)。
1.5活菌总数计数
吸取6 mL目的菌株过夜培养液(于生长培养基中培养10-12 h)转入盛有60 mL生长培养基的三角瓶中,混匀后分别吸取5 mL混合液至标记0、1.5、3、4、6、8、10、12、14、16、18、20的12支无菌大试管中。于30℃、250 r/min条件下培养,并于相应时间点将标有对应时间的大试管取出,分别吸取1 mL各个时间点的生长培养菌液至9 mL灭菌海水中,依次倍比稀释至10-5。吸取100 μL稀释度为10-5的菌液于计数固体培养基上涂布、计数。
1.6脂肪酶活力的测定
在40℃、pH 7.5条件下,以1 min催化水解反应底物(橄榄油)释放1 μmol脂肪酸的酶量定义为1个脂肪酶活力单位(U) (施巧琴,1998)。摇瓶发酵48 h后,吸取发酵上清液于8 000 r/min、4℃下离心5 min,吸取上清酶液备用,参照李建武等的方法测定所筛菌株的产脂肪酶活(李建武等,1994)
1.7产酶条件的优化
改良产酶发酵培养基瓶装量为50 mL/250 mL时,根据接种量、碳源、pH、温度、盐度等影响产脂肪酶的因素,依次进行LD-1302产脂肪酶活条件的优化。
1.7.1接种量对产酶的影响
研究菌起始浓度为5×105CFU/mL的LD-1302的接种量分别为0.50%、1.00%、1.50%、2.00%、2.50%时,对LD-1302产脂肪酶的影响,每隔24 h测定酶活一次,连续测定3次,筛选最适温度接种量。
1.7.2碳源对产酶的影响
研究以1%的橄榄油、椰子油、葵花籽油为碳源时,对LD-1302产脂肪酶活性的影响,每隔24 h测定酶活一次,连续测定3次,筛选最适碳源。
1.7.3pH对产酶的影响
研究改良产酶发酵培养基起始pH分别为5、6、7、8、9时,对LD-1302产脂肪酶的影响,每隔24 h测定酶活一次,连续测定3次,筛选最适pH。
1.7.4温度对产酶的影响
研究改良产酶发酵培养基摇瓶发酵温度分别为27℃、37℃、47℃时,对LD-1302产脂肪酶的影响,每隔24 h测定酶活一次,连续测定3次,筛选最适温度。
1.7.5盐度对产酶的影响
研究海水盐度分别为28、30、32、34、36时,对LD-1302产脂肪酶的影响,每隔24 h测定酶活一次,连续测定3次,筛选最适盐度。
1.8采用SPSS
18.0统计软件分析数据,并采Tukey法对影响酶活的因素进行分析比较。
2 结果
2.1产脂肪酶菌株的筛选
从罗丹明B初筛固体培养基上筛选得到10株水解圈较大的菌株,这些菌株在350 nm紫外灯下观察,在菌落周围均有明显的橙黄色荧光圈(图1)。重复3次摇瓶发酵后,10株菌的产脂肪酶活性存在一定的差异(表1),其中菌株LD-1302的产脂肪酶活性最高,酶活达(22.58±0.09) U/mL。发酵24 h后,LD-1302培养基表面存在不溶于水且浮在水面的絮凝状乳白色蜡样物质,48 h后该絮凝状乳白色蜡样物质消失。

图1 350 nm紫外灯下产脂肪酶菌落周围的橙黄色荧光圈
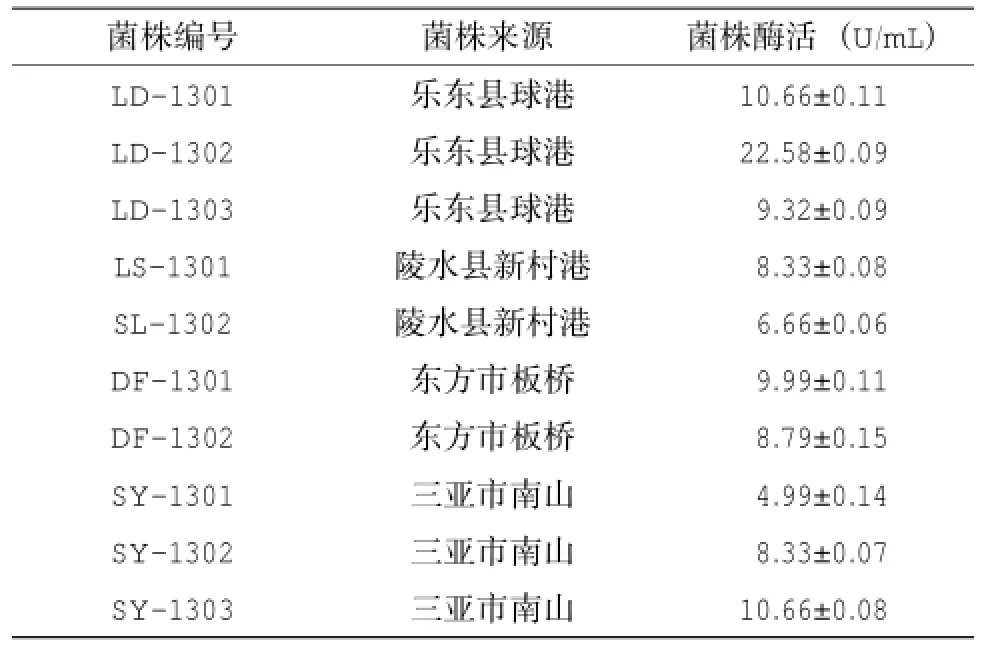
表1 10株产脂肪酶菌株的酶活
2.2菌株鉴定结果
2.2.1菌落形态及镜检
LD-1302菌落形状不规则、凸面、白色不透明、边缘为毛发状;革兰氏染色镜检呈紫色,为G+菌;芽孢染色镜检可观察到绿色的芽孢、显红色的营养体。
2.2.216S rDNA序列测定与分析
以菌株LD-1302的DNA为模版,经细菌16SrDNA通用引物扩增获得序列长度为1 512 bp的基因片段,对其测序并提交Genbank核酸序列数据库。同源性分析结果表明,菌株LD-1302的16S rDNA基因序列与Genbank中的BCRC 15413等15株芽孢杆菌属细菌的同源性达99.9%以上,利用MEGA 6.1构建系统进化树,结果表明该菌株与地衣芽孢杆菌B.licheniformis聚为一支(图2)。初步鉴定菌株LD-1302为地衣芽孢杆菌。
2.2.3生理生化鉴定
菌株LD-1302可于55℃下生长、淀粉水解试验菌落四周出现无色透明圈、明胶水解培养基出现液化现象、V-P试验培养基显红色、V-P试验培养基的终pH显酸性、柠檬酸盐及丙酸盐培养基显蓝色、均可在NaCl 5%、NaCl 7%的肉汤培养基中生长、在pH5.7、pH6.8的肉汤培养基中生长良好,符合对地衣芽孢杆菌的描述(东秀珠等,2001)。结合革兰氏染色、芽孢染色及16S rDNA序列测定与分析结果,鉴定菌株LD-1302为地衣芽孢杆菌。
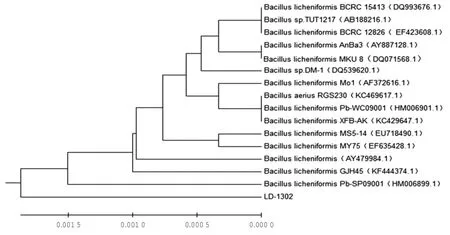
图2 菌株LD-1302的16S rDNA序列系统发育树
2.3活菌总数计数
地衣芽孢杆菌LD-1302在以橄榄油为唯一碳源的生长培养基中延滞期较短,培养6 h活菌总数达到最高,为(94.67±3.21)×106CFU/mL,LD-1302在6~20 h内生长较为稳定,表明该菌株可利用有机碳源橄榄油,并在6 h时将培养基营养物质基本消耗殆尽(图3)。

图3 菌株LD-1302的生长曲线
2.4接种量对LD-1302产酶活性的优化
由图4可知:以橄榄油为碳源时,菌株LD-1302的最适接种量为1.50%,即菌株起始接种浓度为3.75×105CFU/mL时,产脂肪酶活性最高,酶活可达到(31.64±0.34) U/mL,且在最少接种浓度为1.25×105CFU/mL时,也存在较高的产脂肪酶活性。采用SPSS 18.0统计软件分析数据可知:接种量P=0.00<0.01、时间P=0.001<0.01,表明接种量、时间均对酶活影响极显著;由接种量-酶活的同类子集结果可知:接种量为0.50%、2.50%时,酶活均值分别为15.35 U/mL、17.87 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异;接种量为1.00%、2.00%时,酶活均值分别为20.68 U/mL、19.02 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,但产酶效果优于前两者;接种量为1.50%时,酶活均值为26.53 U/mL,与前四者分属不同子集,表明为接种量为1.50%时,产脂肪酶效果最好;由时间-酶活的同类子集结果可知:72 h时,酶活均值为17.72 U/mL,24 h、48 h时,酶活均值分别为21.35 U/mL、20.60 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,但产脂肪酶活优于前者。
2.5碳源对LD-1302产酶活性的影响
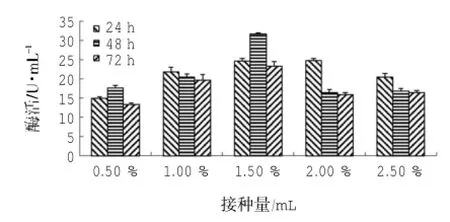
图4 接种量对LD-1302利用橄榄油产脂肪酶的影
由图5可知:最适接种量的LD-1302经橄榄油、椰子油、葵花籽油诱导,最高产脂肪酶活分别为(23.42±0.84)U/mL、(10.76±0.51)U/mL、(9.77± 0.51)U/mL。采用SPSS 18.0统计软件分析数据可知:碳源、时间的P=0.00<0.01,表明碳源、时间均对酶活影响极显著;由碳源-酶活的同类子集结果可知:以椰子油、葵花籽油为碳源时,酶活均值均为8.51 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,而以橄榄油为碳源时,酶活均值为17.54 U/mL,与椰子油、葵花籽油分属不同子集,表明以橄榄油为碳源时,产脂肪酶效果最好;由时间-酶活的同类子集结果可知:24 h、72 h时,酶活均值分别为10.84 U/mL、9.06 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,48 h时,酶活均值为14.66 U/mL,与前两者分属不同子集,表明48 h时,产脂肪酶活效果最好;同时椰子油、葵花籽油也可诱导该菌株产生较高的酶活。

图5 碳源对产酶的影响
2.6pH对LD-1302产酶活性的影响
接种量为3.75×105CFU/mL、橄榄油、椰子油、葵花籽油为有机碳源时,菌株LD-1302在pH 8下有最大脂肪酶活,分别为(29.97±0.33)U/mL、(19.98±0.23)U/mL、(19.98±0.67)U/mL。(图6(a)、图6(b)、图6(c))。
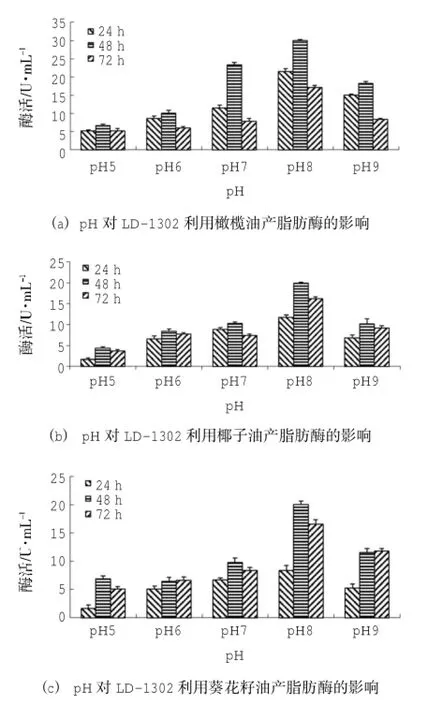
图6 pH对LD-1302产脂肪酶的影响
采用SPSS 18.0统计软件分析数据可知:pH、时间的P=0.00<0.01,表明pH、时间均对酶活影响极显著。由图6-1 pH-酶活的同类子集结果可知:pH 5、pH 6时,酶活均值分别为5.69 U/mL、8.21 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异;pH 7、pH 9时,酶活均值分别为14.21 U/mL、13.84 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,但产脂肪酶活效果优于前两者;pH 8时,酶活均值为22.87 U/mL,与pH 5、pH 6、pH 7、pH 9分属不同子集,表明pH 8时,产脂肪酶活效果最好;由图6(a) 时间-酶活的同类子集结果可知:24 h、48 h、72 h时,酶活均值分别为12.36 U/mL、17.65 U/mL、8.88 U/mL,分属不同子集,表明三者对酶活的影响有明显差异,且48 h时,产脂肪酶活效果最好。由图6(b)pH-酶活的同类子集结果可知:pH 5时,酶活均值为3.18 U/mL;pH 6、pH 7、pH 9时,酶活均值分别为7.52 U/mL、8.80 U/mL、7.66 U/mL,在同一子集中,表明三者对产脂肪酶活无明显差异,但产脂肪酶活效果优于前者;pH 8时,酶活均值为15.98 U/mL,与pH 5、pH 6、pH 7、pH 9分属不同子集,表明pH 8时,产脂肪酶活效果最好;由图6(b) 时间-酶活的同类子集结果可知:24 h时,酶活均值为7.10 U/mL;48 h、72 h时,酶活均值分别为9.99 U/mL、8.79 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,但产脂肪酶活优于前者,且在48 h时酶活均值最大。由图6(c)pH-酶活的同类子集结果可知:pH 5、pH 6时酶活均值分别为4.55 U/mL、6.03 U/mL,且在同一子集中,表明两者对产脂肪酶活无明显差异;pH 7、pH 9时酶活均值分别为8.25 U/mL、9.51 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,但产脂肪酶活效果优于前者;而pH 8时酶活均值为14.95 U/mL,且与pH 5、pH 6、pH 7、pH 9分属不同子集,表明pH 8时,产脂肪酶活效果最好;由图6(c) 时间-酶活的同类子集结果可知:24 h时酶活均值为5.39 U/mL,48 h、72 h时酶活均值分别为10.92 U/mL、9.66 U/mL,在同一子集中,两者对产脂肪酶活无明显差异,但产脂肪酶活优于前者,且在48 h时酶活均值最大。因此,菌株LD-1302的最适pH为8,且在pH 5~pH 9的培养条件下也存在一定的产脂肪酶活性。
2.7温度对LD-1302产酶活性的影响
接种量为3.75×105CFU/mL、pH为8、以橄榄油、椰子油、葵花籽油为碳源时,菌株LD-1302在37℃条件下摇瓶发酵48h后产脂肪酶活最高,依次为(30.97±0.58)U/mL、(20.98±1.2)U/mL、(20.31±0.58)U/mL;产脂肪酶活性跟温度的关系均为37℃>27℃>47℃(图7)。
采用SPSS 18.0统计软件分析数据可知:温度、时间的P=0.00<0.01,表明温度、时间均对酶活影响极显著。由7(a)温度-酶活的同类子集结果可知:27℃、47℃时酶活均值分别为16.17 U/ mL、16.35 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异;37℃时酶活均值为25.97 U/ mL,且与前两者分属不同子集,表明37℃时,产脂肪酶活效果优于前两者;由7(a)时间-酶活的同类子集结果可知:24 h、72 h时酶活均值分别为18.54 U/mL、17.16 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,而48 h时酶活均值为22.79 U/mL,且与前两者分属不同子集,表明培养时间为48 h时,产脂肪酶活效果最好。由7(b)温度-酶活的同类子集结果可知:27℃、47℃时酶活均值分别为10.02 U/mL、9.06 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异;37℃时酶活均值为14.95 U/mL,且与前两者分属不同子集,表明37℃时,产脂肪酶活效果优于前两者;由7(b)时间-酶活的同类子集结果可知:24 h、72 h时酶活均值分别为9.95 U/mL、9.73 U/mL,在同一子集中,表明两者对产脂肪酶活无明显差异,而48 h时酶活均值为14.35 U/mL,且与前两者分属不同子集,表明培养时间为48 h时,产脂肪酶活效果最好。由7(c)温度-酶活的同类子集结果可知:27℃、37℃、47℃时酶活均值分别为7.69 U/mL、14.91 U/mL、10.84 U/mL,分属不同子集,表明三者对产脂肪酶活有明显差异,且37℃时产脂肪酶活效果最好;由7(c)时间-酶活的同类子集结果可知:24h、48h、72 h时酶活均值分别为7.47 U/ml、15.39 U/ml、10.58 U/ml,分属不同子集,表明三者对产脂肪酶活有明显差异,且培养时间为48 h时,产脂肪酶活效果最好。因此,菌株LD-1302的最适产酶温度为37℃,且在27℃、47℃的培养条件下也存在一定的产脂肪酶活性。
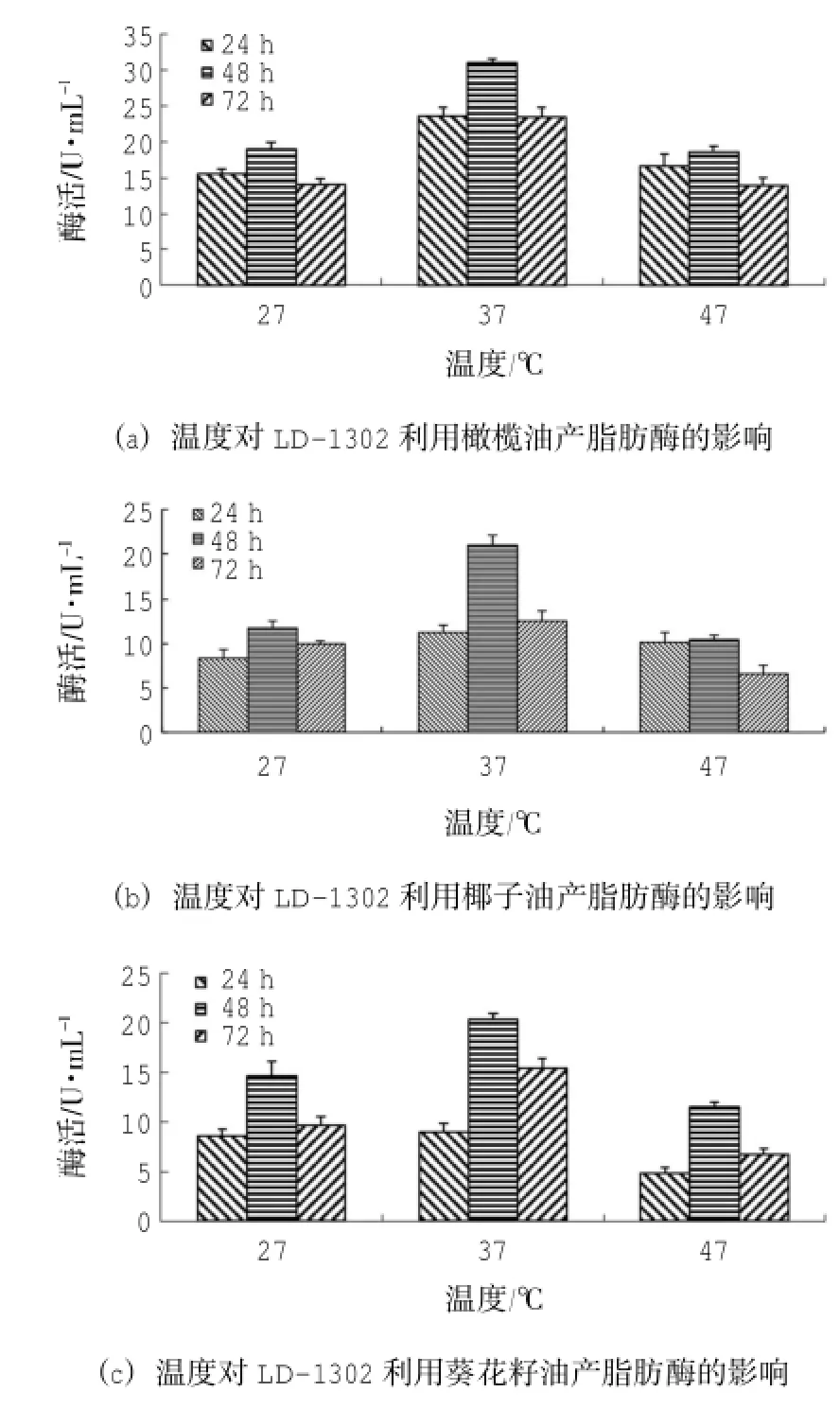
图7 温度对LD-1302产脂肪酶的影响
2.8盐度对LD-1302产酶的优化
由图8可知:以橄榄油为有机碳源、接种量为3.75×105CFU/mL、pH 8、37℃时,菌株LD-1302在盐度32时有最大脂肪酶活,为(34.97±1.45)U/mL。采用SPSS 18.0统计软件分析数据可知:盐度、时间的P=0.00<0.01,表明盐度、时间均对酶活影响极显著;由盐度-酶活的同类子集结果可知:盐度36时酶活均值为22.88 U/mL;盐度28、30、34时酶活均值分别为25.71U/mL、28.60U/mL、27.29U/mL,在同一子集中,表明三者对产脂肪酶活无明显差异,但产脂肪酶活效果略优于前者;盐度32时酶活均值为30.59 U/mL,且与前四者分属不同子集,表明盐度32时,产脂肪酶活效果最好;由时间-酶活的同类子集结果可知:24 h、48 h、72 h时酶活均值分别为27.72U/mL、30.65U/mL、22.68U/mL,分属不同子集,表明三者对酶活的影响有明显差异,且培养时间为48 h时,产脂肪酶活效果最好。随着盐度的增加或减少,菌株LD-1302的产脂肪酶活性都有一定程度的降低,尤其是随盐度的增加,脂肪酶活下降较为显著。
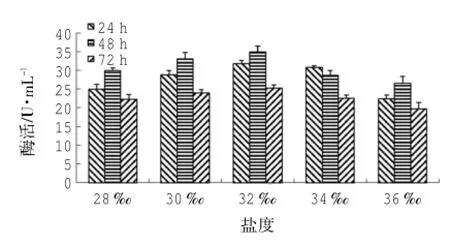
图8 盐度对LD-1302利用橄榄油产脂肪酶的影响
3 讨论
本研究采用高温水浴法从海南热带海水中筛选得到产脂肪酶活性较高的地衣芽孢杆菌LD-1302。当前,已报道的产脂肪酶芽孢杆菌主要有枯草芽孢杆菌、芽孢杆菌B5-12、芽孢杆菌WF63、蜡样芽孢杆菌B.cereus等(胡德朋 等,2008;刘秀花等,2006;黄鹭强等,2010;Akanbi et al.2010),其脂肪酶活依次为2.8 U/mL、24.8U/mL、6.33U/mL、2.51 U/mL,均低于菌株LD-1302的酶活。菌株LD-1302最适应用于盐度32、pH 8、温度37℃的海水环境,在盐度28~36、pH 5~9、27℃~47℃的海水条件下也存在较稳定产脂肪酶活性,并可在蔗糖等速效碳源及橄榄油、椰子油和葵花籽油等有机碳源的诱导下产较高脂肪酶活,这与本研究基于海水环境下筛选产脂肪酶活性菌株并在该环境条件下阐述影响其产酶活性的主要环境因素直接相关。
有关学者筛选的产脂肪酶活性的菌株均是在淡水或者添加NaCl不超过10‰的环境下筛选的(李鑫玲等,2011;胡德朋等,2008;刘秀花等,2006;黄鹭强等,2010;Akanbi et al,2010;魏涛 等,2011;陈林林等,2010;刘秀花 等,2006;Eltayib et al,2010),尽管这些菌株也存在一定的产脂肪酶活性,但其对海水环境的适应性尚未见报道。海水中含有Li+、K+、Ca2+、Mg2+、Zn2+、Sr2+、Ba2+等多种离子,存在较高渗透压,对芽孢杆菌等细菌产脂肪酶、蛋白酶、淀粉酶等活性存在抑制作用(曹煜成等,2005;朱彦博等,2013),导致众多在盐度很低及不含上述离子条件下存在产脂肪酶活较高的菌株的产酶活性大大降低甚至消失。从菌株LD-1302的16S rDNA序列系统发育树可知,虽然菌株LD-1302与Genbank中其他菌株的同源性均为99.9%,却没有明显地高度聚为一支,由此我们推断菌株LD-1302很可能为海南热带海洋环境中的地衣芽孢杆菌菌株,比目前常用的芽孢杆菌对热带海水环境具有更强的适应能力。这可能是在长期的历史进化过程中,海南独特的热带沿海地理环境形成了独特的微生物细菌地理种群。
橄榄油的主要成分为棕榈酸C16H32O2、亚油酸C18H32O2、油酸 C18H34O2、硬脂酸C18H36O2等的甘油三酯(汤富彬等,2013),菌株LD-1302产生的脂肪酶可将这些甘油三酯分解为C16-C18的游离高级脂肪酸,这些游离高级脂肪酸不溶于水浮于水的表面形成絮凝状乳白色蜡样物质,这是菌株LD-1302发酵24 h后在三角瓶中产生的浮于培养基表面的絮凝状乳白色蜡样物质的原因,随着发酵时间的延长,这些絮凝状乳白色蜡样高级脂肪酸的混合物逐渐消失,推测菌株LD-1302除了产脂肪酶外,还可能产生烃类水解酶等其它酶类,将絮凝状乳白色蜡样物质分解为水溶性物质或小分子气体。石油是一类以C6-C20的烷烃、环烷烃、芳香烃类为主的油质,近年来,我国海面溢油与深海溢油事件时有发生,这严重破坏了海洋生态环境,一定程度上制约了海洋经济的可持续健康发展(马丽等,2013;廖国祥等,2011;杨建强等,2011),而微生物修复技术因高效安全、环境友好、无二次污染等优势,被逐渐应用于修复溢油、深海水产养殖等造成的海洋环境污染(王丽娜等,2013;郑天凌等,2001),所以菌株LD-1302很可能对被石油污染的热带海洋环境存在较好的修复作用,当然,这还有待进一步的深入研究。
Akanbi T O,Kamaruzaman A L,Abu Bakar F,et al,2010.Highly thermostable extracellular lipase-producing Bacillus strain isolated from a Malaysian hotspring and identified using 16S rRNA gene sequencing.International Food Research Journal,(17):45-53.
Eltayib H A,Tripti R,Datta M A,2010.Thermostable Alkaline Lipase from a Local Isolate Bacillus subtilis EH 37:Characterization, Partial Purification,and Application in Organic Synthesis.Applied Biochemistry and Biotechnology,(160):2102-2113.
Nejidat A,2005.Nitrification and occurrence of salt-tolerant nitrifying bacteria in the Negev desert soils.FEMS microbiology ecology,52 (1):21-29.
曹煜成,李卓佳,冯娟,等,2005.地衣芽孢杆菌胞外产物消化活性的研究.热带海洋学报,24(6):6-12.
陈林林,辛嘉英,张颖鑫,等,2010.粗状假丝酵母产脂肪酶发酵条件的优化.食品工业科技,31(1):183-185.
东秀珠,蔡妙英,等,2001.常见细菌系统鉴定手册.北京:科学出版社,353-354.
胡德朋,唐家毅,曹昱,等,2008.枯草芽孢杆菌的分离鉴定及酶系分布的研究.水产科学,27(2):86-88.
黄鹭强,谢必峰,黄建忠,等,2010.芽孢杆菌WF63脂肪酶分离纯化及酶学性质.云南民族大学学报(自然科学版),19(4):290-293.
李建武,箫能,余瑞元,等,1994.生物化学实验原理与方法.北京:北京大学出版社,3-11.
李鑫玲,孙晓菲,孟楠,等,2011.产脂肪酶菌株的筛选及产酶条件优化.食品研究与开发,32(6):119-120.
廖国祥,杨建强,高振会,等,2011.深海环境中溢油输移扩散的初步数值模拟.海洋通报,30(6):707-712.
刘秀花,刘茵,梁峰,2006.一株产脂肪酶芽孢杆菌的发酵条件及酶学特性.湖北农业科学,45(4):509-511.
马丽,李吉鹏,陆志强,等,2013.海洋溢油生态损害简易评估方法研究.海洋通报,32(1):113-120.
彭立凤,赵汝淇,谭天伟,2006.微生物脂肪酶的应用.食品与发酵工业,26(3):68-73.
沈萍,范秀容,李广武,2005.微生物实验.北京:高等教育出版社,31-32.
施巧琴,1998.碱性脂肪酶的研究.微生物学通报,8(3):108-110.
汤富彬,沈丹玉,刘毅华,等,2013.油茶籽油和橄榄油中主要化学成分分析.中国粮油学报,28(7):108-113.
王丽娜,2013.海洋近岸溢油污染微生物修复技术的应用基础研究.中国海洋大学.
魏涛,封盛学,毛多斌,等,2011.根霉ZZ-3脂肪酶发酵条件的优化及酶学性质研究.食品工程,(2):20-23.
吴海武,2014.净化水质热带芽孢杆菌的筛选、复方研制及效果研究.海南大学.
徐先栋,谢珍玉,欧阳吉隆,等,2012.褐点石斑鱼脱鳞病病原菌的分离与鉴定.海洋科学,36(2):67-74.
闫云君,舒正玉,杨江科,2006.细菌脂肪酶的结构和功能研究进展.食品与生物技术学报,(4):121-126.
杨建强,张秋艳,罗先香,等,2011.深海溢油生态损害快速评估模拟研究.海洋通报,30(6):702-706.
郑天凌,庄铁城,蔡立哲,等,2001.微生物在海洋污染环境中的生物修复作用.厦门大学学报(自然科学版),40(2):524-534.
周永灿,张本,谢珍玉,等,2013.海南省潜在海水增养殖区研究.海洋出版社,289-290.
朱彦博,2013.海南土著芽孢杆菌筛选、复合及其水质净化效果研究.海南大学.
朱彦博,唐叶玲,陈圣丰,等,2013.盐度、温度和pH对2株海南地衣芽孢杆菌相对蛋白酶活性的影响.海南大学学报(自然科学版,31(2):133-138.
(本文编辑:袁泽轶)
Screening of lipase producing strains adapting to the Hainan tropical marine environment and study on the lipase producing conditions
GUO Cong1,WU Hai-wu1,2,GUO Wei-liang1,ZHU Yan-bo1,HUANG Jie-chang1, ZHOU Yong-can1,WANG Shi-feng1,XIE Zhen-yu1
(1.Key Laboratory of Hainan University for Sustainable Exploitation of Tropical Biotic Resources,Key Laboratory of AquaticBiological Technology of Hainan,College of Marine Science,Hainan University,Haikou 570228;2.Hainan Academy of Agricultural Sciences,Haikou 571100,China)
10 lipase-producing bacterial strains were isolated from Hainan tropical seawater,and the lipase-producing activity of strain LD-1302 was the highest.The strain LD-1302 was identified as Bacillus licheniformis based on 16S rDNA sequence analysis and physiological and biochemical tests.The lipase fermentation condition for the strain LD-1302 was studied on the effect of carbon sources,pH,temperature,inoculation volume,lasting time and salinity,in the seawater environment with pH 8,the salinity of 32,the initial concentration of 3.75×105CFU/mL of LD-1302,which was fermentation of lipase-producing induced by the optimum carbon source of olive oil,and the highest lipase activity was produced in the fermentation of 48 h,and the lipase activity reached the maximal level of(34.97±1.45)U/mL.
lipase;bacillus licheniformis;screening;lipase-producing condition
S913
A
1001-6932(2016)04-0427-09
10.11840/j.issn.1001-6392.2016.04.010
2015-05-07;
2015-07-26
海南省产学研一体化专项资金项目(CXY20130028);海南省重大科技项目(ZDZX2013014);农业科技成果转化资金项目(2011GB2F200009);国家自然科学基金(41466002)。
郭聪(1989-),女,硕士研究生,主要从事水产动物健康养殖与病害控制技术研究。电子邮箱:1257303447@qq.com。
谢珍玉,博士,教授。电子邮箱:xiezyscuta@163.com。
