NGF对鸡胚背根神经节神经突起生长作用的机制研究
2016-10-31李世鹏李佳彧吕晓民
方 琳, 李世鹏, 李佳彧, 吕晓民
NGF对鸡胚背根神经节神经突起生长作用的机制研究
方琳1,李世鹏2,李佳彧3,吕晓民4
目的探讨神经生长因子(nerve growth factor,NGF)促进鸡胚背根神经节(dorsal root ganglion,DRG)神经突起生长的作用机制。方法实验采用9 d的鸡胚分离背根神经节,原代培养法,观察鸡胚DRG的体外生长情况。通过半定量PCR检测诱导型一氧化氮合酶(iNOS)mRNA表达,采用NO检测试剂盒检测NO释放水平。结果NGF能明显促进鸡胚背根神经节神经突起生长,同时可见NGF抑制iNOS mRNA表达,NO检测结果显示,添加NGF培养的背根神经节上清NO分泌水平明显降低,与阴性对照组比较差异显著(P<0.05)。结论NGF可促进鸡胚背根神经节神经突起生长,其作用与其下调iNOS mRNA表达及抑制神经损伤因子NO释放有关。
神经生长因子;神经突起;一氧化氮
神经生长因子(Nerve growth factor NGF)是神经营养因子家族中最早发现的神经生长调节因子[1],NGF的研究对神经科学的发展起了巨大的推动作用。NGF对脑内、特别是基底前脑胆碱能神经元的发生、存活、损伤的保护与修复等方面起着主要的作用。先前的研究已经证实NGF在促进神经突起生长和神经元的分化等方面都具有重要作用[2~4]。但是NGF对鸡胚背根神经节(Dorsal root ganglion,DRG)神经突起生长的作用机制尚不清楚。为了进一步探讨NGF作用机制,本研究采用9日龄的鸡胚背根神经节,体外原代培养法,通过进一步分析诱导型一氧化氮合酶(iNOS)mRNA表达,以及DRG培养上清中神经损伤因子NO释放水平,探讨NGF对DRG神经突起生长促进作用的机制。
1 材料与方法
1.1实验材料9日龄鸡胚(购自长春市种鸡厂),进行3次独立试验,共用鸡胚60只。DMEM培养基为GIBCO公司产品,鼠神经生长因子(NGF) 购自武汉海特生物制药股份有限公司,NO测定试剂盒购自Promega公司。
1.2实验方法
1.2.1鸡胚神经节的制备与培养48孔培养板用1 mg/ml多聚赖氨酸,37 ℃包被2 h,0.01 mol/L磷酸盐缓冲溶液(PBS)冲洗3~4次备用。取9日龄的鸡胚,按本室常规方法获取鸡胚背根神经节[5,6]。在各椎孔处分别夹起神经节,放于预先置有0.5%小牛血清DMEM培养液200 μl的培养孔内,阴性对照组每孔加入0.5%小牛血清DMEM培养液200 μl;NGF 组每孔加入终浓度4 ng/ml的NGF。在37 ℃、5% CO2培养箱培养72 h,在显微镜下观察DRG神经突起的生长状态。
1.2.2鸡胚神经节神经突起的生长判定用倒置显微镜观察,通过统计学分析,比较NGF组与阴性对照组的神经突起数量和长度,由于3 d时的DRG神经突起生长明显,所以我们选取3 d时对神经突起的数量与长度进行判定。在各实验组分别对每个神经节选择5个最长的神经突起计算平均值,以DRG边缘作为测量的起点,以神经突起的最末端为测量的终点[7]。
1.2.3半定量PCR48孔板培养,每孔放40个DRG,在神经节培养3 d时,用1 ml预冷的PBS洗1次,加入TRIZOL试剂1 ml提取DRG总RNA,紫外分光光度计测RNA含量。iNOS的正向引物是5’-ggtcaagaagaagcctttcgca-3’,反向引物是5’-gcttgcccaatagccaccttca -3’。GAPDH的正向引物5’- gtccaagtggtggccatcaa -3’,反向引物5’- gctgagggagctgagatgat -3’。二步法RT-PCR扩增的特异cDNA片段,半定量PCR反应总体积25 μl,cDNA 3 μl,10×PCR缓冲液2.5 μl,dNTP Mix 1.5 μl,Taq DNA聚合酶0.3 μl,上游引物1 μl,下游引物1 μl,加无菌双蒸水至总体积25 μl。反应条件为预变性 95 ℃,90 s,变性 94 ℃,30 s,退火53 ℃,30 s,延伸72 ℃,1 min,共35个循环,最后延伸72 ℃,10 min。以GAPDH作为内参照半定量,各样本表达强度=样本灰度值/GAPDH灰度值。
1.2.4NO检测为了探讨NGF促神经节神经突起生长作用机制是否与神经损伤因子NO分泌有关,实验采用NO检测试剂盒测定神经节培养上清中有关NO稳定氧化代谢产物亚硝酸盐(NO2-)水平[8]。50 μl培养上清加入96孔平底酶标板中,按试剂盒操作说明加入试剂,室温孵育10 min,540 nm检测光吸收值(A540 nm),采用培养液稀释的亚硝酸钠A540 nm值绘制标准曲线。
2 结 果
2.1NGF促进鸡胚背根神经节神经突起生长试验采用4 ng/ml NGF培养鸡胚背根神经节,结果显示,0.5% FCS-DMEM培养液培养3 d的阴性对照组未见明显DRG神经突起生长(见图1A),NGF 4 ng/ml组突起生长明显(见图1B),突起长度126±4.3 μm,与阴性对照组比较差异显著(见图2、图3),P<0.05。上述资料提示NGF能够促进DRG神经突起生长,与文献报道一致[2]。
2.2NGF对一氧化氮合酶(iNOS)mRNA表达的影响通过半定量RT-PCR检测iNOS mRNA表达,计算各样本表达强度,结果发现NGF诱导组比阴性对照组iNOSmRNA表达量更加减少(见图4)。这些数据提示NGF可能通过抑制iNOS mRNA表达进而抑制神经损伤因子NO的合成,促进DRG神经元神经突起生长。
2.3NGF对鸡胚神经节神经细胞释放NO的影响采用NO检测试剂盒对培养鸡胚神经节上清NO分泌水平进行测定,3次独立实验检测结果显示,添加NGF培养的鸡胚神经节NO释放量明显低于阴性对照组(见图5),统计学检测差异显著,P<0.05。
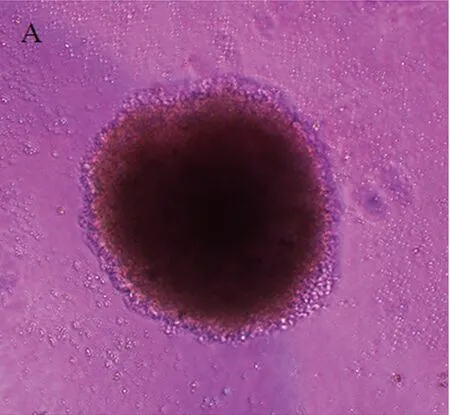
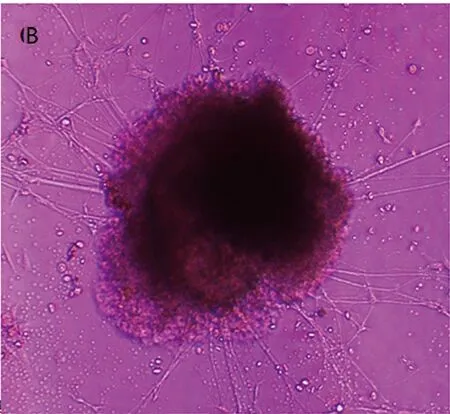
图1光学显微镜观察体外培养3 d的鸡胚背根神经节神经突起的生长状况
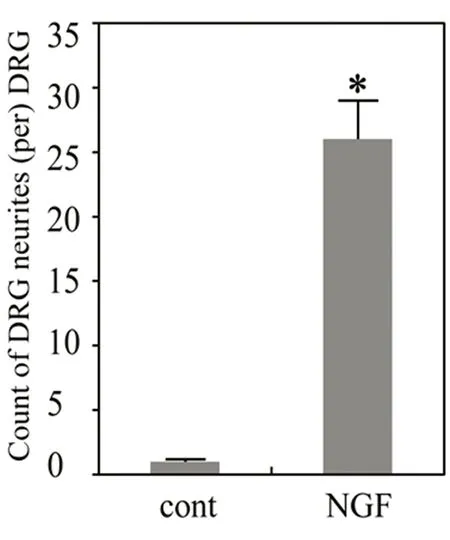
图2 每个神经节突起数量的比较
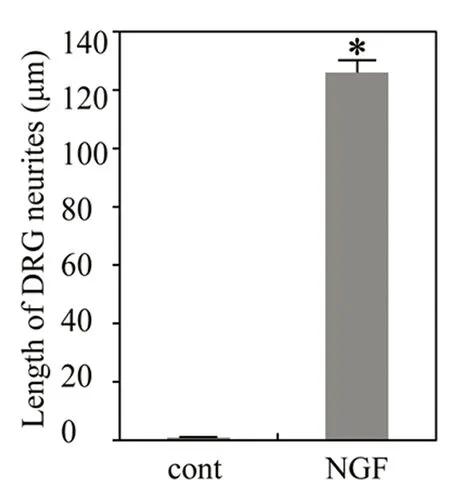
图3 每个神经节突起长度的比较(μm)

1:0.5%FCS-DMEM培养液阴性对照组;2:NGF 4 ng/ml组
图4半定量PCR检测DRG组织中iNOSmRNA表达比较

C:对照组;N:NGF 4ng/ml。与对照组比较统计学差异显著,*P<0.05
图5鸡胚背根神经节培养上清中NO的含量
3 讨 论
NGF作为重要的神经营养因子,其对鸡胚背根神经节神经突起的刺激作用已有文献报道,本研究采用8 d的鸡胚分离背根神经节,原代培养法,进一步证实了NGF在体外可以促进DRG神经元神经突起的生长,并对突起的长度和数量进行了统计学分析。但是,NGF保护DRG神经元的具体作用机制尚不清楚,因此我们采用半定量PCR检测鸡胚DRG的诱导型一氧化氮合酶(iNOS)mRNA表达情况,以及培养鸡胚神经节上清中NO的分泌水平,从而进一步阐明其NGF作用于DRG神经元的作用机制。
一氧化氮合酶(NOS) 可以将精氨酸中的氮原子,在氧气及其他辅助因素参与下合成NO。因此,多数实验通过对NOS的研究来实现对NO作用的研究[9]。一氧化氮合酶其同功酶有三种亚型,即在正常状态下表达的神经元型一氧化氮合酶(nNOS)和内皮型一氧化氮合酶(eNOS)以及在损伤后诱导表达的诱导型一氧化氮合酶(iNOS)。iNOS有神经毒性作用,介导兴奋性神经毒性,iNOS与氧自由基产生反应,生成物为过氧化硝基、羟自由基等化合物,这些化合物可引起组织损害[10~12]。在本研究中,我们发现NGF显著抑制了鸡胚DRG的iNOS mRNA表达,这些结果提示NGF可能通过抑制iNOS mRNA表达,进而促进鸡胚DRG神经突起生长。
文献报道NO过量产生、释放可直接导致神经细胞毒性,影响神经细胞正常代谢,细胞死亡率明显增高[13~16],NO的神经毒性作用表现在:大量羟自由基和二氧化氮自由基引起细胞蛋白质、核酸及脂肪膜损伤,导致细胞膜发生脂质过氧化,而导致神经元死亡[17];神经毒性的产生是NO通过形成NO-铁复合物、巯基蛋白的氧化,形成超氧阴离子等方式实现的[18]。而NGF可以抑制神经细胞一氧化氮的释放,保护神经细胞[19~21]。在本研究中,我们通过检测鸡胚DRG培养上清中神经损伤因子NO释放情况,实验结果显示添加NGF的DRG上清中NO含量明显低于培养液对照组,统计学分析差异显著(P<0.05),表明NGF具有抑制神经损伤因子NO释放作用。
综上所述,本研究资料表明NGF可能通过调控iNOS表达进而抑制神经损伤因子NO的释放,从而促进鸡胚DRG神经元神经突起生长,发挥其对神经元的营养作用。本研究为进一步找到神经营养药物NGF的新作用靶点,治疗神经损伤后神经突起再生的治疗研究提供了新的数据和实验依据。
[1]Thoenen H,Barde Y. Physiology of nerve growth factor[J]. Physiol Rev,1980,60(4):1284-1335.
[2]Kashiba H,Hyon B,Senba E. Glial cell line-derived neurotrophic factor and nerve growth factor receptor mRNAs are expressed in distinct subgroups of dorsal root ganglion neurons and are differentially regulated by peripheral axotomy in the rat [J]. Neurosci Lett,1998,252(2):107-110.
[3]Ma Q,Fode C,Guillemot F. Neurogenin1 and neurogenin2 control two distinct waves of neurogenesis in developing dorsal root ganglia [J]. Genes Dev,1999,13(13):1717-1728.
[4]Rifkin JT,Todd VJ,Anderson LW. Dynamic expression of neurotrophin receptors during sensory neuron genesis and differentiation [J]. Dev Biol,2000,227(2):465-480.
[5]方琳,柳忠辉,刘永茂,等. 激活素促进鸡胚神经节神经突起生长作用[J]. 动物学杂志,2006,41(6):23-28.
[6]方琳,刘永茂,葛敬岩,等. 激活素结合蛋白阻断激活素诱导鸡胚神经节神经突起生长作用及其机制研究[J]. 中风与神经疾病杂志,2007,24(4):395-397.
[7]Hou S,Tian W,Xu Q,et al. The enhancement of cell adherence and inducement of neurite outgrowth of dorsal root ganglia co-cultured with hyaluronic acid hydrogels modified with Nogo-66 receptor antagonist in vitro [J]. Neuroscience,2006,137(2):519-529.
[8]Green LC,Wagner DA,Glogowski J,et al. Analysis of nitrate,nitrite,and nitrate in biological fluids [J]. Anal Biochem,1982,126(1):131-138.
[9]Faraci FM,Brian JE. Nitric oxide and the cerebral circulation [J]. Stroke,1994,25(3):692-703.
[10]Fujiwara Y,Furuta A,Kikuchi H,et al. Discovery of a novel type of autophagy targeting RNA [J]. Autophagy,2013,9(3):403-409.
[11]Jin J,Suzuki H,Hirai S,et al. JNK phosphorylates Ser332 of doublecortin and regulates its function in neurite extension and neuronal migration [J]. Dev Neurobiol,2010,70(14):929-942.
[12]Pattingre S,Bauvy C,Carpentier S,et al. Role of JNK1-dependent Bcl-2 phosphorylation in ceramide-induced macroautophagy [J]. J Biol Chem,2009,284(5):2719-2728.
[13]Dawson VL,Dawson TM,Bartley DA,et al. Mechanisms of nitric oxide mediated neurotoxicity in primary brain cultures[J]. Neurosci,1993,13(6):2651-2661.
[14]Nowicki JP,Duval D,Poignet H,et al. Nitric oxide mediates neuronal death after cerebral ischemia in the mouse [J]. Eur J Pharmacol,1991,204(3):339-340.
[15]Stamler JS. Redox signalling:nitrosylation and related target interaction of nitric oxide [J]. Cell,1994,78(6):931-936.
[16]Zhang J,Dawson VL,Dawson TM,et al. Nitric oxide activation of poly(ADP-ribose) synthase in neurotoxicity [J]. Science,1994,263(5147):687-689.
[17]商秀丽,赵久晗,薛一雪. 脑缺血再灌注大鼠模型 eNOS 和 nNOS 的变化[J]. 中国组织化学与细胞化学杂志,2010,19(1):49-52.
[18]陈俊抛,郑文权,田时雨,等. 大鼠脑缺血时脑组织中 NOS1 阳性神经元变化的连续观察[J]. 临床神经病学杂志,1998,11(6):323-325.
[19]Tang C,Cao X,Wang D. Effects of nerve growth factor on neuronal nitric oxide production after spinal cord injury in rats[J]. Chin J Traumatol,2002,5(3):165-168.
[20]Wu J,Zhang J. Effects of nerve growth factor on nitric oxide-mediated neurotoxicity in primary cortical cultures [J]. Chin Med J (Engl),1999,112(5):448-451.
[21]Thippeswamy T,Morris R. Nerve growth factor inhibitors the expression of nitric oxide synthase in neurones in dissociated cultures of rat dorsal root ganglia[J]. Neurosci Lett,1997,230(1):9-12.
The effect mechanism of NGF in neurite outgrowth of embryonic dorsal root ganglia of the chicken
FANGLin,LIShipeng,LIJiayu,etal.
(ChangchunMedicalCollege,Changchun130021,China)
ObjectiveTo investigate the effect mechanism of NGF in neurite outgrowth of embryonic dorsal root ganglia (DRG) of the chiken. MethodsIn this study,we observed that NGF induced neurite outgrowth of DRG by the primary cultured DRGs from embryonic day 9 (E9) chicken. iNOS mRNA expressions were analyzed by RT-PCR,and the secretion of nitric oxide (NO) was examined by NO kit. ResultsNGF significantly induced neurite outgrowth of DRG and down-regulated the iNOS mRNA expressions of the in DRG. In addition,NO detection indicated that NO secretion level in the supernatant of cultured DRG decreased significantly in NGF group,compared to the control group (P<0.05). ConclusionNGF might stimulate DRG neurite outgrowth via inhibiting iNOS expression and NO secretion.
NGF;Neurite outgrowth;NO
1003-2754(2016)09-0829-04
2016-07-20;
2016-09-06
吉林省科技厅课题(No. 20140520012JH);吉林省卫生青年科研课题(No. 2013Q007);吉林省教育厅科研项目
(1.长春医学高等专科学校,吉林 长春 130031;2.吉林大学植物科学学院,吉林 长春 130062;3.吉林大学中日联谊医院心内科,吉林 长春 130033;4.吉林大学第一医院神经内科,吉林 长春 130021)
吕晓民,E-mail:fanglin1978@163.com
R742
A
