西瓜果实硬度性状主基因+多基因遗传分析
2016-10-28王学征张志鹏陈克农卢丙洋张杨吴鹏栾非时
王学征,张志鹏,陈克农,卢丙洋,张杨,吴鹏,栾非时
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030)
西瓜果实硬度性状主基因+多基因遗传分析
王学征1,2,张志鹏1,2,陈克农1,2,卢丙洋1,2,张杨1,2,吴鹏1,2,栾非时1,2
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨150030;2.东北农业大学园艺园林学院,哈尔滨150030)
研究以硬果皮果肉野生西瓜“PI186490”为母本,以果皮果肉硬度适中栽培西瓜“LSW-177”为父本,构建六个世代群体。利用主基因+多基因混合遗传模型多世代联合分析法,分析2014~2015两年获得的两套六个世代群体(P1、P2、F1、BC1P1、BC1P2和F2)各中心及边缘果肉硬度、果皮厚度和硬度遗传特点。结果表明,中心果肉硬度和果皮厚度遗传符合C-0模型,加性-显性-上位性多基因控制,多基因的加性和显性效应均为正向,多基因上位性效应累计为正向。边缘果肉硬度遗传符合D-4模型,由一对负向完全显性主基因+加性-显性多基因控制,主基因遗传率为19.97%,多基因遗传率为3.25%,主基因遗传起主导作用。
西瓜;果肉硬度;果皮厚度;果皮硬度;遗传分析
王学征,张志鹏,陈克农,等.西瓜果实硬度性状主基因+多基因遗传分析[J].东北农业大学学报,2016,47(9):24-32.
Wang Xuezheng,Zhang Zhipeng,Chen Kenong,et al.Mixed major gene and polygene inheritance analysis of fruit hardness inCitrullus lanatus[J].Journal of Northeast Agricultural University,2016,47(9):24-32.(in Chinese with English abstract)
西瓜[Citrullus lanatus(Thunb)Matsum&Nakai]起源于非洲[1],野生品种可食用性差,经人工驯化和不断加压选择得到风味和口感俱佳的栽培西瓜。西瓜果肉硬度决定西瓜品质及口感,西瓜果皮厚度及硬度决定果实可食用比例及储运性。
西瓜育种目标性状,包括产量、品质、生育期、籽粒重、储运性等,大部分是数量性状,数量性状遗传体系发展过程是动态的。经典数量遗传学认为数量性状一般受微效多基因控制,表型值连续变异,遗传学基础复杂[2]。研究发现一些数量性状同样受主基因控制。盖钧镒等将主基因遗传研究方法延伸到数量性状,提出植物数量性状主基因+多基因混合通用遗传模型[2-3]。章元明等在将成分分布方差剖分为主基因、多基因及环境三种方差组分基础上建立迭代ECM算法(Iterated expectation and conditional maximization,IECM)[4]。主基因+多基因多世代分离分析法在大豆[5-6]、水稻[7-8]、玉米[9-10]、小麦[11-12]、黄瓜[13-16]、油菜[17]、白菜[18-19]、西瓜[20]、番茄[21-22]、辣椒[23-24]等作物数量性状遗传研究中应用广泛,较好诠释数量性状遗传方式及表达效果。
本研究以“PI186490”和“LSW-177”为亲本,配制杂交组合,并于2014和2015两年分别构建含有276和359个单株的F2代及P1、P2、F1、BC1P1、BC1P2六个世代群体。测量两年六个世代西瓜果实中心及边缘果肉硬度、果皮厚度及硬度,分析遗传规律,估计遗传效应,为西瓜品质育种提供理论依据。
1 材料与方法
1.1材料
本研究供试母本材料为近缘野生西瓜自交系“PI186490”,白色果肉,味极苦,果肉致密坚硬,中心与边缘果肉硬度分别为13.18×105和10.19×105Pa,果皮深绿色,坚硬,硬度为18.41×105Pa,选用栽培西瓜品系“LSW-177”为父本材料,果肉红色、味甜、果皮厚度为0.59 cm,皮薄易裂,均由美国农业部农业研究署南部研究中心Angela R.Da⁃vis博士提供;父母本材料亲缘关系较远,授粉亲和,后代可育,且在果肉硬度、果皮厚度和硬度等方面差异较大。配制杂交组合,获得F1代,F1代分别与亲本回交获得BC1P1和BC1P2,F1自交获得F2代分离群体。2014和2015年种植不分离群体P1、P2、F1,各种植30株,回交世代BC1P1、BC1P2各种植30株,分离世代F2种植276和359株。
1.2方法
2014~2015年5~8月于东北农业大学向阳农场试验基地田间试验,随机区组排列设计,株行距80 cm×50 cm,肥水管理与生产相同,每株留2蔓,蘸花授粉,主蔓10~13节留1瓜,授粉40~50 d后收获,将收获果实纵切,调查4个西瓜果实相关性状:中心果肉硬度、边缘果肉硬度、果皮厚度、果皮硬度。使用WDW-5型电子万能试验机测量果皮硬度,C型邵氏硬度计测量中心及边缘果肉硬度,游标卡尺测量果皮厚度,测量重复3次,取平均值。
1.3统计分析
使用IBM SPSS 22.0作描述性统计分析;使用六个世代主基因+多基因混合遗传分离分析法,通过极大似然法和迭代ECM算法估计各世代、各相关成分分布参数,然后通过赤池信息量准则(Akaike's information criterion,AIC)即AIC最小值原则从备选模型中选择相对最适模型,同时作适合性检验,选择最优模型,估计主基因及多基因相关遗传参数,计算遗传率。
2 结果与分析
2.1西瓜果肉硬度遗传分析
2.1.1中心及边缘部分果肉硬度在不同世代群体中的分离
中心及边缘部分果肉硬度在不同世代中分离情况见表1。
由表1可知,2014年F1代中心及边缘果肉硬度分别为10.42×105和6.97×105Pa,BC1P1代果肉硬度分别为9.21×105和1.99×105Pa,接近母本,BC1P2代果肉硬度分别为9.08×105和2.00×105Pa,接近父本;2015年F1代中心及边缘部分果肉硬度分别为12.71×105和7.88×105Pa,BC1P1代果肉硬度分别为11.43×105和2.28×105Pa,接近母本,BC1P2代果肉硬度分别为12.57×105和2.30×105Pa,接近父本。
2.1.2中心及边缘部分果肉硬度在F2群体中的分离
F2群体中,中心和边缘果肉硬度见表2、图1。

表1 2014~2015年果肉硬度在不同世代群体中的分离Table 1Segregation of flesh hardness in different generations in 2014-2015(×105Pa)
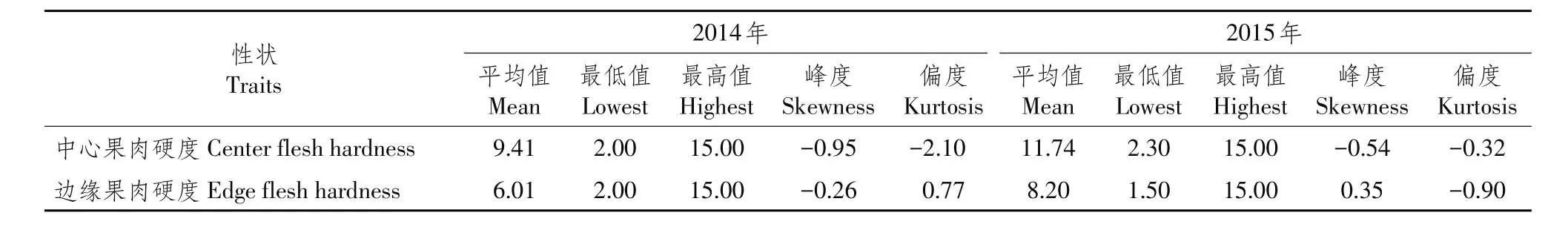
表2 2014~2015年果肉硬度在F2代群体中的分离Table 2Segregation of flesh hardness in F2generations in 2014-2015(×105Pa)

图1 2014~2015年F2代果肉硬度频率分布直方图Fig.1Frequency distribution of flesh hardness in F2generations in 2014-2015
由分离结果可知,2014和2015年F2群体各单株中心及边缘部分果肉硬度表型值在两亲本间,中心果肉硬度最高值均为15.00×105Pa,最低值分别为2.00×105和2.30×105Pa;边缘果肉硬度最高值均为15.00×105Pa,最低值分别为2.00×105和1.50×105Pa,同时存在正向和负向超亲优势。中心和边缘果肉硬度表型值分布连续,偏度和峰度系数均<3,说明存在主效基因控制果肉硬度,果肉硬度在F2群体中服从正态分布,呈数量性状遗传特征。SPSS 22.0软件绘制频率分布直方图,结果见图1。
2.1.3中心果肉硬度遗传模型分析
中心果肉硬度峰度、偏度系数均<3,表型值服从正态分布,利用主基因+多基因混合遗传分离分析法获得中心果肉硬度AIC值,如表3所示。
根据AIC最小值原则从表3中选出AIC值最小的遗传模型及与最小AIC值最接近的两个遗传模型。即C-0、E-1-3、E-1-5为备选模型,适合性检验,结果见表4。

表3 IECM算法估计F2代各遗传模型AIC值(中心果肉硬度)Table 3Estimation of AIC value of the different genetic model by IECM in F2(Center flesh hardness)

表4 中心果肉硬度遗传模型适合性检验Table 4Test of goodness-of-fit about genetic model in center flesh hardness
选出统计量达显著水平个数较少模型为最优模型,中心果肉硬度是多基因遗传或以多基因遗传控制为主,最优模型C-0,多基因加性和显性效应、上位性效应累计均为正向。
2.1.4边缘果肉硬度遗传模型分析
边缘果肉硬度峰度和偏度系数均小于3,表型值服从正态分布,应用主基因+多基因混合遗传分离分析法获得边缘果肉硬度AIC值,结果如表5所示。
根据AIC最小值原则从表5中选择AIC值最小的遗传模型,同时选出与最小AIC值最接近的两个遗传模型为备选,即:D-2、D-3、D-4。对3个备选模型作遗传模型适合性检验。结果见表6。
比较3个遗传模型适合性检验结果,选择统计量达显著水平个数较少模型为最优模型,D-4仅一个统计量差异显著,模型适合性较好。边缘果肉硬度最优模型D-4,受一对负向完全显性主基因+加性-显性多基因控制。

表5 IECM算法估计F2代各遗传模型AIC值(边缘果肉硬度)Table 5Estimation of AIC value of the different genetic model by IECM in F2(Edge flesh hardness)

表6 边缘果肉硬度遗传模型适合性检验Table 6Test of goodness-of-fit about genetic model in edge flesh hardness
2.2西瓜果皮厚度及硬度遗传分析
2.2.1西瓜果皮厚度及硬度在不同世代群体中的分离
根据测量结果,西瓜果皮厚度及硬度在不同世代中分离情况见表7、8,由表7~8可知,2014 和2015年F1代果皮厚度分别为1.05和1.03 cm,介于父本和母本之间,并接近高值亲本,BC1P1代果皮厚度分别为0.56和0.63 cm,接近母本,BC1P2代果皮厚度分别为0.64和0.66 cm,接近母本。2014 年F1代果皮硬度为22.40 N介于父本和母本之间,并接近高值亲本,BC1P1代果皮硬度为27.33 N,接近母本,BC1P2代果皮硬度为27.84 N,接近母本,2015年未获得果皮硬度表性数据。果皮厚度及硬度不同世代分离规律相同。

表7 果皮厚度在不同世代群体中的分离Table 7Segregation of rind thickness in different generations(cm)

表8 果皮硬度在不同世代群体中的分离Table 8Segregation of rind hardness in different generations(N)
2.2.2西瓜果皮厚度及硬度在F2群体中的分离
F2群体中,西瓜果皮厚度见表9和图2(a、b),由表9和图2(a、b)可知,2014~2015年F2群体内各单株西瓜果皮厚度多数在供试双亲间,最高值分别为2.5和2.0 cm;最低值分别为0.5和0.4 cm,既存在正向超亲优势又存在负向超亲优势。西瓜果皮厚度表现为连续性分布,偏度和峰度绝对值均小于3,说明在控制果皮厚度性状基因中存在主效基因。F2群体中果皮厚度表型值分布服从正态分布,呈明显数量性状遗传特征。

表9 果皮厚度及果皮硬度在F2代群体中的分离Table 9Segregation of rind thickness(cm)and rind hardness(N)in F2generations

图2 F2代果皮厚度和硬度频率分布直方图Fig.2Frequency distribution of rind thickness and hardness in F2generations
西瓜果皮硬度见表9和图2(c),群体内各单株西瓜果皮硬度平均值为24.35 N,最高值为34.00 N;最低值为10.20 N,同时存在正向超亲优势和负向超亲优势。西瓜果皮硬度表现为连续分布,偏度和峰度绝对值均小于3,说明在控制果皮厚度性状基因中存在主效基因。F2群体中果皮厚度表型值分布基本服从正态分布,存在偏分离,呈数量性状遗传特征。
2.2.3果皮厚度遗传模型分析
果皮厚度峰度和偏度系数均<3,表型值服从正态分布,利用主基因+多基因混合遗传分离分析方法,获得边缘果肉硬度AIC值,如表10所示。

表10 IECM算法估计F2代各遗传模型AIC值(果皮厚度)Table 10Estimation of AIC value of the different geneticmodel by IECM in F2(Rind thickness)
根据AIC最小值原则从表10中选择AIC值最小、拟合性优良的模型C-0。果皮厚度是典型多基因遗传模型,多基因加性和显性效应均为正向,多基因上位性效应累计为正向。
2.2.4果皮硬度遗传模型分析
分析2014年果皮硬度表型数据,峰度为-0.82,偏度为-0.25,峰度和偏度绝对值均小于3,表型值服从正态分布,呈数量性状遗传特征。选择主基因+多基因混合遗传分离分析法分析,未得到AIC值,原因有待分析。
2.3最适模型遗传参数估计
应用选择主基因+多基因混合遗传分离分析方法得到中心果肉硬度和果皮厚度模型C-0、边缘果肉硬度模型D-4分布参数估计一阶遗传参数值,计算遗传效应(见表12),并进一步估计二阶参数,计算遗传方差及遗传率(见表13)。
由表11可知,中心果肉硬度(C-0模型)是典型多基因遗传模型,无主基因存在,多基因加性、显性和上位性效应均为正向。边缘果肉硬度(D-4模型)受一对负向完全显性主基因+加性-显性多基因控制,多基因效应为-5.10,显性效应为2.62。果皮厚度(C-0模型)多基因遗传模型,多基因加性和显性效应均为正向,多基因上位性效应累计为正向。
由表12可知,F2代群体中,边缘果肉硬度主基因遗传率为19.97%,多基因遗传率为3.25%。主基因遗传起主导作用,同时说明环境对边缘果肉硬度存在影响。中心果肉硬度与果皮厚度均符合加性-显性+上位性多基因遗传模型,F2代表型值服从标准正态分布,说明可能存在多基因联合效应,且微效基因数目较多,相互间连锁互作。
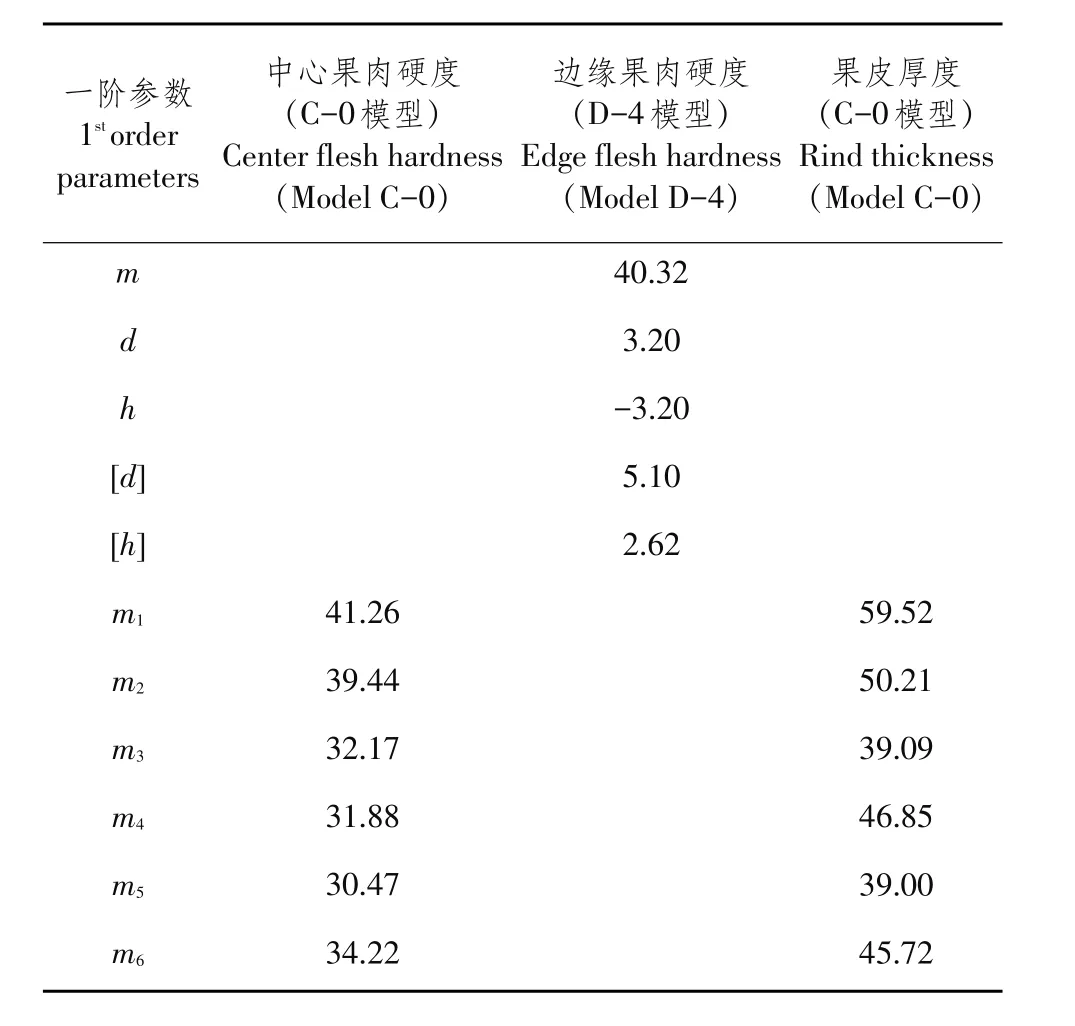
表11 各模型一阶遗传参数估值Table 11Estimates of first order genetic parameters of models

表12 各模型二阶遗传参数估值Table 12Estimates of second order genetic parameters of models
3 讨论与结论
本研究利用主基因+多基因混合遗传模型的多世代联合分析法,分别对2014~2015年构建的两套西瓜六世代(P1、P2、F1、BC1P1、BC1P2、F2)群体中心和边缘果肉硬度、果皮厚度及硬度开展遗传分析。结果表明,两年间F1代在表型值上接近亲本均值,并偏向高值亲本;F2代分离群体中心和边缘果肉硬度、果皮硬度和厚度表型值均表现为无明显分组的连续变异,服从正态分布,果肉硬度、果皮厚度及果皮硬度属于数量性状,受多基因共同控制,与范敏[25]和刘传奇[26]等研究结果相同。F2代分离群体中正态分布峰度系数小于3,说明控制果肉硬度、果皮厚度和硬度的基因中存在主效基因。以F2群体果肉硬度变幅为对照可见,BC1P1表型值偏向于母本,BC1P2表型值偏向于父本,分离规律符合多基因控制的数量性状。说明西瓜果肉硬度、果皮厚度和硬度遗传既受主效基因控制,又受微效基因控制。
F2群体中心果肉硬度与果皮厚度表型值均服从标准正态分布,说明存在多基因联合效应,符合加性-显性+上位性多基因遗传模型(C-0),多基因加性和显性效应均为正向,微效基因数目较多,上位性效应累计为正向。江海坤[27]和包文风[28]应用孟德尔经典方法验证西瓜外果皮绿皮层厚度由1对主基因控制表达,而江海坤通过主基因+多基因混合遗传分离分析法分析表明其受两对主基因控制,符合两对加性-显性-上位性主基因+加性-显性多基因混合模型(E-1),且第二对主基因显性效应小,仅为第一对主基因的1/4。这与本研究中果皮厚度为典型多基因遗传模型,无主基因结果不符,主要原因是由于果皮厚度研究部位差异造成,前者主要关注外果皮绿皮层厚度,而本研究探讨植物学定义上的果皮厚度,遗传背景复杂,受环境影响较大。边缘果肉硬度受1对负向完全显性主基因+加性-显性多基因控制(D-4),区分主基因和多基因效应,主基因遗传率为19.97%,起主导作用,多基因遗传率为3.25%,说明环境对边缘果肉硬度存在影响。
西瓜果皮硬度有两种测量方法:①削去果实外表皮1 cm2面积,手持果实硬度计测量[29],实际测量内果皮硬度,获得数据单位为105Pa,量程较小;②取西瓜果皮,用万能试验机测量相同部位硬度[30],获得数据单位为N。本研究中母本“PI186490”果皮硬度超出手持果实硬度计测定量程,测量困难,故采用第二种方法测量。刘军等应用主基因+多基因混合遗传模型对辣椒六世代群体果肉硬度分离分析,结果表明,辣椒果实硬度遗传符合1对加性主基因+加性-显性多基因遗传模型(D-2)[31]。本研究中F2群体果皮硬度同时存在正向超亲和负向超亲优势,表性值基本服从正态分布,向右偏离,存在主基因控制并受微效多基因修饰,应用主基因+多基因混合遗传分离分析法,未获得AIC值。没有获得果皮硬度AIC值是由于果皮硬度在F2群体中可能为多成分混合分布,存在多个独立概率分布,不适用于本研究模型。
本研究利用主基因+多基因混合遗传模型六个世代联合分析法,从环境方差中剥离出多基因方差,有效降低环境误差[32]。通过2014~2015两年间西瓜果实中心与边缘果肉硬度、果皮厚度、果皮硬度分离数据遗传分析,明确西瓜果实硬度相关性状遗传机制,为获取与之紧密连锁分子标记及相关基因定位和克隆提供理论支持。
[1]王鸣,侯沛.西瓜的起源、历史、分类及育种成就[J].当代蔬菜,2006(3):18-19.
[2]盖钧镒.植物数量性状遗传体系的分离分析方法研究[J].遗传,2005,27(1):130-136.
[3]盖钧镒,章元明,王建康.植物数量性状一传体系[M].北京:科学出版社,2003:351-370.
[4]章元明,盖钧镒.数量性状分离分析中分布参数估计的IECM算法[J].作物学报,2000,26(6):699-706.
[5]李广军,程利国,张国政,等.大豆对豆卷叶螟抗性的主基因+多基因混合遗传[J].大豆科学,2008,27(1):33-41.
[6]罗庆云,於丙军,刘友良,等.栽培大豆耐盐性的主基因+多基因混合遗传分析[J].大豆科学,2004,23(4):239-244.
[7]王庆钰,朱立宏,盖钧镒,等.水稻广亲和性遗传的主基因-多基因混合模型分析[J].遗传,2004,26(6):898-902.
[8]杜鹃,曾亚文,杨树明,等.云南粳稻耐低磷特性的主基因多基因遗传分析[J].生态研究,2007,16(3):920-925.
[9]李静,陈士林,张怀胜,等.玉米穗轴粗的主基因+多基因遗传模型分析[J].河南农业科学,2015,44(5):38-41.
[10]包和平,毕成龙,李颖,等.爆裂玉米百粒重性状的主基因+多基因混合遗传分析[J].华北农学报,2011,26(3):199-203.
[11]张立平,赵昌平,单富华,等.小麦光温敏不育系BS210育性的主基因+多基因混合遗传分析[J].作物学报,2007,33(9):1553-1557.
[12]侯北伟,窦秉德,章元明,等.小麦雌性育性的主基因+多基因混合遗传分析[J].遗传,2006,28(12):1567-1572.
[13]罗晓梅,司龙亭,尹维娜.黄瓜黄色线与瓜长比的主基因+多基因的遗传分析[J].华北农学报,2008,23(2):88-91.
[14]闫立英,娄丽娜,冯志红,等.雌雄同株黄瓜单性结实性主基因+多基因混合遗传分析[J].西北植物学报,2009,29(6):1122-1126.
[15]嵇怡,徐强,陈学好.黄瓜株高性状遗传模型分析[J].扬州大学学报:农业与生命科学版,2009,30(3):75-79.
[16]Martin A,Yeboah,Chen X H,et al.Inheritance of water logging tolerance in cucumber[J].Euphytica,2008,162:145-154.
[17]Zhang S F,Ma C Z,Zhu J C,et al.Genetic analysis of oil content in Brassucanapus L.using mixed model of major-gene and poly⁃gene[J].Act a Genet Sin,2006,33(20):171-180.
[18]韩建明,侯喜林,史公军,等.不结球白菜株高性状主基因+多基因遗传分析[J].南京农业大学学报,2008,31(1):23-26.
[19]韩建明,侯喜林,史公军,等.不结球白菜叶子重量性状遗传模型分析[J].遗传,2007,29(9):1149-1153.
[20]栾非时,王凤娇,高鹏,等.西瓜果实可溶性糖含量的遗传分析[J].东北农业大学学报,2014,45(9):25-33.
[21]冯辉,王五宏,徐娜,等.串番茄主要株型性状的遗传研究[J].中国农业科学,2008,41(12):4134-4139.
[22]李纪锁,沈火林,石正强.鲜食番茄果实中番茄红素含量的主基因-多基因混合遗传分析[J].遗传,2006,28(4):458-462.
[23]陈学军,方荣,周坤华,等.辣椒果实性状主基因+多基因遗传分析[J].西北植物学报,2012,32(2):246-251.
[24]徐小万,曾莉,李颖,等.辣椒开花期的主基因+多基因遗传分析[J].生物数学学报,2012(4):753-757.
[25]范敏,许勇,张海英,等.西瓜果实性状QTL定位及其遗传效应分析[J].遗传学报,2000,27(10):902-910.
[26]刘传奇,高鹏,栾非时.西瓜遗传图谱构建及果实相关性状QTL分析[J].中国农业科学,2014,47(14):2814-2829.
[27]江海坤.西瓜(Citrulls.lanatus)裂果机理及其分子标记研究[D].南京:南京农业大学,2010:63-69.
[28]包文风.西瓜白化致死基因的分子标记和遗传分析[D].北京:中国农业科学院,2010:40-45.
[29]江海坤,袁希汉,章镇,等.西瓜主要农艺性状与裂果性状的相关及通径分析[J].中国蔬菜,2009(16):31-35.
[30]张杨.西瓜果实品质及种子性状遗传规律分析[D].哈尔滨:东北农业大学,2013.
[31]刘军,郭爽,张维,等.辣椒果实硬度性状的主基因+多基因遗传分析[J].西南农业学报,2011,24(4):1464-1468.
[32]罗凤娟,董晓萌,袁志发,等.主基因-多基因混合遗传数量性状的单性状选择模型[J].西北农林科技大学学报:自然科学版,2008,36(9):190-196.
Mixed major gene and polygene inheritance analysis of fruit hardness inCitrullus lanatus
WANG Xuezheng1,2,ZHANG Zhipeng1,2,CHEN Kenong1,2,LU Bingyang1,2,ZHANG Yang1,2,WU Peng1,2,LUAN Feishi1,2
(1.Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(Northeast Region),Ministry of Agriculture,Harbin 150030,China;2.School of Horticulture and LandscapeAgriculture,Northeast Agricultural University,Harbin 150030,China)
Wild watermelon PI186490 with hard fruit hardness and weak fruit hardness line of LSW-177,were employed to construct six genealogical populations P1,P2,F1,BC1P1,BC1P2and F2in 2014 and 2015,respectively.Fruit hardness,rind thickness and rind hardness of the center and edge of the fruits of the populations were analyzed by means of the major gene+polygene mixed inheritance model of quantitative traits,respectively.The results showed that the inheritance of the fruit hardness and the rind thickness of watermelon followed the additive dominant and multiple polygene(C-0 model),the additive and dominant effects of multiple genes were positive.Edge fruit hardness followed the negative to complete dominant gene+additive dominant multiple polygene(D-4 model).The main gene genetic rate was 19.97%,and the genetic rate of multi gene was 3.25%.The major gene played a leading role.
watermelon;flesh hardness;rind thickness;rind hardness;genetic analysis
S651
A
1005-9369(2016)09-0024-09
2016-07-09
国家西甜瓜产业技术体系项目(CARS-026-02)
王学征(1978-),女,教授,博士,硕士生导师,研究方向为西甜瓜遗传育种。E-mail:xz6206815@163.com
