逆境胁迫下小麦脂肪氧化酶基因表达的qRT-PCR分析
2016-10-27张福彦张建伟杨保安范家霖陈晓杰陈云堂
张福彦,陈 锋,张建伟,杨保安,范家霖,陈晓杰,陈云堂,崔 龙
(1.河南省科学院同位素研究所有限责任公司/河南省核农学重点实验室,河南郑州 450015;2.河南农业大学农学院/河南省粮食作物协同创新中心,河南郑州 450002)
逆境胁迫下小麦脂肪氧化酶基因表达的qRT-PCR分析
张福彦1,2,陈 锋2,张建伟1,杨保安1,范家霖1,陈晓杰1,陈云堂1,崔 龙1
(1.河南省科学院同位素研究所有限责任公司/河南省核农学重点实验室,河南郑州 450015;2.河南农业大学农学院/河南省粮食作物协同创新中心,河南郑州 450002)
为探讨小麦脂肪氧化酶基因在非生物胁迫过程中的生物学功能,采用qRT-PCR技术,首先分析了 TaLox-B2和 TaLox-B3基因在小麦幼叶、茎、根以及成熟籽粒中的表达情况,其次分析了这2个基因在高盐、低温、高温和干旱胁迫下叶片中的表达模式。结果表明,这2个基因在小麦根、茎、叶以及成熟籽粒中均有表达,但 TaLox-B2基因主要在叶和成熟籽粒中表达,而 TaLox-B3基因主要在根和叶中表达。在高盐胁迫下,这2个基因的表达趋势大体一致,类似于正态分布,在3 h时达到峰值。在低温逆境下, TaLox-B2基因的表达模式无明显规律,而 TaLox-B3基因在0~6 h范围内呈上调表达,之后开始逐渐下降。在高温逆境下,这2个基因在0~12 h范围内均呈下调表达,但二者下调的趋势明显不同。在模拟干旱胁迫下,这2个基因相对表达量均较低,表达趋势存在明显差别,但二者的表达模式则无明显规律。推测认为, TaLox-B2和 TaLox-B3基因主要受盐胁迫诱导,且与PEG干旱胁迫之间没有特定的关系,此外,温度变化对 TaLox-B2和 TaLox-B3基因表达量的影响较为明显,但低温和高温的作用机制不同。
普通小麦;逆境胁迫;脂肪氧化酶基因;表达分析
面粉色泽是评价小麦品质的重要指标之一,对面粉或面制品的商品性具有重要影响[1]。面粉中八氢番茄红素合成酶、多酚氧化酶、脂肪氧化酶等其他过氧化物酶通过对黄色素和类胡萝卜素等色素类物质的氧化降解,进而对面粉或面制品色泽产生影响[2-4]。在小麦中,脂肪氧化酶(Lipoxygenase,Lox)含量虽然较低,但对面粉或面制品色泽等具有重要影响,现已成为小麦品质育种的重要目标之一。
小麦籽粒Lox活性可遗传率较高,基因型是决定小麦Lox活性的最主要因素[5-6]。Hart和Langston[7]利用中国春缺体-四体代换系对硬粒小麦Lpx同工酶进行定位,结果发现, Lpx-A1、Lpx-B1和 Lpx-D1分别位于4AL、4BL和4DS染色体上,而 Lpx-A2、 Lpx-B2和 Lpx-D2分别位于5AL、5BL和5DL上,因而推测小麦Lox基因主要位于第4和第5同源群上。随着大麦和硬粒小麦中Lox基因被克隆和定位[8-10],普通小麦中Lox基因的克隆、定位及与之紧密连锁的分子标记的开发等也取得了一定的进展。Feng等[11]采用同源克隆的方法从普通小麦品种小偃54中克隆了位于4DS染色体上的 TaLox1基因和位于5DL染色体上的 TaLox2n基因,并对二者在成熟籽粒中的相对表达量进行分析,发现 TaLox1比 TaLox2n基因表达量更高,说明 TaLox1基因对小麦籽粒Lox活性作用更为明显[11]。之后,又利用同样的方法从普通小麦中克隆出一个新Lox基因,命名为 TaLox3,将其定位在4A染色体上[12]。Geng等[13]利用电子克隆方法克隆得到普通小麦4B染色体上的 TaLox-B1基因,且发现了其至少含有2种等位变异类型,分别命名为 TaLox-B1a和 TaLox-B1b,二者gDNA序列间存在单核苷酸多态性,根据该多态性开发1对共显性互补功能性分子标记Lox16和Lox18。Garbus等[14]先后在普通小麦中克隆发现了与硬粒小麦中类似的 Lpx-A1-like、 Lpx-B1.2和 Lpx-D1基因,并将其分别定位在4A、4B和4D染色体上。之后,Zhang等[15]采用电子克隆技术从普通小麦4BS染色体上克隆得到2个与Lox活性关系密切的新基因,命名为 TaLox-B2和 TaLox-B3,且发现 TaLox-B2基因存在2种等位变异类型,将其命名为 TaLox-B2a和 TaLox-B2b,同时,根据三者基因的gDNA序列差异开发了功能性分子标记Lox-B23。尽管已有关于普通小麦籽粒Lox基因克隆、功能标记开发和检测以及Lox活性分析等的相关报道,但有关小麦Lox基因在非生物胁迫过程中的生物学功能的报道很少。
本研究以小麦 β-actin基因为对照,利用qRT-PCR技术,先分析 TaLox-B2和 TaLox-B3基因在小麦幼叶、茎、根以及成熟籽粒中的表达情况,其次分析以上2个因基在高盐、低温、高温和干旱胁迫下叶片中的表达模式,旨在为进一步了解小麦籽粒脂肪氧化酶基因的生物学功能和分子遗传基础提供一定的帮助。
1 材料与方法
1.1试验材料及其处理
供试材料包括2014年河南省最新审定的小麦品种豫农211、1997年河北省审定的小麦品种石4185及目前全国推广面积最大的小麦品种矮抗58,均由河南农业大学小麦育种研究室提供。挑选籽粒饱满的小麦种子,经双氧水消毒后播种于培养皿中,置于人工气候培养箱中,于光/暗周期为12 h/12 h、温度为22~25 ℃的条件下培养。待幼苗长至三叶一心期时,分别取各小麦品种的幼叶、茎和根,同时将矮抗58幼苗分别在4 ℃低温、42 ℃高温、100 mmol·L-1NaCl以及20% PEG6000共4种逆境胁迫环境下分别处理0、1、3、6、12和24 h后取其叶片,于-80 ℃超低温冰箱中保存备用。
1.2试验方法
1.2.1总RNA的提取
分别取适量1.1中保存于-80 ℃超低温冰箱中的小麦幼叶、茎和根,加入液氮后迅速研磨至粉末状,采用Trizol法提取总RNA,具体操作步骤参照南海波[16]的方法进行。同时,参照胡群文等[17]提取小麦种子RNA的方法提取供试各小麦品种成熟种子RNA。
1.2.2cDNA第一链的合成
以提取的总RNA为模板,利用RNA反转录试剂盒[Prime Script○RRT reagent Kit With gDNA Eraser, 宝生物工程(大连)有限公司]进行反转录合成cDNA的第一链。
1.2.3特异性引物的设计
利用DNAMAN Version 6.0进行序列分析,采用Primier Primer 5.0设计特异性引物。根据Zhang等[15]新克隆的小麦籽粒 TaLox-B2和 TaLox-B3基因的gDNA序列设计2对特异性引物Lox-P2和Lox-P3;以小麦中稳定表达的肌动蛋白基因 β-actin(GI:48927671)序列设计1对特异性引物WAC,作为内参。引物合成均在生工生物工程(上海)股份有限公司进行,具体引物序列信息见表1。
1.2.4表达分析
RT-PCR反应在美国伯乐iQ5实时荧光定量PCR仪中进行。3次生物学重复。qRT-PCR反应体系:cDNA 2 μL,10 pmol·L-1的上下游引物各0.5 μL,SYBR Premix ExTaqII(2×)[宝生物工程(大连)有限公司]10 μL,ddH2O 7 μL。qRT-PCR反应程序:95 ℃预变性5 min;95 ℃变性10 s,64 ℃退火45 s,72 ℃延伸20 s,40个循环;72 ℃延伸10 min,10 ℃保存。反应结束后,取5 μL PCR产物进行2.0%琼脂糖凝胶电泳,溴化乙锭(EB)染色,UV扫描成像后确认是否与扩增曲线结果吻合。最后,采用2-△△Ct法[18]计算基因的相对表达量。

表1 RT-PCR特异性引物序列信息Table 1 Specific primer sequence for RT-PCR
2 结果与分析
2.1 TaLox-B2和 TaLox-B3基因在小麦不同器官中的表达
利用RT-PCR分析 TaLox-B2和 TaLox-B3基因在矮抗58、石4185和豫农211小麦品种的不同器官中的表达,结果(图1)表明, TaLox-B2基因在石4185、矮抗58以及豫农211的不同器官中均表达,且在叶中表达水平明显高于根、茎和成熟籽粒,成熟籽粒中的表达水平略高于根、茎,而根中表达水平最低(图1A)。 TaLox-B3基因在石4185和豫农211的不同器官中均不表达,而在矮抗58的不同器官中均表达,且在根中表达水平明显高于叶、茎和成熟籽粒,在叶中的表达水平略高于成熟籽粒和茎,而在茎中表达水平最低(图1B)。由此可见,小麦 TaLox-B2基因的表达强度依次为叶>成熟籽粒>茎>根,而 TaLox-B3基因的表达强度依次为根>叶>成熟籽粒>茎。
2.2 TaLox-B2和 TaLox-B3基因在胁迫处理下的特异性表达
利用RT-PCR分析经高盐、低温、高温和干旱胁迫处理后的矮抗58叶片中 TaLox-B2和 TaLox-B3基因的表达情况,结果如图2~5所示。
在4 ℃低温条件下, TaLox-B2基因在0~1 h
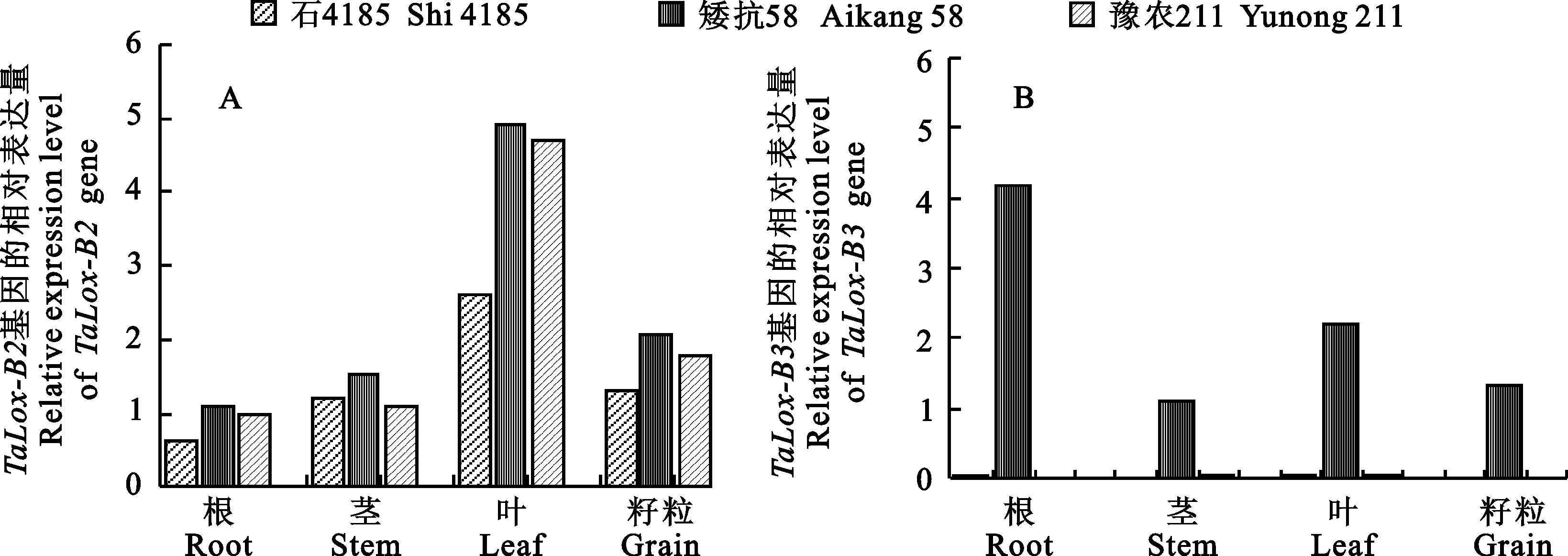
图1 TaLox-B2和 TaLox-B3基因在普通小麦品种不同器官中的相对表达水平
迅速上调表达,在1 h时达到最大,约为起始表达量的1.5倍,此后表达量下降,在3 h时表达量接近起始水平,之后又开始上升,在6 h时达到峰值,此时约为起始表达量的1.1倍,之后又开始平缓下降,24 h时 TaLox-B2的相对表达量较弱; TaLox-B3基因在0~6 h迅速上调表达,在6 h时达到最大,此时约为起始表达量的2.6倍,之后表达量逐渐下降,24 h时其表达量达到最低,此时与 TaLox-B2的相对表达水平非常接近(图2)。

图2 4 ℃低温条件下矮抗58叶片中 TaLox-B2和TaLox-B3基因的表达
42 ℃高温条件下, TaLox-B2基因呈下调表达趋势,在0~1 h平缓下降,之后开始急剧下降,在12 h时达到最低,此时约为起始表达量的1/20,之后又开始缓慢上升,24 h时约达到最低表达量时的4倍; TaLox-B3基因也呈下调表达趋势,在0~12 h平缓下降,在12 h时达到最低,此时约为起始表达量的1/10,之后又开始缓慢上升,24 h时达到最低表达量时的2.2倍(图3)。

图3 42 ℃高温条件下矮抗58叶片中 TaLox-B2和TaLox-B3基因的表达
在100 mmol·L-1NaCl处理条件下, TaLox-B2基因在0~3 h平缓上升,在3 h时达到最高,此时约为起始表达量的2.4倍,之后开始缓慢下降,但到12 h以后下降速度减慢,基本处于一个稳定的状态; TaLox-B3基因在0~3 h急剧上升,在3 h时达到最高,此时约为起始表达量的5倍,之后开始下降,在12 h时达到最低,此时相对表达量与起始表达量相当,但略低于起始表达量,此后又开始缓慢上升,在24 h时的相对表达量约为起始表达量的1.4倍(图4)。
在20% PEG6000胁迫条件下, TaLox-B2基因在0~3 h平缓上升,在3 h时达到一个峰值,之后开始下降,在12 h时达到另外一个峰值,之后开始急剧下降,在24 h时的相对表达量约为起始表达量的1/3倍; TaLox-B3基因在0~1 h呈下调表达,之后开始上升,且在3 h和12 h分别有一个峰值,在24 h时的相对表达量约为起始表达量的1/4倍(图5)。

图4 100 mmol·L-1 NaCl胁迫条件下矮抗58叶片中 TaLox-B2和TaLox-B3基因的表达

图5 干旱胁迫条件下矮抗58叶片中 TaLox-B2和TaLox-B3基因的表达
3 讨 论
脂肪氧化酶广泛存在于各种植物中,植物在受到外源伤害或病原菌侵染时Lox表达增强,而Lox的催化产物脂氢过氧化物及其次生产物可以降解为传递生物胁迫和非生物胁迫信息的信号因子,以增强对昆虫和真菌病害的敏感性,进而对植物起到一定的保护作用[19]。目前,脂肪氧化酶在拟南芥、马铃薯、大麦、水稻以及大豆等植物中关于生理基础和分子生物学方面的研究较为深入。Hildebrand等[20]研究认为,大豆叶片中的Lox与反应底物是分开的,但在其受到逆境胁迫,并产生组织损伤后,Lox能与底物进行结合,脂肪氧化酶蛋白及其活性会急剧增加,并形成新的脂肪氧化酶同工酶。而Shukle等[21]发现从大豆中提取的脂肪氧化酶可以有效的阻止烟草天蛾幼虫的生长发育,因此他们认为脂肪氧化酶在大豆植物体内能直接起到抵御有害生物危害的功能。Royo等[22]从马铃薯中克隆出与逆境胁迫相关的 Lox1、 Lox2和 Lox3基因,研究发现 Lox1在块茎和根中特异性表达, Lox3基因则在叶片和根中表达,而 Lox2只在叶片中表达,说明Lox基因具有特定的组织表达特异性;对马铃薯叶片进行伤害处理后,研究发现 Lox3基因的表达量在0.5 h后迅速增强,而 Lox2基因的表达量在24 h内呈递增趋势,从而说明了植物体内不同的Lox基因在应对逆境生物胁迫时扮演着不同的角色。脂肪氧化酶在普通小麦抗逆境方面的研究也取得一定的研究进展。Ocampo等[23]通过研究小麦Lox活性与小麦植株抗病性的关系,发现当小麦植株受到病原体侵染时,植物组织中Lox活性迅速提高,并刺激产生相应的创伤素、植物二烯酸以及脱落酸等来阻止病原体进一步入侵。张荣平等[24]在模拟干旱和高温条件下研究冬小麦不同品种胚根脂氧合酶(Lox)活性变化,发现抗旱-抗热性强的小麦品种胚根中Lox活性只有较小幅度的上升,而抗旱-抗热性弱的品种Lox活性则有较大幅度的上升。说明植物体内Lox活性含量的变化情况与植物所在外界环境密切相关。本研究对控制小麦籽粒Lox活性主效基因 TaLox-B2和 TaLox-B3的表达模式以及对各种胁迫的响应进行研究,结果发现,低温和NaCl胁迫时 TaLox-B2和 TaLox-B3基因的表达量在短时间内迅速上升,以增强植物对外界环境的敏感性,进而对小麦植株起到保护作用,这与Ocampo等[23]和张荣平等[24]的研究结果基本一致;而在高温胁迫时, TaLox-B2和 TaLox-B3基因的表达量呈下降趋势,这与低温和NaCl胁迫时的Lox基因的作用机制明显不同,需进一步深入研究;干旱胁迫时, TaLox-B2和 TaLox-B3基因的表达量均较低,且没有明显规律,表明二者的表达可以与渗透胁迫无关,主要是离子胁迫诱导其表达。
[1]HE Z H,YANG J,ZHANG Y,etal.Pan bread and dry white Chinese noodle quality in Chinese winter wheats [J].Euphytica,2004,139(3):257-267.
[2]CRAWFORD A C,STEFANOVA K,LAMBE W,etal.Functional relationships of phytoene synthase 1 alleles on chromosome 7A controlling flour colour variation in selected Australian wheat genotypes [J].TheoreticalandAppliedGenetics,2011,123(1):95-108.
[3]CHANG C,ZHANG H P,XU J,etal.Variation in two PPO genes associated with polyphenol oxidase activity in seeds of common wheat [J].Euphytica,2007,154(1-2):181-193.
[4]郑文寅,汪 帆,司红起,等.普通小麦籽粒LOX、PPO活性和类胡萝卜素含量变异及对全麦粉色泽的影响[J].中国农业科学,2013,46(6):1087-1094.
ZHENG W Y,WANG F,SI H Q,etal.Variation of LOX and PPO activities and carotenoid content as well as their influence on whole flour color in common wheat [J].ScientiaAgriculturaSinica,2013,46(6):1087-1094.
[5]BORRELLI G M,TROEEOLI A,FONZO N D,etal.Durum wheat lipoxygenase activity and other quality parameters that affect pasta color [J].CerealChemistry,1999,76(3):335-340.
[6]王 慧,郑文寅,樊 宏,等.不同小麦品种籽粒中LOX活性及基因型和环境互作分析[J].中国粮油学报,2011,26(1):11-14,19.
WANG H,ZHENG W Y,FAN H,etal.Lipoxygenase activity and its genotype and environment interactions for different wheat varieties [J].JournaloftheChineseCerealsandOilsAssociation,2011,26(1):11-14,19.
[7]HART G E,LANGSTON P J.Chromosome location and evolution of isozyme structural genes in hexaploid wheat [J].Heredity,1977,39:263-277.
[8]VAN MECHELEN J R,SMITS M,DOUMA A C,etal.Primary structure of a lipoxygenase from barley grain as deduced from its cDNA sequence [J].BiochimicaetBiophysicaActa,1995,1254(2):221-225.
[9]CARRERA A,ECHENIQUE V,ZHANG W,etal.A deletion at the Lpx-B1 locus is associated with low lipoxygenase activity and improves pasta color in durum wheat(Triticumturgidumspp.durum) [J].JournalofCerealScience,2007,45(1):67-77.
[10]VERLOTTA A,SIMONE V D,MASTRANGELO A M,etal.Insight into durum wheat Lpx-B1:a small gene family coding for the lipoxygenase responsible for carotenoid bleaching in mature grains [J].BMCPlantBiology,2010,10:263.
[11]FENG B,DONG Z Y,XU Z B,etal.Molecular analysis of lipoxygenase (LOX) genes in common wheat and phylogenetic investigation of LOX proteins from model and crop plants [J].JournalofCerealScience,2010,52(3):387-394.
[12]FENG B,DONG Z Y,XU Z B,etal.Molecular characterization of a novel type of lipoxygenase(LOX) gene from common wheat(TriticumaestivumL.) [J].MolecularBreeding,2012,30(1):113-124.
[13]GENG H W,XIA X C,ZHANG L P,etal.Development of functional markers for a lipoxygenase gene TaLox-B1 on chromosome 4BS in common wheat [J].CropScience,2012,52(2):568-576.
[14]GARBUS I,SORESI D,ROMERO J,etal.Identification,mapping and evolutionary course of wheat lipoxygenase-1 genes located on the A genome [J].JournalofCerealScience,2013,58(2):298-304.
[15]ZHANG F Y,CHEN F,WU P P,etal.Molecular characterization of lipoxygenase genes on the short arm of chromosome 4B in Chinese bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2015,128(8):1467-1479.
[16]南海波.小麦总RNA的提取[J].渤海大学学报:自然科学版,2006,27(1):18-20.
NAN H B.Total RNA extraction from wheat [J].JournalofBohaiUniversity:NaturalScienceEdition,2006,27(1):18-20.
[17]胡群文,陈晓玲,张志娥,等.干种子高质量总RNA的快速提取方法 [J].植物遗传资源学报,2010,11(3):360-363.
HU Q W,CHEN X L,ZHANG Z E,etal.A rapid extraction method of high quality total RNA from dry seeds [J].JournalofPlantGeneticResources,2010,11(3):360-363.
[18]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod [J].Methods,2001, 25(4):402-408.
[19]FEUSSNER I,WASTERNACK C.The lipoxygenase pathway [J].AnnualReviewofPlantBiology,2002,53:275-297.
[20]HILDEBRAND D F,RODRIGUEZ J G,BROWN G C,etal.Peroxidative responses of leaves in two soybean genotypes injured by two spotted spider mites (Acari:Tetranychidae) [J].JournalofEconomicEntomology,1986,79(6):1459-1465.
[21]SHUKLE R H,MURDOCK L L.Lipoxygenase trypsin inhibitor,and lectin from soybeans:effects on larval growth of manducasexta (Lepidoptera:Sphingidae) [J].EnvironmentalEntomology,1983,12(3):787-791.
[22]ROYO J,VANCANNEYT G,PÉREZ A G,etal.Characterization of three potato lipoxygenases with distinct enzymatic activities and different organ-specific and wound-regulated expression patterns [J].TheJournalofBiologicalChemistry,1996,271:21012-21019.
[23]OCAMPO C A,MOERSBACHER B,GRAMBOW H J.Increased lipoxygenase activity is involved in the hypersensitive response of wheat leaf cells infected with a rulent rust fungi or treated with fungal elicitor [J].ZeitschriftfürNaturforschungC,1986,41(5-6):559-563.
[24]张荣平,王振镒,高俊风,等.小麦胚根脂氧合酶(LOX)活性变化与抗热-抗旱性的关系[J].干旱地区农业研究,1992,10(4):81-85.
ZHANG R P,WANG Z Y,GAO J F,etal.Relation of LOX activity in wheat radicle with drought-heat resistance [J].AgriculturalResearchintheAridAreas,1992,10(4):81-85.
Expression Analysis of Wheat Lipoxygenase Genes at Different Stress Conditions by Quantitative Real-Time PCR
ZHANG Fuyan1,2,CHEN Feng2,ZHANG Jianwei1,YANG Baoan1,FAN Jialin1,CHEN Xiaojie1,CHEN Yuntang1,CUI Long1
(1.Isotope Institute Co.,Ltd,Henan Academy of Sciences/Henan Key Laboratory of Nuclear Agricultural Sciences,Zhengzhou,Henan 450015,China; 2.Agronomy College,Henan Agricultural University/Collaborative Innovation Center of Food Crops in Henan Province,Zhengzhou,Henan 450002,China)
To explore the biology function of wheat lipoxygenase genes under abiotic stress,we used the quantitative real-time PCR to deduce the expression profiling of TaLox-B2 and TaLox-B3 genes in roots,stems,leaves and mature seeds of wheat and the expression analysis of TaLox-B2 and TaLox-B3 genes in leaves under salt-stress treatment (100 mmol·L-1NaCl),low temperature-stress treatment (4 ℃),high temperature-stress treatment(42 ℃) and drought-stress treatment(20% PEG6000). The results showed that TaLox-B2 and TaLox-B3 genes could express in various tissues of wheat,including roots,stems,leaves and mature seeds. The expression of TaLox-B2 was mainly in the leaves and mature seeds,while TaLox-B3 was expressed primarily in the roots and leaves. The expression trends of TaLox-B2 and TaLox-B3 were similar to normal distribution and reached a peak at 3 h under high salinity. TaLox-B2 gene did not show a significant trendline under low temperature-stress treatment. The expression of TaLox-B3 gene was up-regulated at low temperature from 0 h to 6 h,and began to gradually decline afterwards. The expression of TaLox-B2 and TaLox-B3 genes were down-regulated at high temperature-stress treatment from 0 h to 12 h.However,the TaLox-B2 and TaLox-B3 genes showed obviously different trendlines. TaLox-B2 and TaLox-B3 genes showed obviously different expression profiles,respectively,and their expression levels were very low,while there were no clear expression tendency were observed under the treatment of PEG6000. To summarize, TaLox-B2 and TaLox-B3 were mainly induced by salt-stress,but no specific relationship with PEG drought stress was found. In addition,the expression of TaLox-B2 and TaLox-B3 genes have more obvious influence on the temperature changes,but the mechanism of the effect of the low temperature and high temperature are different.
TriticumaestivumL.; Stress; Lipoxygenase genes; Expression analysis
2016-03-09
2016-05-06
河南省基础与前沿技术研究计划资助项目(162300410169;152300410141);河南省小麦产业技术体系建设专项资金项目(Z2010-01-04);郑州市重大科技攻关项目(121PZDGG071)
E-mail:zhangfuyan704@163.com
张建伟(E-mail:zjw10308@163.com);杨保安(E-mail:yangcorn@163.com)
S512.1;S330
A
1009-1041(2016)09-1153-06
网络出版时间:2016-08-31
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160831.1649.010.html
