神经调节蛋白1对高糖损伤的心肌细胞的保护作用及其机制
2016-10-27罗明雄陈小丹魏玲
罗明雄,陈小丹,魏玲
神经调节蛋白1对高糖损伤的心肌细胞的保护作用及其机制
罗明雄,陈小丹,魏玲
目的:研究神经调节蛋白1(NRG-1)对高糖损伤的心肌细胞的保护作用及其机制。
方法:培养大鼠胚胎期心脏组织H9c2心肌细胞,进行分组处理。分别为对照组(不加任何诱导药物处理24 h)、高糖作用组(HG组,用含终浓度33 mmol/L的葡萄糖培养基培养心肌细胞处理24 h )、不同浓度NRG-1作用组(分别在含有33 mmol/L高浓度葡萄糖的培养基中同时加入10、50、250 nmol/L的NRG-1培养心肌细胞处理24 h,设定为N1、N2、N3组)。细胞计数(CCK-8)方法检测各组心肌细胞存活率;流式细胞术检测各组心肌细胞胞内活性氧(ROS)水平和细胞凋亡情况;同时测定各组心肌细胞中肌酸激酶(CK)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)活力和丙二醛(MDA)含量;蛋白免疫印迹(Western-blot)方法检测各组心肌细胞中NRG-1的受体,即表皮生长因子受体-2(ErbB2)和表皮生长因子受体-4(ErbB4)的表达;原位缺口末端标记法(Tunel)染色检测2型糖尿病心肌病模型大鼠经NRG-1处理后的心肌细胞凋亡。
结果:N1组至N3组心肌细胞的存活率由(63.33±3.56)%上升至(85.88±4.55)%;心肌细胞中ROS含量由(33.57±4.23)%下降至(15.88±4.55)%;细胞凋亡率由(36.44±4.86)%下降至(14.77±4.21)%;心肌细胞中ErbB2和ErbB4受体表达随之分别由(0.26±0.04)、(0.39±0.03)上升至(0.84±0.03)、(0.72±0.04),与HG组比差异均有统计学意义(P<0.05);CK、LDH酶活力和MDA含量逐渐下降而SOD活性逐渐回升,与HG组比差异均有统计学意义(P<0.05)。NRG-1作用的2型糖尿病心肌病模型大鼠心肌组织细胞凋亡也显著下降。
结论:NRG-1能够提升高糖作用下心肌细胞存活率,减轻高糖对心肌细胞氧化应激损伤和细胞凋亡,可能通过与心肌细胞中ErbB2/ErbB4受体结合发挥作用。
神经调节蛋白-1;肌细胞,心脏;氧化应激;细胞凋亡;糖尿病心肌病
Abstract
Objective: To study the protective roll of neuregulin-1 (NRG-1) on high glucose caused myocardial cell injury in rat’s embryo H9c2 myocardial cells with its mechanism.
Methods: Cultured rat’s embryo H9c2 myocardial cells were divided into 5 groups:① Control group,② High glucose(HG) group, containing glucose 33 mmol/L,③ HG+NRG-1 10 nmol/L (N1) group,④ HG+NRG-1 50 nmol/L (N2) group and⑤HG+NRG-1 250 nmol/L (N3) group. All cells were treated for 24 hours. Myocardial cell survival rate was measured by CCK-8 method, intracellular reactive oxygen species (ROS) level and the apoptosis rate were detected by flow cytometry, enzymes activities of CK, LDH, SOD and MDA content were examined, proteins expressions of NRG-1 receptor as ErbB2 and ErbB4 were assessed by Western blot analysis. NRG-1 treated myocardial cell apoptosis in type II diabetic cardiomyopathy rats was observed by Tunel staining.
Results: Compared with HG group, from N1 group to N3 group, myocardial cell survival rates were increased from (63.33±3.56) %to (85.88±4.55) %, ROS levels decrease form (33.75±4.23) % to (15.88±4.55) %, apoptosis rates reduced from (36.44±4.86) % to(14.77±4.21) %, receptor expressions of ErbB2 was elevated from (0.26±0.04) to (0.84±0.03) and ErbB4 was elevated from (0.39±0.03)to (0.72±0.04), all P<0.05; enzymes activities of CK, LDH and MDA content were gradually decreased and SOD activity was gradually increased, all P<0.05. NRG-1 treated myocardial cell apoptosis in type II diabetic cardiomyopathy rats was also obviously reduced.
Conclusion: NRG-1 could increase the survival rate and reduce the oxidative stress injury and apoptosis of cultured rat’s embryo H9c2 myocardial cells in HG condition which might be related to NRG-1 binding to ErbB2/ErbB4 molecules in the cells.
(Chinese Circulation Journal, 2016,31: 902.)
有研究表明高血糖能够导致糖尿病性心肌病和心力衰竭,是糖尿病性心肌损伤疾病的独立危险因素[1]。但糖尿病引起心肌损伤疾病不容易被诊治,常导致糖尿病心血管并发症患者死亡率升高。预防并减轻高血糖引起的心肌或血管损伤对于防治心血管疾病具有重要价值,但目前关于糖尿病性心肌病的发病机制尚不完全清楚[2]。神经调节蛋白-1(NRG-1)是类表皮生长因子家族成员,在心脏发育过程中发挥重要作用[3]。研究表明NRG-1基因缺失的胎鼠心脏发育会出现缺陷,表明NRG-1在胎鼠心肌发育中发挥作用[4]。有研究发现高糖可抑制心肌微血管细胞中NRG-1的表达,当加入胰岛素治疗后细胞中NRG-1表达能够回升,因此推测NRG-1可能在减轻高血糖引起心肌损伤中发挥重要作用[5]。为了揭示NRG-1在糖尿病性心肌疾病中发挥的作用,本研究利用高糖直接作用于H9c2心肌细胞模拟临床上高血糖引起糖尿病性心肌损伤疾病状态,观察NRG-1对高糖作用下心肌细胞损伤的影响,并揭示其是否能够通过抗氧化应激和细胞凋亡发挥作用。
1 材料与方法
1.1材料及试剂
H9c2心肌细胞株购自中国科学院上海生科院细胞资源中心;DMEM/F-12细胞培养基、胎牛血清、含0.25%EDTA的胰酶购自美国Hyclone公司;NRG-1购自美国R&D公司;细胞计数试剂盒8(CCK-8)购自北京鼎国生物公司;肌酸激酶(CK)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)试剂盒购自南京建成生物公司;丙二醛(MDA)酶联免疫标记试剂盒购自武汉华美生物工程公司;双氢罗丹明123、Annexin-V/PI细胞凋亡试剂盒购自美国BD公司;多克隆兔抗鼠表皮生长因子受体2(ErbB2)、表皮生长因子受体4(ErbB4)、β肌动蛋白(β-actin)一抗购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗、增强化学发光(ECL)试剂盒购自北京中杉金桥公司。30只Wistar大鼠,质量160~180 g,无特定病原体(SPF)级别,合格证号SCXK-2012-0031,由南京医科大学实验动物中心提供。
1.2实验方法
细胞培养及分组处理:将来源自大鼠胚胎期心脏组织的H9c2心肌细胞复苏后,在含10%的胎牛血清的DMEM/F12细胞培养基中培养,并置于37℃,5% CO2的培养箱中。待细胞贴壁生长至80%时,消化收集细胞进行后续实验。实验分为5组,分别为正常对照组:用正常DMEM/F12培养基,不加其他诱导药物处理24 h;高糖作用组(HG组):利用含终浓度33 mmol/L葡萄糖的培养基培养处理24 h;不同浓度NRG-1作用组(分别设定为N1、N2、N3组):在含有33 mmol/L高浓度葡萄糖的心肌细胞培养基中同时分别加入10、50、250 nmol/L的NRG-1培养处理24 h。
CCK-8方法检测细胞存活率[6]: 将生长状态良好的H9c2心肌细胞以5×104个/ml接种于96孔板中,待细胞贴壁生长后,按照上述分组处理24 h后在每孔中加入20 µl的CCK-8溶液,在37℃下继续孵育培养4 h,用酶标仪测定各孔在450 nm处的吸光值(A值)。每组细胞设置6个复孔,并进行3次重复实验。按照下公式计算各组心肌细胞的存活率:细胞存活率(%)=处理组A值/对照组A值×100%。
流式细胞术检测ROS和细胞凋亡率[7,8]: 将H9c2心肌细胞等量接种于6孔板中,并按照相同的分组处理方法诱导处理24 h,后利用0.25%的胰酶消化离心收集各组细胞。用磷酸缓冲盐溶液(PBS:137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/ L Na2HPO4,2 mmol/L KH2PO4,pH7.2~7.4)洗涤细胞2次后,重悬细胞并分别加入1 µmol/L的双氢罗丹明123孵育1 h,孵育完后离心收集细胞并用PBS洗涤1次。各组细胞中活性氧(ROS)能够将双氢罗丹明123氧化成罗丹明123而发出荧光,利用流式细胞仪可以检测各组细胞中阳性荧光表达率反映心肌细胞中ROS含量变化。另外将消化重悬的各组心肌细胞,先用FITC标记的膜连蛋白V(Annexin-V)和碘化丙啶(PI)各5 µl混匀室温避光孵育30 min,后用PBS洗涤两次后离心,并用150 µl的PBS重悬细胞,立即用流式细胞仪上样检测各组心肌细胞经处理后的凋亡率。
检测CK、LDH、SOD酶活力和MDA含量变化:将H9c2心肌细胞接种于6孔板中,按照上述分组处理方法处理24 h。培养结束后收集各组细胞的上清,按照文献[9]建立标准曲线,分光光度计比色法测定各组心肌细胞经不同处理后细胞上清中漏出的LDH、CK酶活力。同时消化收集各组细胞,PBS洗涤1次后利用强蛋白提取试剂(50 mM Tris,150 mM NaCl,pH7.4)提取各组心肌细胞中总蛋白。同样分光光度计比色法测定各组细胞中SOD酶活力[9]。按照文献[10]中酶联免疫标记法测定各组心肌细胞中MDA含量。
蛋白免疫印迹(Western-blot)检测受体分子ErbB2和ErbB4表达:按照上述相同方法分组培养处理H9c2心肌细胞24 h,后用0.25%的胰酶消化离心收集各组心肌细胞。PBS洗涤2次后用RAPI强细胞裂解蛋白提取试剂提取各组心肌细胞中总蛋白。按照文献[7]中利用BCA试剂盒测定各组细胞中总蛋白浓度。每组上样总蛋白30 µg,12%的SDS-PAGE凝胶电泳1.5 h,半干法转聚偏二氟乙烯(PVDF)膜,并用含5%脱脂奶粉的TBST溶液(20 mmol/L Tris-HCl,500 mmol/L NaCl,0.05% Tween20,pH7.5)封闭30 min,后分别孵育多克隆兔抗鼠ErbB2、ErbB4、β-actin一抗(1:1000稀释)4℃过夜,后用TSBT溶液振荡洗涤3次,再室温下孵育HRP标记的山羊抗兔IgG二抗(1:5000稀释)2 h,TBST溶液洗涤3次后,加入ECL化学发光试剂显影曝光并拍照。利用Quantity One软件分析各目的蛋白的相对表达含量变化。
原位缺口末端标记法(Tunel)检测Ⅱ型糖尿病心肌病模型大鼠心肌细胞凋亡情况:将Wistar大鼠30只随机分成三组,在温度(23±2)℃,相对湿度(55±2)%的环境下自由饮水进食。10只大鼠为健康对照组;其余20只用高脂高糖饲料(基础饲料66.6%、葡糖糖20.0%、猪油10.0%、胆固醇0.4%、蛋白粉3.0%)连续喂4周后,按照45 mg/kg的比例腹腔注射新配制的链脲佐菌素(0.1%的柠檬酸缓冲液,pH4.5配制)部分破坏胰岛β细胞功能。1周后大鼠尾部采血测大鼠空腹血糖持续3 d高于16.7 mmol/L,有多饮、多尿、多食现象,且经检测心功能均出现异常(每搏输出量、心排血量降低、而心室最大舒张速度升高)即为2型糖尿病大鼠造模成功,为糖尿病心肌病组,糖尿病心肌病大鼠继续高糖高脂喂食4周;NGR-1处理组:糖尿病心肌病大鼠继续高糖高脂喂食外每天尾静脉注射1 ml的250 nmol/(kg·ml)的NGR-14周。结束后麻醉处死各组大鼠,取心肌组织切片,后按照文献[9]Tunel方法染色检测各组大鼠心肌组织细胞凋亡情况。
1.3统计学方法

2 结果
2.1NRG-1能够抑制高糖对心肌细胞的毒性作用(图1)
CCK-8检测: 与正常对照组比,HG组中H9c2心肌细胞存活率显著下降(P<0.05);与HG组相比,N1、N2、N3组中H9c2心肌细胞存活率均显著上升,并具有浓度效应(P<0.05)。
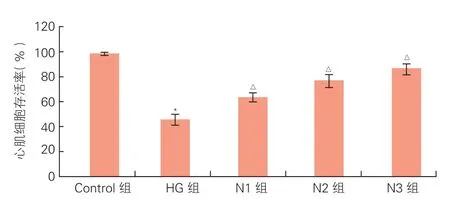
图1 神经调节蛋白1对高糖作用下H9c2心肌细胞存活率的影响(n=3)
2.2NRG-1减少高糖诱导心肌细胞中ROS的产生(图2)
流式细胞术检测: 与正常对照组比,HG组ROS含量显著上升(P<0.05);N1、N2、N3组细胞中ROS含量较HG组均下降,并随着NRG-1作用浓度的升高,ROS含量下降越明显,与HG组比差异有统计学意义(P均<0.05)。
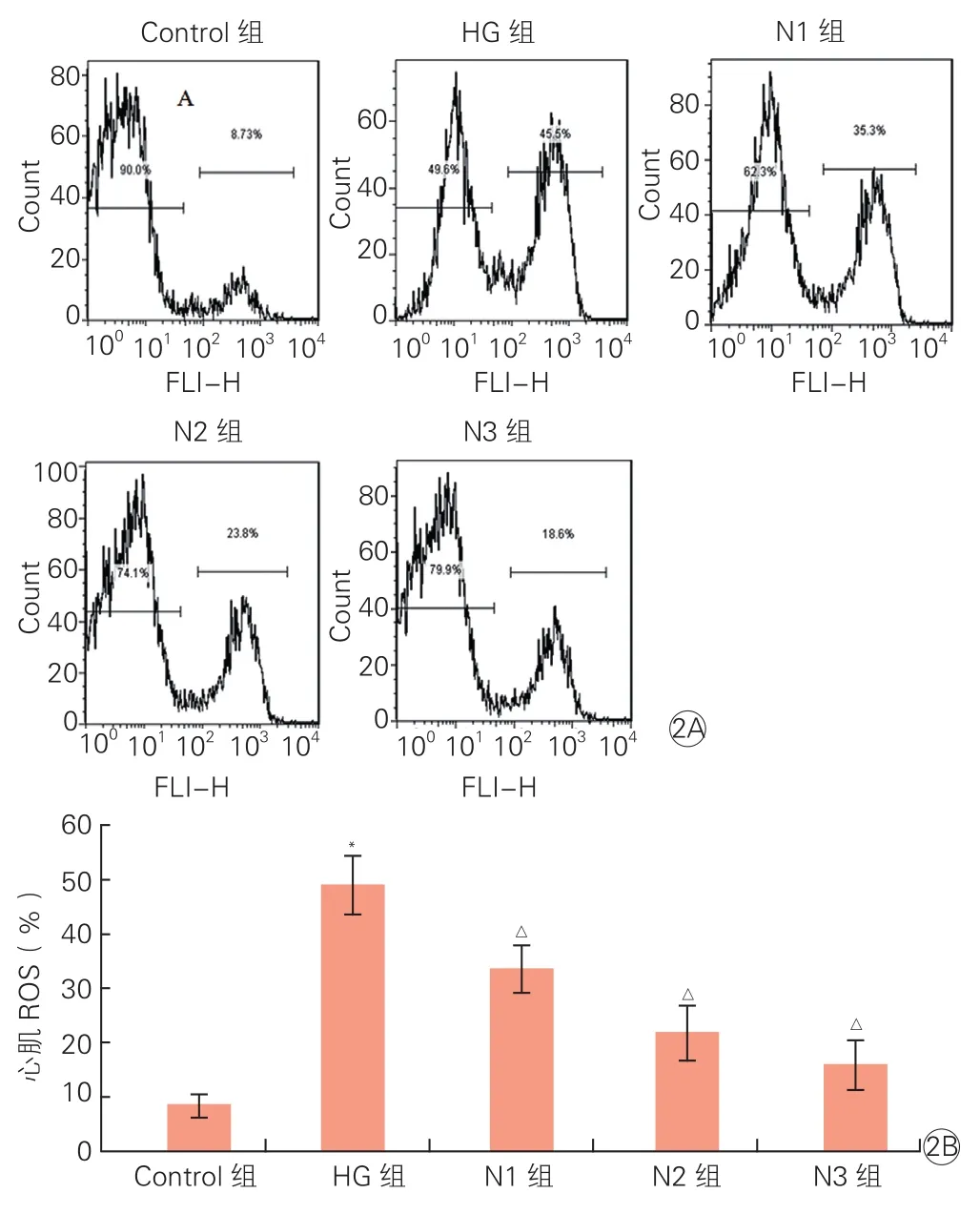
图2 神经调节蛋白1对高糖作用下心肌细胞中ROS含量的影响
2.3NRG-1降低高糖引起的心肌细胞凋亡(图3)
流式细胞术检测各组心肌细胞凋亡: 与正常对照组比,HG组中H9c2心肌细胞凋亡率显著增加(P<0.05);与HG组比,N1、N2、N3组中H9c2心肌细胞凋亡率则逐渐下降(P均<0.05)。
2.4NRG-1促进心肌细胞抵抗高糖引起氧化应激反应(表1)
与正常对照组相比,HG组中H9c2心肌细胞中LDH、CK酶活力和MDA含量均显著增加,而SOD酶活力显著下降(P均<0.05);N1、N2、N3组中H9c2心肌细胞中LDH、CK酶活力和MDA含量逐渐下降,而SOD酶活力则随之逐渐上升,与HG组比差异均有统计学意义(P均<0.05)。
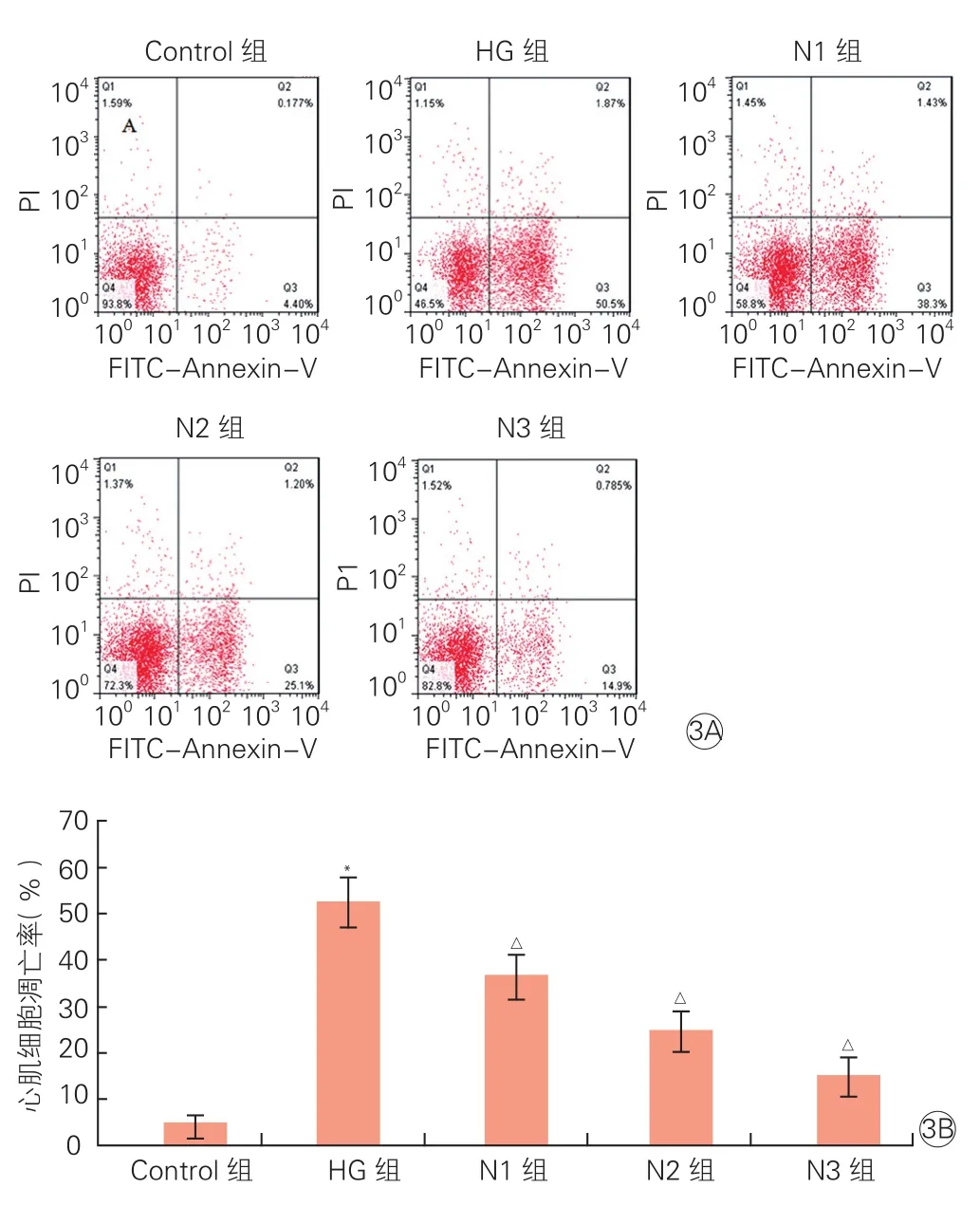
图3 神经调节蛋白1对高糖作用下心肌细胞凋亡的影响 (n=3)
表1 NRG-1对高糖作用下培养的H9c2心肌细胞上清液中CK和LDH活力以及心肌细胞的SOD活力和MDA含量的影响
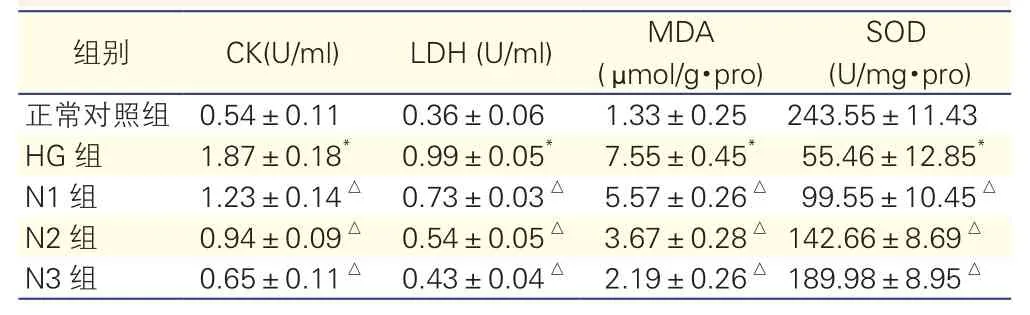
表1 NRG-1对高糖作用下培养的H9c2心肌细胞上清液中CK和LDH活力以及心肌细胞的SOD活力和MDA含量的影响
注:CK:肌酸激酶;LDH:乳酸脱氢酶;MDA:丙二醛;SOD:超氧化物歧化酶;HG组:高糖作用组;N1组:10 nmol/L NRG-1和高糖同时作用组;N2组:50 nmol/L NRG-1和高糖同时作用组;N3组:250 nmol/L NRG-1和高糖同时作用组。与正常对照组比*P<0.05;与HG组比△P<0.05
SOD(U/mg·pro)正常对照组 0.54±0.11 0.36±0.06 1.33±0.25 243.55±11.43 HG组 1.87±0.18* 0.99±0.05* 7.55±0.45* 55.46±12.85*N1组 1.23±0.14△ 0.73±0.03△ 5.57±0.26△ 99.55±10.45△N2组 0.94±0.09△ 0.54±0.05△ 3.67±0.28△142.66±8.69△N3组 0.65±0.11△ 0.43±0.04△ 2.19±0.26△189.98±8.95△组别 CK(U/ml) LDH (U/ml) MDA(μ mol/g·pro)
2.5NRG-1促进高糖作用下心肌细胞中ErbB2和ErbB4表达(图4)
Western-blot检测:与正常对照组比,HG组H9c2心肌细胞中ErbB2表达水平显著降低(P<0.05),而ErbB4表达水平变化不明显;与HG组比N1、N2、N3组中H9c2心肌细胞中ErbB2和ErbB4表达水平均随之显著上升,并具有浓度效应(P均<0.05)。

图4 蛋白免疫印迹分析神经调节蛋白1对高糖作用下心肌细胞中ErbB2和ErbB4表达的影响 (n=3)
2.6NRG-1减少2型糖尿病心肌病模型大鼠心肌组织凋亡(图5)
Tunel检测:大鼠健康对照组心肌组织中基本未见凋亡心肌细胞;糖尿病心肌病组心肌组织中可见大量心肌细胞凋亡;而NRG-1处理组凋亡的心肌细胞显著减少,说明NRG-1能够对高糖损伤的2型糖尿病心肌病大鼠心肌组织发挥保护作用。

图5 神经调节蛋白1对糖尿病心肌病模型大鼠心肌组织凋亡的影响
3 讨论
临床研究发现,糖尿病能够明显增加心肌病、心力衰竭、先天性心脏病和冠心病等心血管疾病的发生率和致死率,糖尿病患者由于体内持续的高血糖水平,容易诱发并导致糖尿病性心肌病心血管并发症[3]。而糖尿病性心肌疾病不容易发现并易被忽视,成为2型糖尿病患者心血管并发症致死的主要诱因之一,但其明确的发病机制尚不完全明确。有研究表明,由循环系统中高血糖水平造成的氧化应激使心肌细胞受损发生细胞凋亡和功能减弱,与糖尿性心肌疾病的发生发展密切相关[11]。近来研究发现,神经调节蛋白NRG-1在幼、成年人心脏心内膜、心肌微血管中均有较高表达,当心肌受到损伤时,NRG-1表达量会显著减少[12]。施国祥等[13]研究表明高糖可抑制心肌微血管细胞中NRG-1蛋白和mRNA的表达,当加入胰岛素后心肌细胞中NRG-1表达能够回升,推测NRG-1在心肌细胞抵抗高糖损伤中可能发挥重要作用。而本研究利用高浓度葡萄糖作用于H9c2心肌细胞构建糖尿病性心肌损伤模型,发现高糖能够显著降低心肌细胞存活率,而NRG-1能够逐渐提升心肌细胞的存活率,减轻高糖产生的细胞毒性作用,说明NRG-1能够保护高糖损伤的心肌细胞,促进其存活。
目前,大多研究者认为糖尿病性心肌疾病与高血糖引起的心肌细胞氧化应激有关,而活性氧ROS积累引起的氧化应激在糖尿病心血管并发症中发挥极其关键作用[14]。Niedowicz等[15]在糖尿病并发症心力衰竭确诊患者的心肌活检中,能够观察发现ROS产生显著增多。本研究中利用流式细胞术检测同样发现单独高糖作用下,H9c2心肌细胞中产生ROS阳性率显著上升,但在不同浓度NRG-1同时作用下,各组心肌细胞中ROS含量均显著下降,说明NRG-1能够减少或清除高糖诱导心肌细胞中积累产生的ROS。同时NRG-1促进心肌细胞抵抗氧化应激损伤并维持细胞功能也可以通过CK、LDH、SOD和MDA反映出来。CK是心肌细胞胞内酶,其能够直接反映心肌细胞损伤程度,而LDH与细胞功能变化、结构完整性有关,研究表明高糖作用下乳鼠心肌细胞中CK和LDH酶活力都会显著增加[16]。本研究中在NRG-1和高糖同时作用下,体外培养的心肌细胞上清液中CK和LDH酶活力均有所降低,并具有浓度效应,说明NRG-1能够保护高糖作用下心肌细胞的完整性,并维持其细胞功能。MDA含量和SOD活性变化是反映机体抵抗氧化应激反应的重要指标,有研究证实高糖能够刺激心肌细胞中MDA含量升高,使SOD活性下降,说明高糖损伤心肌细胞抗氧化系统[17]。本研究中发现NRG-1和高糖同时作用后,心肌细胞中MDA含量逐渐下降,而SOD活性逐渐上升,表明NRG-1能够提升心肌细胞抗氧化应激能力和清除氧自由基以减轻高糖的损伤作用。
近来研究发现,在糖尿病各种心血管并发症发生机制中,细胞凋亡均发挥着重要的调节作用[18]。贾强等[19]研究发现高糖能够诱导乳鼠心肌细胞凋亡,而氧化应激是高糖诱导心肌细胞凋亡的一个重要机制。上述研究已发现NRG-1能够促进心肌细胞抵抗氧化应激损伤,另利用流式细胞术检测NRG-1对高糖作用下的心肌细胞凋亡的影响。研究发现在不同浓度NRG-1同时作用下,心肌细胞凋亡率逐渐下降,显著低于单独高糖作用组。同时本研究中建立的糖尿病心肌病大鼠模型,经NRG-1处理后其心肌组织凋亡细胞也显著减少,从细胞和组织水平验证NRG-1能够降低高糖作用下心肌细胞凋亡发挥保护作用。有研究发现NRG-1主要通过与其心肌细胞膜上的受体蛋白ErbB2/ErbB4结合,使下游的具有转录激活功能的分子磷酸化而发挥作用[20]。本研究中发现单独高糖作用下,心肌细胞中ErbB2和ErbB4表达水平有所下降;而当不同浓度NRG-1和高糖同时作用时,心肌细胞中ErbB2和ErbB4表达却均升高,且显著高于高糖单独作用组,说明NRG-1减轻高糖作用下心肌细胞氧化应激和细胞凋亡可能通过与受体结合并激活NRG-1/ ErbB2/ErbB4信号通路发挥作用。
综上所述,本研究首次发现神经调节蛋白NRG-1能够提升高糖作用下心肌细胞存活率,减轻高糖对心肌细胞氧化应激损伤和细胞凋亡,并通过与心肌细胞中受体ErbB2/ErbB4结合发挥作用。通过本研究为临床防治糖尿病性心肌病提供前期基础和理论依据。
[1] 孙洋, 赵红. 糖尿病冠状动脉硬化性心脏病中心肌损伤与氧化应激的关系. 中国循环杂志, 2014, 29: 952-954.
[2] 刘忠和, 余薇, 刘超, 等. 姜黄素对糖尿病大鼠心肌的保护作用.中国病理生理杂志, 2014, 30: 725-728.
[3] Xu M, Wu X, Jie B, et al. Neuregulin-1 protects myocardial cells against H2O2-induced apoptosis by regulating endoplasmic reticulum stress. Cell Biochem Funct, 2014, 32: 464-469.
[4] Formiga FR, Pelacho B, Garbayo E, et al. Controlled delivery of fibroblast growth factor-1 and neuregulin-1 from biodegradable microparticles promotes cardiac repair in a rat myocardial infarction model through activation of endogenous regeneration. J Control Release, 2014, 173: 132-139.
[5] Chen M, Bi LL, Wang ZQ, et al. Time-dependent regulation of neuregulin-1β/ErbB/ERK pathways in cardiac differentiation of mouse embryonic stem cells. Mol Cell Biochem, 2013, 380: 67-72.
[6] 刘玥, 帅春, 李杰生, 等. 活细胞计数试剂盒在检测 5-氮杂-2’-脱氧胞苷对慢性粒细胞白血病细胞的增殖抑制作用中的应用. 解剖学报, 2014, 45: 582-584.
[7] 宋小英, 景鹏伟, 熊丽溶, 等. 骨髓基质细胞衰老对造血细胞氧化应激的影响. 解剖学报, 2015, 46: 757-763.
[8] 李文明, 吴琦, 朱彧. 异硫氰酸苄酯诱导脑胶质瘤 U-87 MG 细胞凋亡及其机制的研究. 中国药理学通报, 2014, 30: 116-120.
[9] 马懿江, 何庆, 胡志东, 等. 间歇低氧合并肺气肿大鼠模型肝脏氧化应激及凝血功能的研究. 天津医药, 2015, 43: 117-120.
[10] Vanessa Fiorentino T, Prioletta A, Zuo P, et al. Hyperglycemiainduced oxidative stress and its role in diabetes mellitus related cardiovascular diseases. Curr Pharm Design, 2013, 19: 5695-5703.
[11] Pitocco D, Tesauro M, Alessandro R, et al. Oxidative stress in diabetes: implications for vascular and other complications. Int J Mol Sci, 2013,14: 21525-21550.
[12] Odiete O, Konik EA, Sawyer DB, et al. Type 1 diabetes mellitus abrogates compensatory augmentation of myocardial neuregulin-1beta/ ErbB in response to myocardial infarction resulting in worsening heart failure. Cardiovasc Diabetol, 2013, 12: 52.
[13] 施国祥, 郑泽琪, 李宾公, 等. 高糖对心肌微血管内皮细胞表达神经调节蛋白1的影响. 中国组织工程研究与临床康复, 2010, 14: 5159-5162.
[14] Rajesh M, Bátkai S, Kechrid M, et al. Cannabinoid 1 receptor promotes cardiac dysfunction, oxidative stress, inflammation, and fibrosis in diabetic cardiomyopathy. Diabetes, 2012, 61: 716-727.
[15] Niedowicz DM, Daleke DL. The role of oxidative stress in diabetic complications. Cell Biochem Biophys, 2005, 43: 289-330.
[16] Wang X, Qin W, Qiu X, et al. A novel role of exogenous carbon monoxide on protecting cardiac function and improving survival against sepsis via mitochondrial energetic metabolism pathway. In J Biol Sci,2014, 10: 777.
[17] Li Z, Hu J, Li Y, et al. The effect of hyperoside on the functional recovery of the ischemic/reperfused isolated rat heart: potential involvement of the extracellular signal-regulated kinase 1/2 signaling pathway. Free Radical Bio Med, 2013, 57: 132-140.
[18] Duan J, Wei G, Guo C, et al. Aralia taibaiensis protects cardiac myocytes against high glucose-induced oxidative stress and Apoptosis. Am J Chinese Med, 2015, 43: 1159-1175.
[19] 贾强, 杨锐, 马善峰, 等. 硫化氢对糖尿病大鼠心肌损伤保护作用及其抗凋亡机制. 安徽医科大学学报, 2014, 49: 172-176.
[20] Hedhli N, Kalinowski A, S Russell K. Cardiovascular effects of neuregulin-1/ErbB signaling: Role in vascular signaling and Angiogenesis. Curr Pharm Design, 2014, 20: 4899-4905.
Protective Roll of Neuregulin-1 on High Glucose Caused Myocardial Cell Injury in Rat’s Embryo H9c2 Myocardial Cells With its Mechanism
LUO Ming-xiong, CHEN Xiao-dan, WEI Ling.
Department of Cardiology, Suzhou Wuzhong People’s Hospital, Suzhou (215128), Jiangsu, China
Corresponding Author: WEI Ling, Email: weiling43@163.com
Neuregulin-1; Myocytes, cardiac; Oxidative stress; Apoptosis; Diabetic cardiomyopathy
2015-10-20)
(编辑:常文静)
215128 江苏省,苏州市吴中人民医院 心内科(罗明雄),门诊部(陈小丹);云南省昆明市,成都军区昆明总医院地方干部病房科(魏玲)
罗明雄 主治医师 硕士研究生 研究方向为心血管疾病分子机制研究 Email:LMX750104@163.com 通讯作者:魏玲 Email:weiling43@163.com
R54
A
1000-3614(2016)09-0902-06 doi:10.3969/j.issn.1000-3614.2016.09.018
