清脑滴丸对大鼠脑缺血再灌注后炎性因子动态变化的影响
2016-10-26刘雪梅王建伟赵珈艺王凤丽
刘雪梅 王建伟 赵珈艺 王凤丽 梁 晓
(北京中医药大学东方医院,北京,100078)
清脑滴丸对大鼠脑缺血再灌注后炎性因子动态变化的影响
刘雪梅王建伟赵珈艺王凤丽梁晓
(北京中医药大学东方医院,北京,100078)
目的:观察清脑滴丸对大鼠急性脑缺血再灌注脑梗死面积,皮层肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)改变,探讨淸脑滴丸治疗急性脑梗死的可能机制。方法:线栓法制备大鼠大脑中动脉缺血再灌注模型(MCAO),随机分为正常组,假手术组,模型缺血1.5 h分别再灌注6 h、24 h、48 h、72 h、7 d,清脑滴丸各相应时间点治疗组。TTC染色脑片计算梗死面积。酶联免疫法检测皮层IL-1β、TNF-α和IL-10。结果:脑组织TTC染色显示模型各组均出现明显梗死灶,在再灌24~72 h梗死面积最大(P<0.01),清脑滴丸治疗组的梗死面积明显缩减,再灌24~72 h梗死面积减小最为明显(P<0.01)。与假手术组比较,再灌注6 h时IL-1β、TNF-α、IL-10出现升高,再灌注48~72 h达高峰(P<0.01),至再灌注7 d仍有明显升高。与各模型组比较,清脑滴丸治疗组明显下调IL-1β和TNF-α(P<0.01);且能明显上调IL-10(P<0.05~0.01)。结论:清脑滴丸能够显著下调脑缺血再灌注后TNF-α、IL-1β,上调IL-10,缩小脑梗死面积,减轻脑损伤,提示清脑滴丸治疗急性脑梗死机制可能与调节炎症因子,促炎因子与抗炎因子达到动态平衡有关。
急性脑缺血再灌注;清脑滴丸;TNF-α;IL-1β;IL-10
脑缺血再灌注损伤可继发性引起炎性反应,产生的一系列炎性细胞因子在脑缺血中发挥着双重作用。肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)是公认的炎性介质,可以促进脑缺血损伤区黏附分子的表达和炎性细胞的浸润[1]。白细胞介素-10(IL-10)作为抑炎细胞因子,可通过抑制炎性因子合成,受体表达等途径起到保护脑组织的作用[2]。炎性反应的作用与急性脑缺血再灌注算上时间与程度密切相关。前期实验发现清脑滴丸能够使脑缺血再灌注大鼠的行为学神经功能评分升高,脑组织病理损伤减轻。本研究动态观察急性脑缺血再灌注不同时间引发不同程度脑损伤,检测皮层TNF-α、IL-1β与IL-10,探讨清脑滴丸治疗急性脑梗死的作用机制。
1 材料与方法
1.1材料健康雄性SD大鼠168只,体重(220±20)g,购自维通利华实验动物技术有限公司,许可证号:SCXK(京)2004-0003;清脑滴丸,由北京同仁堂药业提供。IL-1β、IL-10、TNF-α ELISA试剂盒购自上海联硕公司生物科技有限公司。
1.2分组与给药方法健康雄性SD大鼠,每组14只。分为:1)正常对照组:正常大鼠不手术。2)假手术组:大鼠麻醉后暴露颈总动脉,栓线从左侧颈总动脉仅插入10 mm,未阻断大脑中动脉;灌胃等体积生理盐水。3)模型组:分为脑缺血1.5 h后再灌6 h模型组(Ischemia 1.5 h/Reperfusion 6 h,R6 h)、再灌24 h模型组(R24 h)、再灌48 h模型组(R48 h)、再灌72 h模型组(R72 h),再灌7 d模型组(R7 d)。大鼠给予线栓法阻断左侧大脑中动脉1.5 h后拔出栓线,0.5 h后灌胃生理盐水一次,以后每隔12 h灌胃1次,模型组各组分别在拔出栓线6 h、24 h、48 h、72 h、7 d后处死。4)清脑滴丸组:分为清脑滴丸(Q)6 h组、Q24 h组、Q48 h组、Q72 h组、Q7 d组。造模方法同模型组,术后0.5 h予灌胃清脑滴丸配制溶液(90 mg/kg)1次,以后每隔12 h给药1次,各组分别在拔出栓线6 h、24 h、48 h、72 h、7 d后处死,与模型组在时间点上一一对应。
1.3脑缺血再灌注模型(MCAO)的建立参照Zea Longa[3]的方法加以改良,SD大鼠采用10%水合氯醛(35 mg/kg)腹腔注射进行麻醉,仰卧固定于手术台上,颈部正中切开,逐层分离组织,暴露左侧颈总动脉(Common Carotid Artery,CCA)、颈外动脉(External Carotid Artery,ECA)、颈内动脉(Internal Carotid Artery,ICA),永久结扎CCA近心端、ECA根部,微动脉夹暂时夹闭CCA的远心端,在CCA结扎处远心端剪一斜口,经此斜口插入顶端光滑成球面的直径0.24 mm的尼龙线,经CCA分叉处通过ICA入颅至大脑前动脉(Anterior Cerebral Artery,ACA)的起始部,从而闭塞了大脑中动脉(Middle Cerebral Artery,MCA)的起始部,造成了MCA供血相关区的梗死。尼龙线平均插入深度为(18.5±0.5)mm,结扎CCA远心端以固定尼龙线和防止出血,逐层缝合皮肤,尼龙线末端暴露在体外。栓塞3 h、6 h、24 h、48 h、72 h后,拔出尼龙线,模拟急性脑缺血。假手术组除插线10 mm外,其余步骤同模型组。采用Zea Longa神经症状评分,选1~3分的大鼠进行正式实验。

表1 Zea Longa 5分制评分标准
1.4实验方法
1.4.1每个时间点结束后,取7只大鼠新鲜脑组织去除嗅球,小脑和低位脑干,冠状面均匀切5片,将切片放入1%TTC染液中,37℃水浴30 min,梗死部位呈白色,正常脑组织呈红色。将切片依次摆好,拍照,采用Image-pro Plus 5.0软件计算梗死面积。
1.4.2酶联免疫法检测IL-1β、IL-10、TNF-α浓度:每组取7只新鲜缺血侧大脑皮层,按重量体积比加冰冷生理盐水制备成10%的组织匀浆,3 000 r/min离心10 min,ELISA试剂盒检测。
2 结果
2.1脑缺血面积检测TTC染色,正常脑组织呈红色,梗死组织呈白色。正常组和假手术组:大脑红染,未发现任何白色梗死区域;再灌6~7 d模型各组均出现不同面积的白色梗死灶,再灌24~72 h梗死面积最大(P<0.01),给予清脑滴丸治疗后,各组白色梗死灶面积减小,再灌24~72 h梗死面积减小最为明显(P<0.01)。结果见表2,图1。
2.2IL-1β、TNF-α、IL-10浓度假手术组与正常对照组大鼠相比较,IL-1β、TNF-α、IL-10无统计学意义(P>0.05)。与假手术组比较,模型组再灌注6 h出现IL-1β升高,再灌注48 h达高峰(P<0.01),至再灌注7 d仍有处于高值,统计学具有统计学意义(P<0.01);与模型组比较,在相应各时间点,清脑滴丸治疗后,IL-1β在再灌注24 h开始出现降低,再灌注48~72 h降低最明显(P<0.01),在再灌注7 d仍有下降趋势(P<0.01)。再灌注6 h时TNF-α出现明显升高,再灌注48 h达到高峰,至7 d仍处于明显升高状态,与假手术组比较,差异显著(P<0.01);与模型组比较,在相应各时间点,清脑滴丸治疗后,TNF-α在再灌注6 h~7 d均有明显降低(P<0.01)。再灌注6 h时IL-10出现升高,再灌注24~72 h升高达到顶峰,至再灌注7 d仍明显高于假手术组,有统计学意义(P<0.01);与模型组比较,在相应各时间点,清脑滴丸治疗后,IL-10升高明显(P<0.05~0.01),再灌注7 d无统计学意义(P>0.05)。结果见表3。

图1 TTC染色
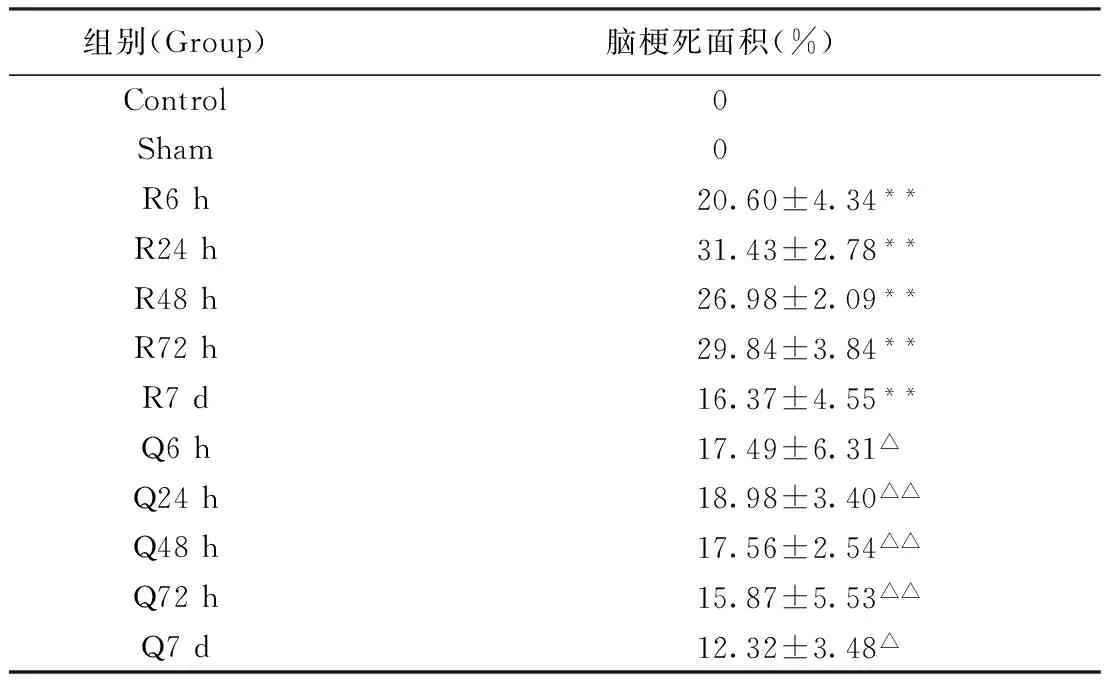
组别(Group)脑梗死面积(%)Control0Sham0R6h20.60±4.34**R24h31.43±2.78**R48h26.98±2.09**R72h29.84±3.84**R7d16.37±4.55**Q6h17.49±6.31△Q24h18.98±3.40△△Q48h17.56±2.54△△Q72h15.87±5.53△△Q7d12.32±3.48△
注:*P<0.05,**P<0.01与相同时间点假手术组比较;△P<0.05,△△P<0.01与相同时间点模型组比较。

表3 IL-1β、TNF-α、IL-10变化
注:*P<0.05,**P<0.01与相同时间点假手术组比较;△P<0.05,△△P<0.01与相同时间点模型组比较。
3 讨论
正常情况下TNF、IL-1、IL-10等炎性因子的表达水平非常低,当发生急性脑缺血后,诸多炎性细胞因子的大量表达,可加重损伤脑组织。当发生急性脑缺血再灌注损伤,首先诱导前炎症因子IL-1β、TNF-α大量产生,继而刺激抗炎因子IL-10产生,促炎因子与抗炎因子之间的平衡失调,促进了炎性反应过程的发生发展。脑缺血再灌注后,细胞受到损伤,各种神经胶质细胞、血管内皮细胞、神经元和血管周围的炎性细胞被激活,分泌大量的IL-1β,过多的、持续表达的IL-1β可以诱导黏附分子的表达,导致大量中性粒细胞在血管上黏附,释放有害的炎性介质,引起脑组织的损伤;同时IL-1β还可以激活内皮细胞产生多种活性物质,导致脑缺血程度加重[4-5]。TNF-α是由多种细胞分泌的一类多向性细胞因子。脑缺血后,TNF-α有加重局部脑损伤的作用,其机制可能为:增加毛细血管通透性和开放血脑屏障;损伤神经髓鞘和少突胶质细胞;促进更多促炎细胞因子释放,加重脑缺血后炎性反应等[6]。IL-10是一种抗炎细胞因子,可以抑制IL-1β和TNF-α产生,也可抑制细胞因子受体表达和激活。IL-10可通过抑制诱导型NO合成酶产生,减轻迟发性脑损伤,减少缺血后期NO生成,也可减少自由基产生,抑制细胞凋亡,发挥保护神经作用[2]。急性脑卒中患者初期IL-10即可升高,且IL-10水平与病情严重程度呈正相关。有研究发现,脑缺血再灌注损伤后IL-10变化晚于TNF-α、IL-1β等,且随着IL-10的升高,TNF-α、IL-1β明显降低[7],证实急性脑缺血再灌注损伤后促炎和抗炎是一个相互作用的过程,抗炎和促炎作用处于动态的非平衡状态,导致损伤加重。
急性脑缺血属中医“中风病”范畴。自内经对中风病就有所描述,在“外风”“内风”立论的基础上,逐渐形成了基于风、火、痰、瘀、虚等主因的辨证体系,其中“火、瘀”作为主要的致病因素,已被历代医家所认可。王永炎院士提出“毒损脑络”学说,认为脏腑功能和气血运行失常,使体内的病理或生理产物蕴积过多,以致邪气亢盛败坏形体而转化为毒,强调瘀毒、痰毒、热毒互结,损伤脑络的理论观点[8]。清脑滴丸来源于王永炎院士的临床经验方,由三七、栀子、冰片组成,栀子味苦,性寒,泻火解毒,主要针对由火致毒,是解火毒的主要药物,三七味甘辛,气微寒,长于活血化瘀之功效,冰片味苦,性微寒,香窜善走,清热泻火,醒脑开窍。三药合用共奏清热解毒,活血宣窍之功效。本团队前期临床工作采用清脑滴丸用于治疗腔隙性脑梗死之风火上扰兼瘀血证患者,发现其明显改善患者的神经功能缺损程度,尤其治疗“善忘迟钝、头痛、眩晕、口苦咽干、大便秘结、舌苔黄”等火热、血瘀的症状效果显著。实验研究也发现清脑滴丸可明显减轻急性局灶性脑缺血大鼠脑组织病理损害,减轻酸中毒、抑制自由基损伤、恢复自由基代谢平衡,抑制黏附分子表达,调节炎性因子保护受损的脑组织[9-10]。从药代动力学角度也发现急性脑缺血模型对清脑滴丸有效组分的生物利用度最高[11]。本研究证实清脑滴丸能够显著下调脑缺血再灌注后TNF-α、IL-1β,上调IL-10,缩小脑梗死面积,减轻脑损伤,提示清脑滴丸治疗急性脑梗死可能与调节炎性因子,促炎因子与抗炎因子达到动态平衡有关,为该药临床治疗提供了科研依据。
[1]刘秀平,许栋明,王文,等.炎症反应影响脑缺血再灌注损伤的研究进展[J].中国康复理论与实践,2009,15(11):1041-1043.
[2]Protti GG,Gagliardi RJ,Forte WC,et al.Interleukin-10 may protect against progressing injury during the acute phase of ischemic stroke[J].Arq Neuropsiquiatr,2013,71(11):846-851.
[3]Longa EZ,Weinstein PR,CarlSon S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]Lambertsen KL1,Biber K,Finsen B.Inflammatory cytokines in experimental and human stroke[J].J Cereb Blood Flow Metab,2012,32(9):1677-1698.
[5]Smith CJ1,Emsley HC,Udeh CT,et al.Interleukin-1 receptor antagonist reverses stroke-associated peripheral immune suppression[J].Cytokine,2012,58(3):384-389.
[6]Bokhari FA1,Shakoori TA,Butt A,Ghafoor F.TNF-alpha:a risk factor for ischemic stroke[J].J Ayub Med Coll Abbottabad,2014,26(2):111-114.
[7]Chen J,Wu X,Shao B,et al.Increased expression of TNF receptor-associated factor 6 after rat traumatic brain in-jury[J].Cell Mol Neurobiol,2011,31(2):269-275.
[8]王永炎.关于提高脑血管疾病疗效难点的思考[J].中国中西医结合杂志,1997,17(4):195-196.
[9]柳洪胜,张允岭,刘雪梅,等.从局灶性脑缺血在关注炎症因子的动态变化探讨内毒形成的作用[J].北京中医药大学学报,2007,30(4):740-743.
[10]王斌,于绍坤,孙建宁,等.清脑宣窍滴丸对急性脑缺血损伤大鼠的保护作用及机理初探[J].中国实验方剂学杂志,2009,15(1):37-41.
[11]周威,石任兵,孙建宁.不同模型下清脑宣窍方有效组分药代动力学研究[J].北京中医药大学学报,2008,31(4):265-268.
(2015-12-28收稿责任编辑:洪志强)
Effects of Qingnao Dripping Pills on Dynamic Changes of Inflammatory Factors after Cerebral Ischemia-reperfusion in Rats
Liu Xuemei, Wang Jianwei, Zhao Jiayi, Wang Fengli, Liang Xiao
(Dongfang Hospital of Beijing University of Chinese Medicine, Beijing 100078, China)
Objective:To observe the cerebral infarct area and contents of tumor Necrosis Factor-α(TNF-α), interleukin-1β(IL-1β) and interleukin-10(IL-10) in rats with acute cerebral infarction, and discuss the mechanism of Qingnao dripping pills in treating such diseases. Methods:The rat models of focal cerebral ischemia and reperfusion were made by thread occlusion technique induced middle cerebral artery occlusion. Rats were randomly divided into 12 groups: control group, sham group, 3 h, 6 h, 12 h, 24 h, 48 h, 72 h reperfusion respectively after 1.5 h ischemia by MCAO, and Qingnao dripping pills groups. Using TTC staining brain to measure infarction area, ELISA to measure IL-1β, TNF-α and IL-10. Results:TTC staining display model group had obvious infarcts, and the infarction area was the largest during 24 h to 72 h reperfusion(P<0.01); while after giving Qingnao dripping pills, the infarction area was significantly reduced(P<0.01). Compared with sham group, IL-1β, TNF-α and IL-10 appeared to rise at 6 h, and at 48 h and 72 h reached reperfusion peak (P<0.01). There was an increasing rise at 7d reperfusion. Compared with the model groups, IL-1β and TNF-α in the Qingnao dripping pills treatment group significantly decreased(P<0.01) and IL-10 obviously increased(P<0.05 ~ 0.01). Conclusion:Qingnao dripping pills can significantly decrease TNF-a and IL-1β and increase IL-10; thus reducing cerebral infarction area and improve brain damage. This may due to that it can modulate inflammatory factor, pro-inflammatory factor and anti-inflammatory factor to achieve dynamic balance.
Acute cerebral ischemia-Reperfusion; Qingnao dripping pills; TNF-α;IL-1β; IL-10
国家自然科学基金项目资助(编号:81202683);北京中医药大学研究创新团队项目(编号:2011-CXTD-23)
刘雪梅(1979.1—),女,博士,副研究员,研究方向:中医药防治中风病机制研究,E-mail:liuxuemei04@126.com
R544+.9
A doi:10.3969/j.issn.1673-7202.2016.01.007
