IL-22在蓝莓益生菌血清干预肝细胞脂肪变性实验中的表达
2016-10-26祝娟娟程明亮
祝娟娟 程明亮
·论著·
IL-22在蓝莓益生菌血清干预肝细胞脂肪变性实验中的表达
祝娟娟程明亮
目的探讨蓝莓益生菌血清通过对IL-22表达的影响改善非酒精性脂肪肝的作用机制。方法血清药理学方法制备大鼠10%蓝莓益生菌低、中、高剂量血清。建立游离脂肪酸(FFA)诱导的正常肝细胞株L-02细胞脂肪变性模型,设立正常组、模型组、蓝莓益生菌低、中、高剂量血清组。油红O染色检测细胞内的脂质沉积;定量检测细胞内三酰甘油(TG)含量;RT-PCR检测各组IL-22 基因表达;Western blot及免疫荧光法检测各组IL-22蛋白表达。结果FFA诱导刺激24 h后,模型组细胞内可见大量脂质沉积,且TG含量明显高于正常组(P=0.000),IL-22的基因及蛋白表达均较正常组明显减弱(P=0.000);与模型组相比,蓝莓益生菌低、中、高剂量血清组的TG逐渐降低(P=0.000),细胞内的脂肪沉积逐渐减轻;高剂量血清组IL-22的基因和蛋白表达较模型组、低剂量血清组、中剂量血清组显著增强(P=0.000),但蓝莓益生菌低、中剂量血清组之间IL-22的基因表达和蛋白表达差异无统计学意义(P>0.05)。结论蓝莓益生菌血清能上调IL-22的表达,参与改善非酒精性脂肪肝的作用机制。
蓝莓益生菌血清;肝细胞;脂肪变性;白介素-22
非酒精性脂肪性肝病(NAFLD)已成为全世界最常见的肝脏疾病之一[1-2],且呈上升趋势。该病包括单纯性非酒精性脂肪肝、非酒精性脂肪性肝炎、肝纤维化及肝硬化等[3]。据统计,10%~20%的NAFLD患者伴有不同程度的肝细胞炎性反应[4]。IL-22是IL-10家族成员中的一员,与IL-10在结构上存在明确的相关性[5],是重要的护肝因子,在多种肝脏疾病中呈现保护作用[6-7]。IL-22可通过激活JAK1/STAT3信号通路,下调脂肪酸转运蛋白达到治疗酒精性脂肪性肝病的目的[8]。目前,临床尚缺乏治疗NAFLD的特效药物[9],益生菌作为肠道微生态调节剂能有效减轻内毒素血症,改善肠道屏障功能,在NAFLD的治疗中能起到一定治疗作用[10-11]。中医认为,“上工治未病”,因此通过饮食调节是治疗NAFLD的重要手段。蓝莓营养成分丰富,富含花青素及多种多酚类物质,具有很好的抗氧化性、抗炎性反应、增强机体免疫力作用。研究显示,蓝莓具有良好的护肝作用,逆转肝纤维化[12],并且联合益生菌后能有效减轻肝脏炎性反应,改善肝细胞脂肪变性[13]。本实验拟采用混合游离脂肪酸体外诱导正常人肝细胞L-02脂肪变性,并通过蓝莓益生菌对IL-22表达的影响来探讨二者参与拮抗NAFLD的作用机制。
资料和方法
一、细胞株和实验动物
正常人肝细胞株L-02购自中国科学院上海细胞生物学研究所细胞库。Wistar大鼠,雄性,清洁级,体质量(180±20)g(购自贵州医科大学动物实验中心,合格证号:SCXK-(黔)2012-0001),分笼普通饲料喂养,自由饮食,用于制备蓝莓益生菌血清。
二、蓝莓、益生菌
选用贵州麻江兔眼园兰蓝莓,-20℃冻存,临用时解冻提取原浆,其成分含量包括花青素、微量元素、类黄酮、维生素等[14];益生菌干片(婴儿双歧杆菌、动物双歧杆菌、乳杆菌:中国微生物菌种保藏管理委员会普通微生物中心)。
三、主要试剂和仪器
DMEM 培养基(美国Gibco,批号:C11995500B),胎牛血清(美国Gibco, 批号:10099141),青链霉素(美国Gibco, 批号:15140122),0.25%含EDTA 胰蛋白酶(美国Gibco, 批号:25200-056),油酸(美国Sigma,批号:SLBM2519V);棕榈酸(美国Sigma,批号:SLBM2077V),TG试剂盒(南京建成生物工程研究所,批号:F001-1);anti-IL22RA (英国Abcam,批号:ab5984);β-actin (美国Immuno Way,批号:YT0099);DAPI(中国solarbio,批号:D8200);标记FITC荧光羊抗兔IgG(北京中杉金桥,批号:121704);细胞活性检测试剂(cell counting kit CCK8 日本同仁化学研究所,批号:SC-45063);β-actin(上海生工生物工程技术服务有限公司,批号:B661102)、IL-22引物(上海生工生物工程技术服务有限公司,批号:10441578);Maxima SYBR Green/ROX qPCR预混液(美国Thermo Scientific,批号:00330632);ViiA7 Real-time PCR System(美国;Applied Biosystems);EPS-601电泳仪(美国;Amersham);SynergyH4多功能酶标仪(美国;biotek);显微镜图像采集系统Olympus BX41(日本;OLYMPUS);激光扫描共聚焦显微镜(德国;Leica公司)。
四、蓝莓益生菌原液制备
益生菌干片磨至粉末状后加入蓝莓原浆中混匀,使益生菌含量达108CFU/mL[15]。
五、蓝莓益生菌血清制备
Wistar大鼠随机分成4组:0.9%氯化钠溶液对照组、蓝莓益生菌低剂量组(0.25 mL/100 g)、蓝莓益生菌中剂量组(0.5 mL/100 g)、蓝莓益生菌高剂量组(1 mL/100 g)[16]。分别灌胃5 d,2次/d,于末次灌胃后2 h再重复灌胃1次,第2次灌胃1 h后股动脉取血。3000 r/min离心20 min,混匀同组大鼠血清,50℃水浴30 min灭活补体,0.22 μm微孔滤器过滤除菌,-20℃保存备用。
六、细胞培养与传代
正常人肝细胞株L-02用培养液(90%DMEM培养液+10%胎牛血清+1%青链霉素+1%非必需氨基酸)37 ℃、体积分数为0.05的CO2恒温培养箱中培养,细胞呈贴壁生长,24 h更换培养液,80%~90%细胞融合度时,用0.25%含EDTA胰蛋白酶收集细胞并传代。
七、肝细胞脂肪变性模型建立
L-02细胞用含1 mmol/L的混合游离脂肪酸[(油酸(oleic acid,OA):软脂酸(palmitic acid,PA)=2∶1)]诱导L-02细胞脂肪变性[17]。
八、实验分组
将细胞分为正常组、模型组、蓝莓益生菌低、中、高剂量血清组。将L-02细胞以1×105个/mL细胞密度接种于六孔板中,37 ℃、体积分数为0.05的CO2恒温培养箱中培养24 h后弃去培养基。正常组与模型组加入含0.9%氯化钠溶液血清培养基,蓝莓益生菌低、中、高剂量血清组分别添加含10%相对应血清的培养基。各组细胞提前24 h采用相应血清进行干预,然后除正常组外,各组添加1 mmol/L的混合脂肪酸培养24 h。
九、CCK8检测细胞存活率
将L-02细胞100 μL以1×105个/mL细胞密度接种在96孔培养板中,37℃、体积分数为0.05的CO2恒温培养箱中培养24 h后弃去培养基,每组设6个平行孔,按上述方法分组处理72 h,每孔加入10 μL CCK8于37℃、体积分数为0.05的CO2恒温培养箱中孵育2 h,在450 nm读取吸光度。以对照组细胞增殖活力为100%,其他各组细胞增殖活力=处理组(450)/空白组(450)×100%。
十、油红O染色观察细胞内脂滴变化
将细胞接种于六孔板内,同时放入玻片,制作细胞爬片,分组处理细胞72 h,PBS轻洗细胞爬片3次,4%多聚甲醛固定15 min,PBS轻洗3次,加油红O染液避光染色30 min,60%异丙醇洗去多余染液,苏木素染核10 s,蒸馏水轻洗3次,甘油明胶封片。显微镜下观察细胞内脂滴情况。
十一、细胞内TG水平测定
胰蛋白酶消化细胞,1000 r/min,离心5 min收集细胞,经反复冻融,充分裂解细胞,3000 r/min,离心10 min,取上清液,采用TG试剂盒检测TG,BCA蛋白浓度测定试剂盒检测总蛋白含量,结果表示为每克细胞总蛋白含量中所含的TG量。
十二、免疫荧光法检测IL-22表达
以1×105个/mL细胞密度接种于六孔板中,放入玻片,制作细胞爬片,分组处理细胞72 h,PBS轻洗细胞爬片,4%多聚甲醛固定,0.5%Triton X-100室温通透,3% H2O2孵育30 min,1%BSA室温封闭,滴加浓度为1∶100的一抗1 mL,4 ℃孵育过夜,次日予冷PBST轻洗后滴加浓度为1∶100标记FITC二抗1 mL,避光孵育2 h,冷PBST轻洗后加入0.5 μg/mL DAPI避光孵育,激光扫描共聚焦显微镜下观察并采图。
十三、RT-PCR检测IL-22基因表达
以1×105个/mL细胞密度接种于六孔板中,按上述方法进行分组处理72 h后,弃培养液,PBS轻洗2次,每孔加入500 μL Trizol提取总RNA。RNA反转录合成cDNA,按试剂盒说明书操作。所用引物按参考文献设计并在GenBank 进行核对。β-actin 引物:正义链,5′-CCTGGCACCCAGCACAAT-3′;反义链,5′-GGGCCGGACTCGTCATAC -3′。IL-22引物:正义链,5′-GCTTGACAAGTCCAACTT-CCA-3′;反义链,5′-GCTCACTCATACTGACT-CCGT-3′。PCR反应体系(50 μL):2×Es Taq MasterMix 25 μL、正向引物2 μL、反向引物2 μL、模板DNA 2 μL、去核糖核酸酶水19 μL 。反应条件:预变性,94 ℃、2 min;变性,94 ℃、30 s;退火,55 ℃、30 s;延伸,72 ℃、30 s,变性、退火、延伸经35个循环;终延伸,72 ℃、2 min 。qRT-PCR 反应体系(20 μL):SYBR Green 10 μL、ddH2O 6 μL、引物混合物2 μL、模板cDNA 2 μL。反应条件:第1阶段,50 ℃、2 min;第2阶段,95 ℃、10 min;第3 阶段,95 ℃、15 s,60 ℃、1 min,40个循环。结果判定:通过β-actin作为内参照,琼脂糖电泳检测扩增片段;同时比较目的基因与内参基因的ct值差异,从而对上述基因在各组中的表达进行相对定量。
十四、Western印迹测定IL-22的蛋白表达
细胞按前述分组方法接种于六孔板中,培养72 h后收集细胞,每孔加入RIPA:PMSF(1:99)150 μL裂解液,抗原蛋白提取后进行蛋白含量测定,取蛋白质样品30 μg,计算蛋白上样量,8%SDS-PAGE凝胶电泳、转膜、封闭、用IL-22抗体(1∶1000)4 ℃孵育过夜,二抗(1∶20 000)避光孵育2 h,ECL曝光显影,Gel Doc EQ凝胶成像仪扫描,ImageJ软件分析结果。
十五、统计学处理
结 果
一、L-02细胞脂肪变性模型建立
正常组细胞可见细胞形态正常,胞质中无脂滴沉积;用含1 mmol/L的混合游离脂肪酸(OA∶PA=2∶1)诱导L-02细胞脂肪变性24 h后,光学显微镜下观察到模型组L-02细胞形状不规则或成椭圆形,胞质内可见大量红色脂滴,经不同剂量的蓝莓益生菌血清干预后,胞质内的脂滴较模型组明显减少,且在蓝莓益生菌高剂量血清组中减少更为显著,但低、中剂量血清组间相比脂滴减少无显著差异,见图1。
二、CCK8检测各组L-02细胞增殖活力
设定正常对照组细胞增殖活力为100%,模型组细胞增殖活力为96.4%,蓝莓益生菌低剂量血清组细胞增殖活力为92.5%,蓝莓益生菌中剂量血清组细胞增殖活力为91.3%,蓝莓益生菌高剂量血清组细胞增殖活力为93.2%。与正常组相比,模型组、蓝莓益生菌低、中、高剂量血清组细胞增殖活力差异无统计学意义(P>0.05)。

图1 各组L-02细胞光镜下形态(油红O染色,×200)
三、不同剂量蓝莓益生菌血清对FFA诱导L-02细胞脂肪变性后细胞内TG含量影响
与正常组比较,模型组的TG含量明显增加(P<0.01);与模型组比较,蓝莓益生菌低、中、高剂量血清组的TG含量较模型组明显降低(P<0.01);与低、中剂量组比较,高剂量血清组TG明显下降(P<0.01),见图2。
四、激光共聚焦观察各组细胞IL-22表达
正常组细胞轮廓清晰,模型组细胞轮廓消失,胞内绿色荧光强度较正常组明显减弱,经不同剂量蓝莓益生菌血清干预后,细胞内的绿色荧光强度较模型组明显增强,其中蓝莓益生菌高剂量血清组的绿色荧光强度较低、中剂量组增强明显,见图3。

图2 各组L-02细胞TG含量检测

图3 各组L-02细胞免疫荧光观察IL-22表达(×40)
五、RT-PCR检测IL22基因表达
(一)琼脂糖电泳检测扩增产物与正常组比较,模型组IL-22表达较明显减少,蓝莓益生菌低、中、高剂量血清组IL-22表达较模型组增加,且高剂量血清组增加更为显著,见图4。
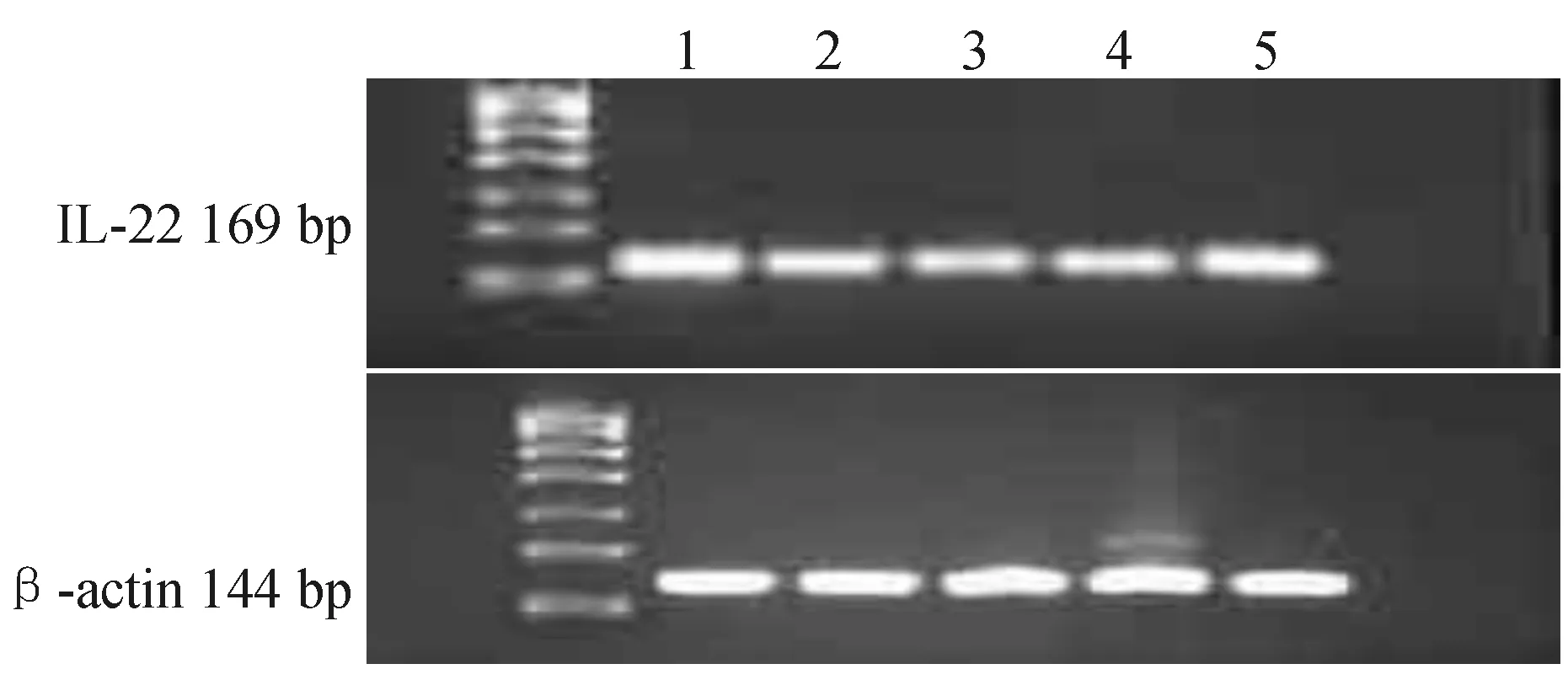
注:1. 正常组;2. 模型组;3. 蓝莓益生菌低剂量组;4. 蓝莓益生菌中剂量组;5. 蓝莓益生菌高剂量组
图4各组L-02细胞cDNA扩增产物
(二)qRT-PCR检测IL-22 mRNA表达与正常组相比,模型组IL-22 mRNA表达量明显降低(P=0.000),与模型组比较,蓝莓益生菌低、中、高剂量血清组IL-22mRNA表达较模型组增加(P=0.000),且高剂量血清组增加更为显著(P=0.000),但低、中剂量组之间差异无统计学意义(P=0.382),见图5。
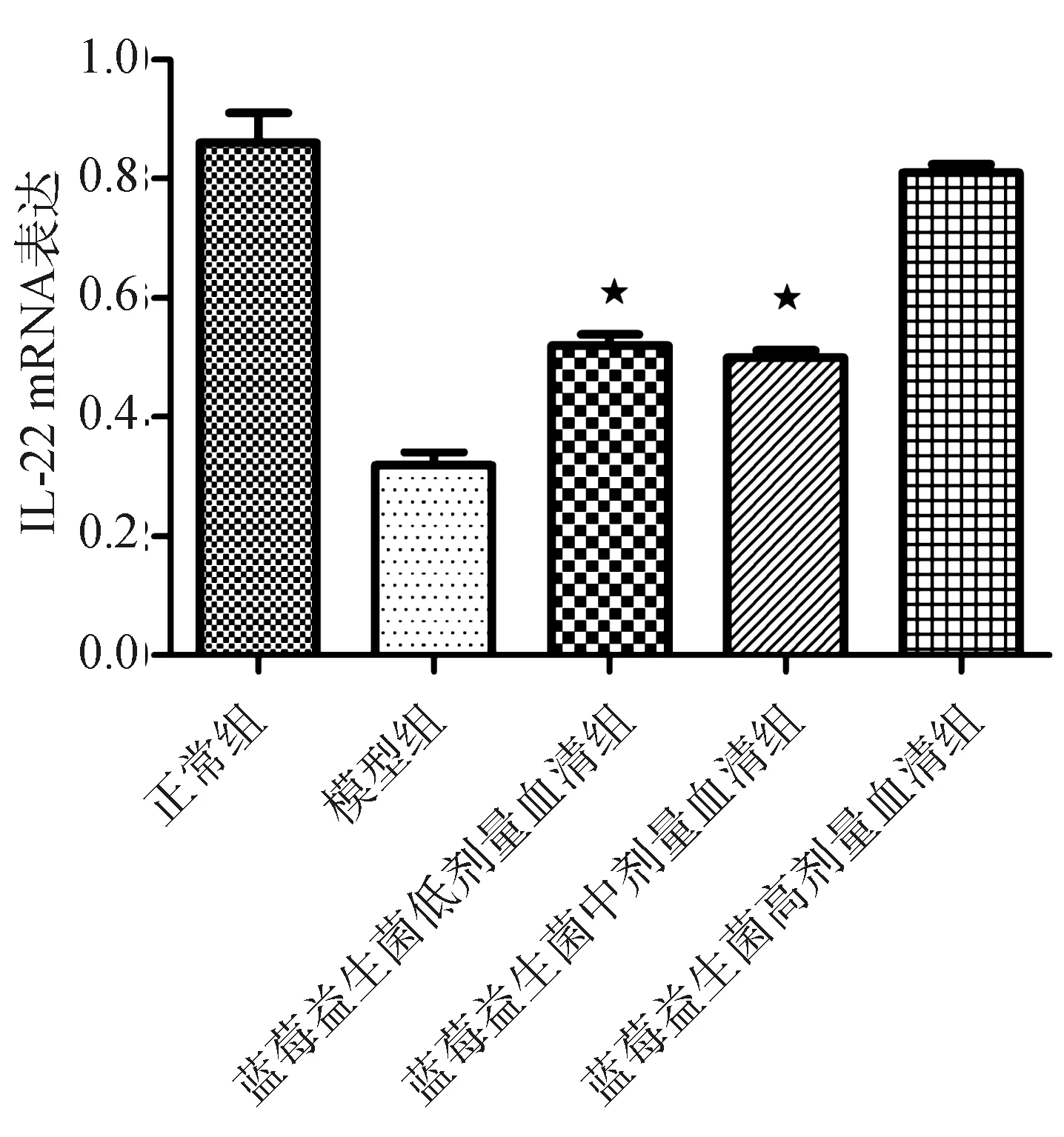
图5 各组L-02细胞IL-22 mRNA表达
六、Western印迹检测IL-22蛋白表达
与正常组相比,模型组IL-22蛋白表达量明显降低(P=0.000),与模型组比较,蓝莓益生菌低、中、高剂量血清组表达较模型组增加(P=0.000),且高剂量血清组增加更为显著(P=0.000),见图6,图7。

注:1. 正常组;2. 模型组;3. 蓝莓益生菌低剂量血清组;4. 蓝莓益生菌中剂量血清组;5. 蓝莓益生菌高剂量血清组
图6各组IL-22蛋白表达

图7 各组IL-22蛋白相对表达量
讨 论
近年来免疫炎性反应对NAFLD的影响逐渐受到重视,肝内多种具有免疫功能的细胞(如KC、NK)受到细菌、病毒、药物或其他一些代谢产物(如LPS)刺激后,可通过LPS/TLR4信号通路下游的衔接分子MyD88诱导促炎因子(如IL-21、CXCL-10)和抗炎因子(如IL-10)的产生[18]。促炎因子激活相关信号通路上调胆固醇调节元件蛋白-1c等具有脂肪合成功能的基因表达,导致肝细胞内的TG和胆固醇聚集,而发生NAFLD。IL-22是抗炎因子IL-10家族成员中的一员,与IL-10在结构上存在明确的相关性[19],可由多种细胞分泌(如NK细胞、Th17、Th22等),在控制细菌感染、稳定内环境和组织修复中起到重要作用[20]。有学者发现,IL-22在多种肝脏疾病中起到保护作用,是重要的护肝因子,主要通过其受体IL-22RA1发挥生物作用[7,21]。Yang等[22]的研究显示,IL-22可通过激活STAT3通路下调TG合成的相关基因改善因肥胖所致的脂肪肝。Xiao等[23]通过IL-22治疗乙醇诱导的肝损伤的研究发现,IL-22可通过其受体IL-22RA1激活JAK1/STAT3信号通路,下调FATP表达,达到改善肝细胞脂肪变性的作用。综上,IL-22对多种肝脏疾病有保护作用,由IL-22参与拮抗NAFLD,其作用机制可能是通过调控JAK1/STAT3信号通路而实现。
目前临床上尚无针对NAFLD的特效药物,益生菌作为肠道微生态调节剂可用于NALFD的治疗,以改善肠道微生态环境,减轻内毒素血症,从而减轻肝细胞炎性反应,达到治疗非酒精性脂肪性肝病的目的[11]。相关研究发现,蓝莓富含花青素、类黄酮及多酚类等物质具有抗氧化、抗炎、抗肿瘤、调节免疫、降血脂等功效[24-25],且蓝莓中的花青素能激活免疫系统,使免疫球蛋白不受自由基的侵害,激活巨噬细胞,增强人体的免疫力。蓝莓对急性酒精性脂肪肝有保护作用[26],其机制可能是蓝莓能有效抑制TNF-α,下调SREBP-1c的表达,合理改善脂代谢,减少脂质沉积于肝脏。研究发现,蓝莓对肝星状细胞活性也有抑制作用,能有效减少炎性介质的产生,达到逆转肝纤维化的功效[12]。陆爽等[16]通过应用高剂量的蓝莓血清能有效促进HSC-T6细胞凋亡,改善肝纤维化。蓝莓对益生菌的生长有促进作用,同时,益生菌能增强蓝莓的生物活性,二者有协调作用[27]。将蓝莓与益生菌联合,可减轻炎性因子对肝细胞损伤,同时能调节脂质代谢,减少肝细胞脂肪变[13,28]。
研究发现,不同剂量的蓝莓益生菌血清能显著改善混合游离脂肪酸(油酸:软脂酸)处理的肝细胞脂肪变性程度。油红染色后可见模型组胞质内有大量红色脂滴,而蓝莓益生菌低、中、高剂量组胞质内的脂滴较模型组明显减少,其中高剂量组的脂滴减少更为显著,TG检测后发现,经不同剂量蓝莓益生菌血清干预后TG较模型组降低,而高剂量血清组的TG降低最为显著,结合CCK8发现,不同剂量的蓝莓益生菌血清干预后与模型组相比,L-02细胞活性无明显变化,表明所使用浓度范围的血清对L-02细胞活性无影响,排除了各组TG差异是由细胞数量不同所致的可能性。通过不同的方法对IL-22进行检测发现蓝莓益生菌高剂量血清组的IL-22表达均明显高于模型组、蓝莓益生菌低、中剂量血清组,但低、中剂量血清组间的差异不大。由此可见,IL-22变化随着血清剂量升高而呈现高表达,结合TG及油红O染色,说明蓝莓益生菌的联合应用,能显著改善肝细胞脂肪变性程度,并能增强IL-22表达。Radaeva等发现[29],IL-22激活STAT3信号通路可上调抗凋亡基因、抗氧化应激基因的表达,下调脂肪生成基因表达(如SREBP-1c),已达到改善脂肪肝的目的。因此,推测蓝莓益生菌增强IL-22表达拮抗NAFLD的作用机制系IL-22激活JAK1/STAT3信号通路,下调三酰甘油合成相关基因表达,达到改善NAFLD的目的。
由于蓝莓益生菌血清成分复杂,本文仅初步探讨其通过增强IL-22表达推测其参与拮抗NAFLD的作用,具体血清中的哪种成分发挥了作用,是否还存在其他的作用机制,还有待更深层次的研究。
[1]Loomba R, Sanyal AJ. The global NAFLD epidemic. Nat Rev Gastroenterol Hepatol, 2013, 10:686-690.
[2]Milic S, Stimac D. Nonalcoholic fatty liver disease/steatohepatitis: epidemiology, pathogenesis, clinical presentation and treatment. Dig Dis,2012,30:158-162.
[3]Tiniakos DG, Vos MB, Brunt EM. Nonalcoholic fatty liver disease: pathology and pathogenesis. Annu Rev Pathol,2010,5:145-171.
[4]Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology, 2010,52:1836-1846.
[5]Iyer SS, Cheng G. Role of interleukin 10 transcriptional regulation in inflammation and autoimmune disease. Crit Rev Immunol,2012,32:23-63.
[6]Mastelic B, do Rosario AP, Veldhoen M, et al. IL-22 protects against liver pathology and lethality of an experimental blood-stage malaria infection. Front Immunol,2012,3:85.
[7]Chestovich PJ, Uchida Y, Chang W, et al. Interleukin-22: implications for liver ischemia-reperfusion injury. Transplantation, 2012, 93: 485-492.
[8]Gao B, Sung H, Park O, et al. Interleukin-22 treatment ameliorates alcoholic liver injury in a murine model of chronic-binge ethanol feeding: Role of STAT3. Hepatology,2010,52: 1291-1300.
[9]Chalasani N, Younossi Z, Lavine JE, et al. Diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology,2012,55:2005-2023.
[10]Wong VW, Won GL, Chim AM, et al. Treatment of nonalcoholic steatohepatitis with probiotics. A proof-of-concept study. Ann Hepatol,2013,12:256-262.
[11]Eslamparast T, Poustchi H, Zamani F, et al. Synbiotic supplementation in nonalcoholic fatty liver disease: a randomized, double-blind, placebo-controlled pilot study. Am J Clin Nutr,2014,99:535-542.
[12]Wang Y, Cheng M, Zhang B, et al. Dietary supplementation of blueberry juice enhances hepatic expression of metallothionein and attenuates liver fibrosis in rats. PLoS One,2013,8: e58659.
[13]Ren T, Huang C, Cheng M. Dietary blueberry and bifidobacteria attenuate nonalcoholic fatty liver disease in rats by affecting SIRT1-Mediated signaling pathway. Oxid Med Cell Longev,2014,2014:465059.
[14]文光琴,聂飞,方品武.蓝莓果实理化成分含量比较分析与功能评价.北方园艺,2012:27-30.
[15]Osman N, Adawi D, Ahrné S, et al. Endotoxin-and D-galactosamine-induced liver injury improved by the administration of Lactobacillus, Bifidobacterium and blueberry. Dig Liver Dis,2007,39:849-856.
[16]陆爽, 程明亮, 杨德猛, 等. 蓝莓对大鼠肝星状细胞T6凋亡及Bcl-2、Bax表达的影响.中华医学杂志,2015,95:2560-2564.
[17]殷锦锦, 唐外娇, 曾璐, 等.人肝细胞系L-02单纯肝脂肪变性细胞模型的建立与应用.南方医科大学学报,2014,34:837-842.
[18]Kolanowski ST, Dieker MC, Lissenberg-Thunnissen SN, et al. TLR4-mediated pro-inflammatory dendritic cell differentiation in humans requires the combined action of MyD88 and TRIF. Innate Immun,2014,20:423-430.
[19]Sabat R. IL-10 family of cytokines. Cytokine Growth Factor Rev, 2010,21:315-324.
[20]Pan CX, Tang J, Wang XY, et al. Role of Interleukin-22 in liver diseases. Inflamm Res,2014, 63: 519-525.
[21]Mastelic B, do Rosario AP, Veldhoen M, et al. IL-22 protects against liver pathology and lethality of an experimental blood-stage malaria infection. Front Immunol,2012,3:85.
[22]Yang L, Zhang Y, Wang L, et al. Amelioration of high fat diet induced liver lipogenesis and hepatic steatosis by interleukin-22. J Hepatol,2010,53:339-347.
[23]Xiao NK, De CF, Mathews S, et al. Hepatoprotective and anti-fibrotic functions of interleukin-22: Therapeutic potential for the treatment of alcoholic liver disease. J Gastroenterol Hepatol,2013,28:56-60.
[24]Fernandes I, Marques F, Freitas VD, et al. Antioxidant and anti-proliferative properties of methylated metabolites of anthocyanins. Food Chem,2013,141:2923-2933.
[25]Vendrame S, Daugherty A, Kristo AS, et al. Wild blueberry(Vaccinium angustifolium) consumption improves inflammatory status in the obese Zucker rat model of the metabolic syndrome. J Nutr Biochem,2013,24:1508-1512.
[26]赵雪珂, 吴荣敏, 姚玉梅,等. 蓝莓对小鼠急性酒精性脂肪肝TNF-α-R1和SREBP-1c影响的初步研究.重庆医科大学学报,2015,20:43-46.
[27]刘奕炜,周方,郝建新,等. 蓝莓汁及其提取物对嗜酸乳杆菌NCFM体外生长的影响.中国乳品工业,2013,41:13-16.
[28]Branning C, Hakansson A, Ahrne S, et al. Blueberry husks and multi-strain probiotics affect clolnic fermentation in rats.Br J Nutr,2009,101:859-870.
[29]Radaeva S, Sun R, Pan HN, et al. Interleukin 22 (IL-22) plays a protective role in T cell-mediated murine hepatitis: IL-22 is a survival factor for hepatocytes via STAT3 activation. Hepatology, 2004, 39: 1332-1342.
(本文编辑:钱燕)
Expression of IL-22 in hepatic steatosis intervened by blueberry probiotic serum
ZHUJuan-juan,CHENGMing-liang.
DepartmentofInfection,thehospitalaffiliatedofGuiZhoumedicaluniversityCorrespondingauthor:
ObjectiveTo investigate mechanism of blueberry probiotic in treating nonalcoholic fatty liver disease (NAFLD) via affecting expression of interlukin-22 (IL-22). MethodsSerum from rats treated with saline, and low, medium and high dose of blueberry probiotic by gavage were collected, respectively. Cell steatosis model was constructed by stimulating normal liver cell line L-02 with free fatty acid (FFA). Serum from different dose blueberry probiotic treated rats were added into cell culture medium as 10% concentration for the L-02 steatosis model, respectively. Intracellular lipid deposition was observed by oil red O staining and level of triglyceride (TG) was quantitatively determined. Gene expression of IL-22 was detected by reverse transcription polymerase chain reaction (RT-PCR) and protein expression of IL-22 was detected by western blot and immunofluorescence. ResultsAfter 24-hour FFA stimulation in L-02 cell with serum, a pile of lipid deposition could be observed and TG level was significantly increased (P=0.000), while mRNA and protein levels of IL-22 were decreased (P=0.000). In blueberry probiotic serum groups, TG levels and lipid depositions were negatively correlated with the dose of blueberry probiotic. In high-dose blueberry probiotic serum group, expression of IL-22 was significantly enhanced comparing with the other groups (P=0.000). However, there was no significant difference in expression of IL-22 between the low- and medium-dose serum groups (P>0.05). ConclusionBlueberry probiotic might play a role in treatment of NAFLD by enhancing the expression of IL-22.
Blueberry probiotic serum; Hepatocyte; Steatosis; Interleukin-22
贵州省科技厅社会攻关(黔科合SY[2010]3017号);黔东南苗族侗族自治州林业局科研基金(ZLYJZFCG-2012-7)。
550001贵阳贵州医科大学附属医院感染科
程明亮,Email: chengml@21cn.com
2016-05-12)
