双歧杆菌对高脂饮食诱导非酒精性脂肪性肝病大鼠血脂代谢的影响
2016-10-26胡迎宾郭秋霞
胡迎宾 彭 娜 郭秋霞
(华中科技大学同济医学院附属普爱医院消化内科,湖北 武汉 430030)
双歧杆菌对高脂饮食诱导非酒精性脂肪性肝病大鼠血脂代谢的影响
胡迎宾彭娜郭秋霞
(华中科技大学同济医学院附属普爱医院消化内科,湖北武汉430030)
目的探讨双歧杆菌对高脂饮食诱导非酒精性脂肪性肝病大鼠血脂代谢的影响。 方法将45只雄性SD大鼠随机等分为对照组、模型组和治疗组。对照组喂以普通饲料,模型组喂以高脂饲料,治疗组喂以高脂饲料和双歧杆菌。6 w后比较各组大鼠肝指数和肝组织学改变,检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)和甘油三酯(TG)的水平以及肝总脂肪(HLs)含量,采用荧光实时定量RT-PCR测定禁食诱导脂肪因子(FIAF)mRNA的表达。 结果模型组肝指数和肝组织脂肪变性程度均显著高于对照组(P<0.05);而治疗组肝指数和肝组织脂肪变性程度均显著低于模型组(P<0.05)。与对照组比较,模型组ALT、AST、TC、TG和HLs水平显著升高(P<0.05);与模型组比较,治疗组ALT、AST、TC、TG和HLs水平显著降低(P<0.05)。与对照组比较,模型组FIAF mRNA的表达显著升高(P<0.05);与模型组比较,治疗组FIAF mRNA的表达显著降低(P<0.05)。 结论双歧杆菌能够降低NAFLD大鼠的血脂水平,减少肝脏组织中脂肪的沉积,改善肝脏的炎症反应,其机制可能与调节脂质的摄入和抑制FIAF基因的表达有关。
双歧杆菌;非酒精性脂肪性肝病;血脂代谢;禁食诱导脂肪因子
肠道内的微生物群落决定从食物中获得能量的效率、并参与饮食结构变化所导致的代谢活动改变,尤其是在对于如高脂饮食这样的环境压力因素所做出的回应〔1〕。非酒精性脂肪性肝病(NAFLD)是与代谢综合征密切相关的肝脏表现,以异常脂肪积累为核心的代谢性疾病。研究表明,肠道微生物群与血脂之间有着千丝万缕的联系,可能具有调节血脂的作用〔2,3〕。作为肠道内最重要的优势菌群之一,双歧杆菌是否能够通过调节血脂水平,从而影响NAFLD的发生发展尚不清楚。在本研究中我们通过高脂饮食喂养造成大鼠NAFLD模型,应用双歧杆菌进行干预治疗,观察其对肝功能和血脂代谢的影响,为NAFLD的防治提供新的思路。
1 材料与方法
1.1实验动物清洁级雄性SD大鼠45只,体重160~180 g,购于华中科技大学同济医学院实验动物学部。在温度20℃~22℃,湿度50%~60%,明暗周期12 h环境中饲养1 w后开始实验。
1.2实验试剂口服双歧杆菌活菌散剂由丽珠集团丽珠制药厂生产(批准文号:国药准字S20040081,规格:每袋1.0 g)。Trizol购自美国Invitrogen公司,定量RT-PCR 试剂盒购自日本TaKaRa公司。
1.3动物分组、造模及处理将SD大鼠随机等分为对照组、模型组和治疗组。对照组喂以普通饲料和蒸馏水灌胃,模型组喂以高脂饲料(82%的普通饲料+8.3%的蛋黄粉+9%猪油+0.5%胆固醇+0.2%胆酸钠)和蒸馏水灌胃,治疗组喂以高脂饲料和溶于蒸馏水的双歧杆菌活菌散剂(1.25 g·kg-1·d-1)灌胃。所有大鼠于6 w后处死,留取血清,肝组织和小肠组织标本备用。
1.4肝指数测定取大鼠肝脏,用等渗盐水洗去血渍,滤纸吸干并称重,计算肝指数。肝指数=(肝湿重/体质量)×100%。肝脏总脂肪(HLs)含量参照文献〔4〕的测定方法。
1.5肝组织病理学检查按常规方法进行苏木素-伊红(HE)染色,显微镜下观察肝脏组织学改变情况。肝组织脂肪变性程度按脂肪变肝细胞占全部肝细胞的范围分级:F0级:无脂肪变;F1级:30%以下肝细胞脂肪变;F2级,30%~60%肝细胞脂肪变;F3级,60%以上肝细胞脂肪变〔5〕。所有切片均由有经验的病理科医师盲法阅片。
1.6血清生物化学指标测定采用全自动生物化学分析仪测定血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)和甘油三酯(TG)的含量。
1.7荧光实时定量RT-PCR测定禁食诱导脂肪因子(FIAF)基因的表达①RNA提取:取100 mg小肠组织采用Trizol试剂盒提取组织总RNA,通过Tecan infinite M200 PRO多功能酶标仪测定RNA纯度和浓度,以质量分数为1.5%琼脂糖凝胶电泳检测RNA 完整性。②反转录:依据说明书取总RNA 1 μg,5倍反转录缓冲液2 μl,dNTP 0.5 μl,反转录随机引物0.5 μl,反转录酶0.25 μl,RNA酶抑制剂0.25 μl,无RNA酶去离子水补至10 μl。42℃ 15 min,95℃ 2 min,-20℃保存待用。③荧光定量PCR:PCR引物由生工生物工程(上海)股份有限公司合成。FIAF上游引物:5′-CTCTGGGATCTCCACCATTT-3′,下游引物:5′-TTGGGGATCTCCGAAGCCAT-3′; 18 S rRNA上游引物:5′-TACCGCAGCTAGGAATAATGG-3′,下游引物:5′-CGGAACTACGACGGTAT-3′。按说明书以反转录合成的cDNA为模板,然后用SYBR Green作为荧光标记物,在LightCycler荧光实时定量PCR仪(Roche公司,德国)上进行PCR反应。反应体系25 μl,反应条件95℃ 10 min 预变性,然后95℃ 10 s,55℃ 5 s,72℃ 10 s,40个循环。通过融解曲线分析和电泳确定目的条带,结果通过LightCycler软件分析,以18 S rRNA 表达作为内参照,FIAF表达与18 S rRNA表达的比值作为FIAF基因的相对表达量。
1.8统计学方法应用SPSS10.0统计软件进行方差分析、Student-Newman-Keuls检验及χ2检验。
2 结 果
2.1各组大鼠一般情况对照组,模型组和治疗组大鼠的初始体重分别为:(171.14±6.53)g,(169.37±5.86)g和(168.71±5.91)g,差异无统计学意义(P>0.05)。至第6周末,模型组大鼠体重和肝指数均较对照组显著升高(P<0.05);治疗组大鼠体质量和肝指数均较模型组显著降低(P<0.05),见表1。实验过程中各组大鼠均无死亡。
表1 第6周末各组大鼠体重和肝指数比较±s,n=15)
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05,下表同
2.2各组大鼠血清生化指标和HLs含量比较与对照组比较,模型组血清ALT、AST、TC、TG和HLs含量均明显升高(P<0.05);与模型组比较,治疗组血清ALT、AST、TC、TG和HLs含量均明显降低(P<0.05),见表2。

表2 各组大鼠血清生化指标和HLs含量的比较
2.3各组大鼠肝组织病理学变化HE染色见对照组大鼠肝小叶结构完整,肝索排列整齐,肝细胞大小均匀,无变性坏死;模型组大鼠肝细胞广泛脂肪变性;治疗组大鼠肝细胞脂肪变性较模型组明显减轻,见图1。与模型组比较,治疗组脂肪变性分级有显著改善(χ2=28.56,P<0.05)。
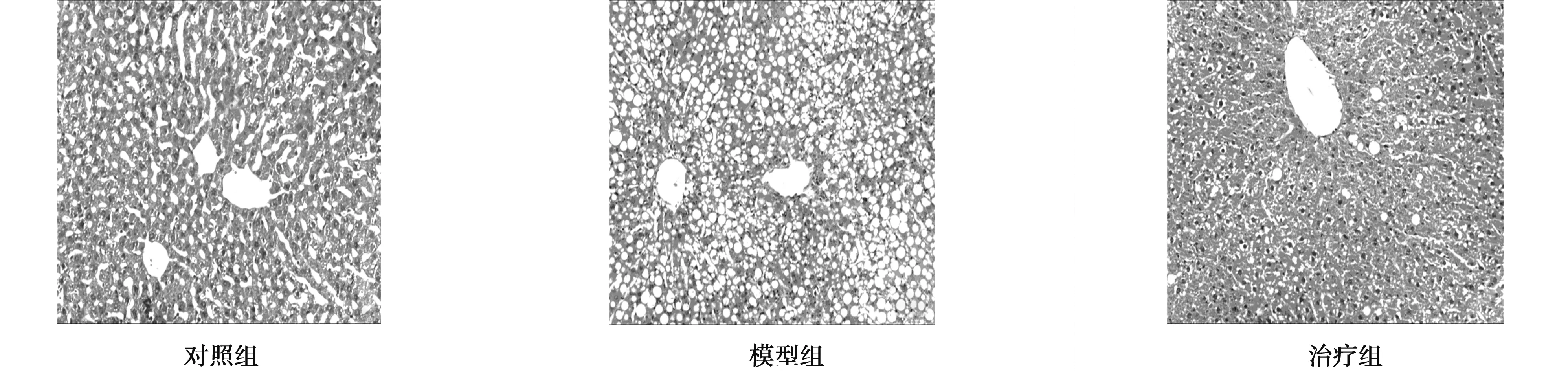
图1 各组大鼠肝组织HE染色结果(×100)
2.4各组大鼠FIAF mRNA的表达与对照组(0.85±0.14)比较,模型组FIAF mRNA的表达明显升高(1.27±0.21,P<0.05);与模型组比较,治疗组FIAF mRNA的表达明显降低(1.11±0.19,P<0.05)。
3 讨 论
益生菌是肠道内有益的活性微生物,它们通过改善宿主微生态平衡,影响宿主能量和物质代谢〔6〕,这为研究NAFLD等代谢性疾病提供了新的视角。
在本研究中,我们通过高脂饮食增加大鼠脂质摄入,经肠道吸收后入门静脉,6 w后发现模型组中TC和TG水平显著增加。而高水平的脂质一方面可以在肝中沉积,即模型组中HLs含量增加;另外一方面产生脂毒性,提升氧化应激水平,导致肝细胞膜损害,即模型组中ALT和AST水平升高。但是,通过双歧杆菌干预后,我们发现无论是血脂水平和HLs含量,还是ALT和AST水平都显著减低。双歧杆菌对血脂代谢的影响有以下两种途径:一是双歧杆菌产生结合胆汁酸水解酶,将结合胆汁酸转变成游离胆汁酸,从而影响胆汁酸的肠肝循环,促使肝脏利用TC合成胆汁酸增加,实现了降低血TC的作用〔7〕;二是双歧杆菌能将未消化吸收的碳水化合物酵解成短链脂肪酸,抑制肝脏脂肪合成酶的活性,从而使血TG水平降低〔8〕。此外,双歧杆菌能够保护肠道黏膜屏障,减轻内毒素血症,避免肝细胞发生炎症损伤〔9〕。
FIAF又被称为血管生成素样蛋白4,它以寡聚体、糖基化及各种亚型的形式存在,经细胞分泌后可直接进入血液循环,在脂肪代谢方面具有重要作用。Koliwad等〔10〕研究证实,FIAF通过使活化的脂蛋白脂肪酶(LPL)不可逆地转化为非活化的LPL单体,抑制LPL的活性而减少血液循环血中TG的清除。在本研究中,我们发现双歧杆菌能够显著降低FIAF基因的表达,同时血液中TG水平也随之降低,可能与LPL活性增加有关。进一步研究证实,无菌小鼠由于提高了FAIF基因的表达水平,通过诱导过氧化物酶体增殖物激活受体γ共激活因子(PGC)-1α的表达,启动了脂肪氧化的代谢途径,增加了脂肪的消耗;而将高脂饮食饲养小鼠的微生物群植入无菌小鼠体内后,发现肠道内FAIF基因的表达受到抑制,血脂的水平明显增加并贮存在肝脏和脂肪组织内〔11〕。由此可见,双歧杆菌可能在减少脂肪的储存过程中发挥了重要作用。
一方面,补充益生菌双歧杆菌可以改善NAFLD大鼠的血脂代谢,另一方面,肠道微生物对膳食脂肪也会做出相应的反应。高脂饮食通过改变肠道微生物群的生存环境,使双歧杆菌、乳酸杆菌和肠球菌等肠道正常菌群数量明显减少,肠杆菌数量则相对增多,从而出现菌群失调或小肠细菌过度生长(SIBO)〔12〕。研究发现,SIBO可以改变肠细胞紧密连接,增加肠道黏膜通透性,从而增加脂质的摄入和参与炎症反应的发生〔13〕。在本研究中,我们也证实高脂饮食诱导的模型组比普通饮食的对照组有更明显的血脂代谢紊乱和炎症损害。所以,高脂饮食可以引起肠道微生态失衡,进而肠道微生物群失调促进血脂代谢异常,提示肠道微生物群在NAFLD的发生发展中起着重要的作用。综上,双歧杆菌能够降低NAFLD大鼠的血脂水平,减少肝脏组织中脂肪的沉积,改善肝脏的炎症反应,其机制可能与调节脂质的摄入和抑制FIAF基因的表达有关。尽管益生菌通过维持肠道微生态的平衡,与NAFLD的发病机制有着密切的关联性,但是益生菌抵御疾病形成而提供的保护作用仍然值得进一步深入探讨。
1Delzenne NM,Neyrinck AM,Bäckhed F,etal.Targeting gut microbiota in obesity:effects of prebiotics and probiotics〔J〕.Nat Rev Endocrinol,2011;4(7):639-46.
2Million M,Lagier JC,Yahav D,etal.Gut bacterial microbiota and obesity〔J〕.Clin Microbiol Infect,2013;19(4):305-13.
3余仁强,袁金玲,马路一,等.益生菌对肥胖大鼠血脂紊乱及胰岛素抵抗的影响〔J〕.中国当代儿科杂志,2013;15(12):1123-7.
4Folch J,Lees M,Sloane-Stanley GH.A simple method for the isolation and purification of total lipides from animal tissues〔J〕.J Biol Chem,1957;226(1):497-509.
5Singh R,Wang Y,Xiang Y,etal.Differential effects of JNK1 and JNK2 inhibition on murine steatohepatitis and insulin resistance〔J〕.Hepatology,2009;49(1):87-96.
6Burcelin R,Garidou L,Pomié C.Immuno-microbiota cross and talk:the new paradigm of metabolic diseases〔J〕.Semin Immunol,2012;24(1):67-74.
7Mouzaki M,Comelli EM,Arendt BM,etal.Intestinal microbiota in patients with nonalcoholic fatty liver disease〔J〕.Hepatology,2013;58(1):120-7.
8Puertollano E,Kolida S,Yaqoob P.Biological significance of short-chain fatty acid metabolism by the intestinal microbiome〔J〕.Curr Opin Clin Nutr Metab Care,2014;17(2):139-44.
9Esposito E,Iacono A,Bianco G,etal.Probiotics reduce the inflammatory response induced by a high-fat diet in the liver of young rats〔J〕.J Nutr,2009;139(5):905-11.
10Koliwad SK,Kuo T,Shipp LE,etal.Angiopoietin-like 4 (ANGPTL4,fasting-induced adipose factor) is a direct glucocorticoid receptor target and participates in glucocorticoid-regulated triglyceride metabolism〔J〕.J Biol Chem,2009;284(38):25593-601.
11Bäckhed F,Manchester JK,Semenkovich CF,etal.Mechanisms underlying the resistance to diet-induced obesity in germ-free mice〔J〕.Proc Natl Acad Sci U S A,2007;104(3):979-84.
12Carter BA,Karpen SJ.Intestinal failure-associated liver disease:management and treatment strategies past,present and future〔J〕.Semin Liver Dis,2007;27(3):251-8.
13Duseja A,Chawla YK.Obesity and NAFLD:the role of bacteria and microbiota〔J〕.Clin Liver Dis,2014;18(1):59-71.
〔2015-05-19修回〕
(编辑苑云杰/曹梦园)
武汉市卫生局临床科研资助项目(WX12C33)
胡迎宾(1978-),男,副主任医师,医学博士,主要从事慢性肝病及胃肠病的基础与临床研究。
R575.5;R589
A
1005-9202(2016)17-4169-03;doi:10.3969/j.issn.1005-9202.2016.17.015
