变应性鼻炎同位素标记相对和绝对定量蛋白质组学研究△
2016-10-26张健赵煜卢晓清吴建
张健 赵煜 卢晓清 吴建
变应性鼻炎同位素标记相对和绝对定量蛋白质组学研究△
张健赵煜卢晓清吴建
目的研究变应性鼻炎(AR)患者鼻黏膜蛋白质表达谱的变化,从蛋白质水平探讨AR的发病机制。方法采用同位素标记相对和绝对定量技术检测正常成年人及AR患者中鼻道鼻腔黏膜中的蛋白表达谱,每组4例,筛选差异表达蛋白。结果在AR患者鼻黏膜与正常人鼻黏膜之间筛选出大量差异表达蛋白。上调蛋白60个,主要包括嗜酸性粒细胞溶血磷脂酶(CLC)、普列克底物蛋白同源结构蛋白7(PLEKHA7)等;下调蛋白160个,主要包括脑恶性肿瘤缺失基因(DMBT1)、S100钙结合蛋白(S100A1)等。结论AR患者鼻黏膜与正常人鼻黏膜蛋白表达差异明显,其中CLC的上调与 DMBT1的下调可能参与鼻黏膜的炎症及免疫应答反应。(中国眼耳鼻喉科杂志,2016,16:309-312)
鼻炎,变应性;蛋白质组学;同位素标记相对和绝对定量
变应性鼻炎(allergic rhinitis,AR)是耳鼻咽喉头颈外科的常见病和多发病,主要表现为鼻痒、打喷嚏等,临床难以根治,多以控制鼻部症状为主。截至目前,其确切发病机制尚不清楚。本研究在前期应用基因芯片研究AR发病机制的基础上[1-2],利用蛋白质组学技术研究正常鼻黏膜组织与AR鼻黏膜组织之间的差异表达蛋白,并分析差异表达蛋白的功能,从蛋白质水平探讨AR的发病机制。
1 资料与方法
1.1实验材料实验组:AR患者中鼻道鼻腔黏膜组织;对照组:无鼻部疾病的正常成年人中鼻道鼻腔黏膜组织,每组4例。均为本科住院患者,年龄30~65岁,平均(41.00±3.12)岁;均为男性。取得标本前均得到受试者同意并签署知情同意书。所有患者无哮喘史及阿司匹林过敏史,皮肤过敏原试验呈阳性,术前2周未使用抗生素及类固醇激素。AR的诊断依据世界卫生组织(World Health Organization, WHO) 标准、过敏史及经皮肤过敏原试验(Lofarma, Milan, Italy)。术中取出标本后,迅速用生理盐水冲洗,去除血液及碎骨片;再用磷酸盐缓冲液(phosphate buffer saline, PBS)冲洗,锡箔纸包裹严密,置于塑料冻存管内,-80 ℃冰箱保存。
1.2实验方法
1.2.1样品裂解和蛋白质定量标本样品解冻后进行裂解。蛋白质样品定量采取对其氨基酸序列上的色氨酸进行荧光光谱定量的方法。色氨酸标准品和蛋白质样品都用缓冲液(8 mol/L尿素+20 mmol/L Tris/HCl, pH=7.6)稀释,并用荧光分光光度计(Varian, Palo Alto, CA)检测其中色氨酸的荧光强度,计算出样品中色氨酸的浓度,除以1.3%后得到样品中蛋白质的浓度。然后进行1D十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)和胶图银染,对样品选取,蛋白质抽提和定量步骤进行实验质量控制。
1.2.2蛋白质酶解100 μg样品加入10 ×103超滤管,12 000×g离心,弃去滤出液。加入200 μL UA 缓冲液(8 mol/L 尿素, 100 mmol/L 三羟甲基氨基甲烷, pH=8.5),12 000×g离心,弃去滤出液。加入终浓度为50 mmol/L 吲哚乙酸(使用UA 缓冲液溶解),避光室温反应20 min。12 000×g离心,弃去滤出液。加入200 μL UA 缓冲液,12 000×g离心,弃去滤出液。加入200 μL 50 mmol/L 四乙基溴化氨,12 000×g离心,弃去滤出液。重复2遍。加入2 μg 质谱测序级胰酶(Promega, V5113),37 ℃酶解过夜。12 000×g离心,20 min后收集滤出液,冷冻干燥。 酶解后的肽段再次进行蛋白质定量,对酶解步骤进行实验质量控制。
1.2.3同位素标记相对和绝对定量和强阳离子肽段分级同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ) 的8丛试剂放置到室温,使用50 μL 异丙醇溶解,加入到各个样品中,室温300 转/min振荡反应2 h;各管加入50 μL 去离子水,室温300 转/min振荡反应30 min终止标记反应。合并各个样品,充分振荡混匀后分装,20 μg/管,真空冷冻干燥保存。1.2.4LC-MS/MS 质谱鉴定色谱柱为实验室自制的直径 75 μm、长 15 cm 的 C18 反相毛细管色谱柱。流速为250 nL/min,全程分析时间为240 min/馏分。肽段洗脱梯度为流动相 B(含 0.1%甲酸的乙腈)在 208 min内从 6% 增加至 20%。208~228 min内从20%增加至35%,其后2 min内升至90%并维持至240 min。1.2.5数据库搜索和定量信息提取质谱产生的原始文件使用Proteome Discoverer(1.3版本,Thermo Fisher Scientific, San Jose, CA)进行数据库搜索。数据库搜索产生的结果用Proteomics Tool Suite(3.8.0版本)进行谱图筛选,校正同位素标签纯度,定量数据整合。1.2.6筛选标准应用IBM SPSS Statistics 20.0软件进行统计学分析。两两比较用最小显著差异(least significant difference, LSD)法。差异蛋白标准是fold<0.83 或 fold>1.2,且P<0.05。
2 结果
2.1蛋白质抽提产物1D SDS-PAGE各个样品的蛋白质抽提产物SDS-PAGE 总体分布模式在相同的样品分组中比较类似,蛋白质电泳行为正常,降解现象不明显,蛋白质定量比较一致,符合后续实验研究分析的要求(图1)。
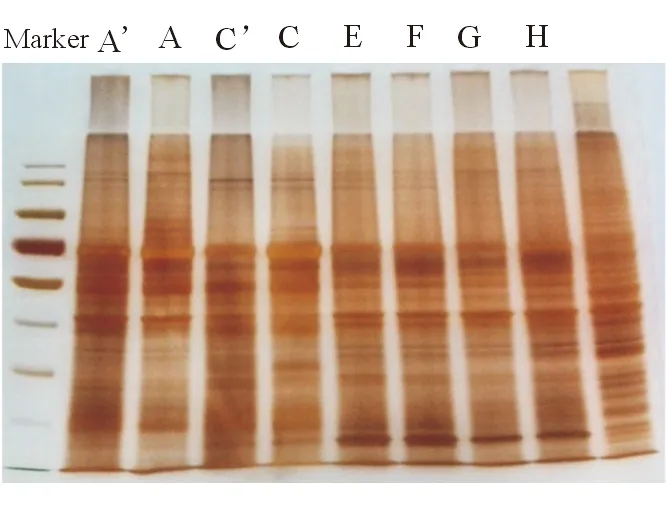
图1. 蛋白质抽提产物1D SDS-PAGE A~H条带表示每个样本中总蛋白的凝胶结果
2.2蛋白质组鉴定和定量控制肽段和蛋白质假阳性率<0.01,总共得到14 694条非冗余肽段,对应于2 463个蛋白质组,在8个iTRAQ通道中都存在定量信息。iTRAQ各个通道的蛋白质定量数值在整体上分布均一,所有通道内蛋白分子量Log2对数值的上四分位数、中位数、下四分位数基本保持在同一水平(图2),未经校正的原始数据总体分布的差异小。结果显示本实验iTRAQ定量标记实验具有严格质量控制和优秀的质谱定量能力。
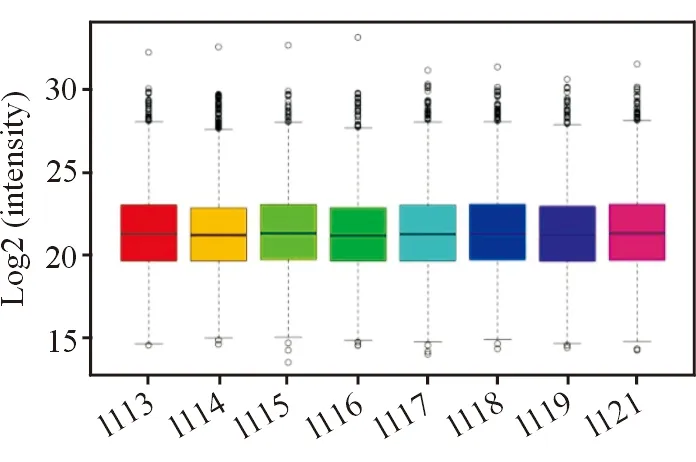
图2. iTRAQ原始定量结果箱线图分布 横向1113~1121为各个样本的iTRAQ稳定同位素化学标记通道,纵向为通道内蛋白相对分子质量Log2对数值
2.3蛋白质定量频率分布进一步对各个样品考查蛋白质定量频率分布(图3)。各个样品的分布高度一致,峰值集中在20~23之间,结果显示本实验良好的数据重复性和定量精确性。
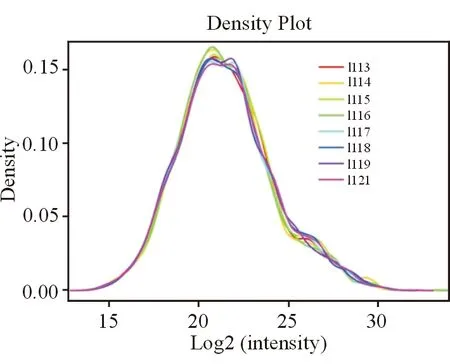
图3. 蛋白质定量频率分布 横坐标为各通道蛋白质相对分子质量的Log2对数值,纵坐标为相对应的蛋白质密度
2.4实验处理组两两相关性考查原始数据各个实验处理组两两相关性(图4),数据的总体相关性非常优秀,R2在0.97~1范围内分布。结果显示本实验iTRAQ定量结果数据具有良好的重复性和数据可信度。
2.5差异蛋白筛选结果AR患者鼻黏膜及正常人鼻黏膜之间筛选出220个差异表达蛋白。上调蛋白60个,其中上调2倍以上蛋白17个,包括嗜酸性粒细胞溶血磷脂酶 (eosinophil lysophospholipase,CLC)、 普列克底物蛋白同源结构蛋白7(pleckstrin homology domain containing family A member 7 ,PLEKHA7)等;下调蛋白160个,其中下调超过50%以上蛋白65个,主要包括脑恶性肿瘤缺失基因1(deleted in malignant brain tumors 1 protein,DMBT1)、S100钙结合蛋白(S100A1)等。这些蛋白涉及炎症反应、免疫应答等多种生理过程。
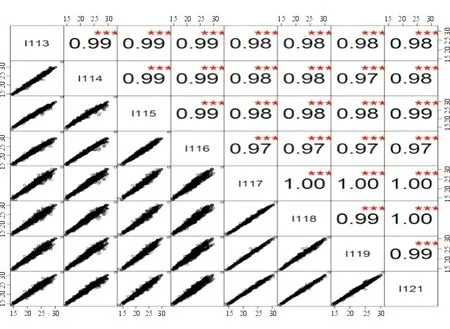
图4. 数据两两相关性 每2个通道之间两两比较,得出相似比R2
2.6差异蛋白功能分析选取差异最为明显的4个蛋白质对数据库进行搜索,并对其应用GO-MF(蛋白组数据自动分析系统)进行功能分析(表1)。

表1 AR鼻黏膜差异蛋白质GO-MF功能分析
3 讨论
AR的发病机制尚不完全清楚。我们课题组前期应用基因芯片研究变态反应的发病机制,结果提示炎症介质和细胞因子对AR的发生可能起很重要的作用[1-2]。本实验在此基础上利用蛋白质组学的方法,检测了AR患者中鼻道鼻腔黏膜与正常成年人中鼻道鼻腔黏膜蛋白表达谱,研究结果发现了大量差异表达蛋白。其中差异最为明显的有CLC、PLEKHA7、S100A1和DMBT1。
3.1CLCCLC广泛存在于原核细胞和真核细胞中,被认为与磷脂代谢密切相关,在嗜酸性粒细胞内蛋白中占有很大比例[3-4]。颗粒内超微结构分析表明,CLC主要与炎症反应有关[5],其主要生物学功能是将溶血卵磷脂水解成为甘油磷脂酰胆碱及少量游离脂肪酸。溶血磷脂是细胞骨架的重要组成部分,因此CLC在维持细胞骨架稳定性方面具有重要作用,而AR的病理学特点正是嗜酸性粒细胞的浸润。本实验结果显示,CLC有大幅度上调,上调2倍以上,这与Ghafouri等[6]对AR患者鼻腔冲洗液进行的蛋白质组学研究结果相符合。同时,Bryborn等[7]也据此进行了基因验证,推测CLC的遗传变异与AR相关。我们的研究结果认为,可能的原因是CLC引起鼻黏膜细胞骨架破坏,导致鼻黏膜细胞坏死或者凋亡,释放一系列细胞因子,触发或者进一步加重了鼻腔黏膜局部的变态反应,导致AR的发生。
3.2PLEKHA7PLEKHA7是一种附着链接蛋白,对维持黏膜上皮细胞稳定性具有重要作用。PLEKHA7为黏附小带的生发和形态、功能维持所必需,主要与闭角型青光眼有关[8]。目前关于PLEKHA7与AR之间的关系尚未见报道。本实验结果显示,AR患者中鼻道鼻腔黏膜与正常成年人中鼻道鼻腔黏膜蛋白表达明显上调,推测其在AR鼻黏膜中高表达,可能破坏了鼻黏膜上皮的稳定性,引起局部鼻黏膜损伤,从而导致AR发作。
3.3S100A1S100A1为S100大家族中的一员,属于钙结合蛋白,具备细胞内和细胞外调节活性,参与多种细胞活动,其主要生物学功能是调节细胞内外的钙离子浓度,进而影响蛋白磷酸化,最终可以实现对细胞膜上离子通道及电生理过程的调控。王鑫等[9]在研究伴有AR的鼻息肉免疫相关基因表达谱时发现,实验组织较正常组织相比,S100A2表达下调。本实验中S100A1显著下调,与本课题组前期的基因芯片研究结果及王鑫等[9]的结果接近,提示S100A1与AR有密切联系,可能是调节鼻黏膜细胞内外钙离子浓度,导致AR发生,具体机制有待进一步研究。3.4与前期基因芯片研究结果对比我们将本次蛋白质组学的研究结果与本课题组前期的基因芯片研究结果对比[1-2]。基因芯片研究结果显示:DMBT1表达明显下调;本蛋白质组学研究中,DMBT1表达亦明显下调。
DMBT1是近年来新发现的一种抑癌基因。Kang等[10]认为,DMBT1与上皮发育有密切关系,DMBT1能将上皮重建的调节与炎症反应联系起来,在维持黏膜上皮局部微环境的稳态上发挥重要作用。Reichhardt等[11]研究发现,DMBT1在新生儿粪便及羊水中含量较高,尤其是在胎粪中更是占到所有蛋白总量的4%~10%,最终认为DMBT1在新生儿的先天性免疫机制中有重要作用。同时,Ronellenfitsch等[12]也发现,如果新生儿出生时伴有感染性疾病,母乳中的DMBT1含量也会显著提高,因此,DMBT1在母乳中可能与免疫球蛋白类似参与了先天性免疫防御。肠炎症性疾病时,肠上皮细胞内的白细胞介素27诱导的DMBT1表达上调。Diegelmann等[13]证实,DMBT1在抗炎、抗菌过程中有重要作用。本次实验中DMBT1表达明显下调,这与国内外有关报道一致[14-15],并与本课题组前期的基因芯片研究结果相吻合。我们认为,DMBT1的下调可能破坏了鼻腔黏膜局部微环境的稳定,鼻腔黏膜免疫应答出现了问题,降低了黏膜的抗感染能力,最终导致AR的发生。
Wu J, Bing L, Jin H, et al. Gene expression profiles of nasal polyps associated with allergic rhinitis[J]. Am J Otolaryngol, 2009,30(1):24-32.
[2]刘冰, 吴建, 赵舒薇, 等. 人类变应性鼻炎基因表达谱的研究[J].中国耳鼻咽喉头颈外科, 2008, 15(3): 149-152.
[3]Ackerman SJ, Weil GJ, Gleich GJ. Formation of Charcot-Leyden crystals by human basophils[J]. J Exp Med, 1982, 155(6): 1597-1609.
[4]Ackerman SJ, Loegering DA, Gleich GJ. The human eosinophil Charcot-Leyden crystal protein: biochemical characteristics and measurement by radioimmunoassay[J]. J Immunol, 1980, 125(5): 2118-2126.
[5]Dvorak AM, Ackerman SJ. Ultrastructural localization of the Charcot-Leyden crystal protein (lysophospholipase) to granules and intragranular crystals in mature human basophils[J]. Lab Invest, 1989, 60(4): 557-567.
[6]Ghafouri B, Irander K, Lindbom J, et al. Comparative proteomics of nasal fluid in seasonal allergic rhinitis[J]. J Proteome Res, 2006, 5(2): 330-338.
[7]Bryborn M, Hallden C, Sall T, et al. CLC-a novel susceptibility gene for allergic rhinitis[J]. Allergy, 2010, 65(2): 220-228.
[8]Chen Y, Chen X, Wang L, et al. Extended association study of PLEKHA7 and COL11A1 with primary angle closure glaucoma in a Han Chinese population[J]. Invest Ophthalmol Vis Sci, 2014, 55(6): 3797-802.
[9]王鑫, 董震. 鼻息肉组织免疫相关基因的表达谱[J]. 中华耳鼻咽喉科杂志, 2004, 39(12): 721-724.
[10]Kang W, Reid KB. DMBT1, a regulator of mucosal homeostasis through the linking of mucosal defense and regeneration?[J]. FEBS Lett, 2003, 540(1/3): 21-25.
[11]Reichhardt MP, Jarva H, de Been M, et al. The salivary scavenger and agglutinin in early life: diverse roles in amniotic fluid and in the infant intestine[J]. J Immunol, 2014, 193(10): 5240-5248.
[12]Ronellenfitsch S, Weiss C, Frommhold D, et al. High DMBT1 concentrations in breast milk correlate with increased risk of infection in preterm and term neonates[J]. BMC Pediatr, 2012, 12: 157.
[13]Diegelmann J, Olszak T, Goke B, et al. A novel role for interleukin-27 (IL-27) as mediator of intestinal epithelial barrier protection mediated via differential signal transducer and activator of transcription (STAT) protein signaling and induction of antibacterial and anti-inflammatory proteins[J]. J Biol Chem, 2012, 287(1): 286-298.
[14]Liu Z, Kim J, Sypek JP, et al. Gene expression profiles in human nasal polyp tissues studied by means of DNA microarray[J]. J Allergy Clin Immunol, 2004, 114(4): 783-790.
[15]Rostkowska-Nadolska B, Kapral M, Fraczek M, et al. A microarray study of gene expression profiles in nasal polyps[J]. Auris Nasus Larynx, 2011, 38(1): 58-64.
(本文编辑杨美琴)
Isobaric tags for relative and absolute quantitation proteomic research of allergic rhinitis
ZHANGJian,ZHAOYu,LUXiao-qing,WUJian.
DepartmentofOtorhinolaryngology,ShanghaiChangzhengHospital,Shanghai200003,China
WU Jian, Email: jianwu2008@126.com
ObjectiveTo study the protein expression profiles of allergic rhinitis (AR) and to explore the pathogenic mechanisms of AR from the level of proteins. MethodsFour samples of AR mucosa and 4 samples of normal nasal mucosa were collected and the protein expression profiles of the samples were detected by means of isobaric tags for relative and absolute quantitation technique. The differentially expressed proteins were analyzed and discussed. ResultsThere were totally 220 differentially expressed proteins. Among them, 60 proteins including eosinophil lysophospholipase (CLC), pleckstrin homology domain containing family A member 7 (PLEKHA7), etc. were up-regulated and 160 proteins including detected in malignant brain tumors 1 protein (DMBT1), S100A1, etc. were down-regulated. ConclusionsThere were differences in protein expression profiles between AR and normal nasal mucosa. Differentially expressed proteins provide new cues for the study of pathogenesis of AR. Up-regulation of CLC and down-regulation of DMBT1 may be involved in inflammation, immune response of nasal mucosa. (Chin J Ophthalmol and Otorhinolaryngol,2016,16:309-312)
Rhinitis, allergic; Proteomics; Isobaric tags for relative and absolute quantitation
上海市科委西医引导重点科研项目(14411960400,14411960401);上海市科委产学研项目(14DZ1940103)
上海长征医院耳鼻咽喉科上海200003
吴建(Email: jianwu2008@126.com)
张健和赵煜为共同第一作者
10.14166/j.issn.1671-2420.2016.05.002
2015-11-11)
