蛋白酶活化受体1调控 Mcl-1和Bax 表达介导热打击致人脐静脉内皮细胞早期凋亡的研究
2016-10-25王郑莲徐秋林刘亚楠周耿标刘云松邱俊明
王郑莲 徐秋林 刘亚楠 周耿标 刘云松 邱俊明 苏 磊
(1.广州军区广州总医院重症医学科,全军热区创伤救治与组织修复重点实验室,广东 广州 510010;2.广州中医药大学,广东 广州 510403;3.广东省中医院芳村医院重症医学科,广东 广州 510000)
论著
蛋白酶活化受体1调控 Mcl-1和Bax 表达介导热打击致人脐静脉内皮细胞早期凋亡的研究
王郑莲1,2徐秋林1刘亚楠1周耿标3刘云松1邱俊明1苏磊1
(1.广州军区广州总医院重症医学科,全军热区创伤救治与组织修复重点实验室,广东广州510010;2.广州中医药大学,广东广州510403;3.广东省中医院芳村医院重症医学科,广东广州510000)
目的:观察热打击人脐静脉内皮细胞(HUVECs)后蛋白酶活化受体1(PAR1)对凋亡相关蛋白Mcl-1、Bax水平表达调控及细胞早期凋亡的影响,明确PAR1在热打击致HUVECs凋亡中的作用。方法:采用PAR1抑制剂SCH79797(SCH)、PAR1激动剂TFLLR-NH2(TF)、PAR1siRNA、PAR1腺病毒过表达预处理HUVECs,给予42 ℃热打击2 h,后于8 h提取各处理组总蛋白,western blot检测Mcl-1、Bax、Caspase 3及Cleaved-Caspase 3蛋白表达,流式细胞计数仪检测各处理组细胞早期凋亡。结果:与正常对照组比较,热打击组Mcl-1、Bax、Caspase 3表达增加及Cleaved-Caspase 3活化程度增加(P<0.05);与热打击组比较,PAR1抑制剂或PAR1siRNA联合热打击组Mcl-1表达增加(P<0.05),Bax减少(P<0.05),Cleaved-Caspase 3活化程度降低,细胞早期凋亡数目减少(P<0.05,P<0.01),PAR1激动剂或PAR1腺病毒联合热打击组Bax表达增加(P<0.05),Mcl-1表达减少(P<0.05),Cleaved-Caspase 3活化程度增加,且细胞早期凋亡数目增加(P<0.05或P<0.01)。结论:热打击HUVECs可发生细胞凋亡,Mcl-1、Bax蛋白表达增加;PAR1通过调控Mcl-1及Bax的表达最终起到促凋亡作用。
热打击人脐静脉内皮细胞细胞凋亡蛋白酶活化受体1Mcl-1Bax
重症中暑是指核心温度超过40 ℃并因热损伤后继发系统性炎症反应和凝血功能障碍从而导致的多器官功能障碍综合征,涉及细胞因子、炎性介质、凝血系统的激活和内皮细胞损伤之间的交互反应[1]。血管内皮细胞是热打击的重要效应细胞[2]。细胞凋亡是中暑细胞死亡的主要特征,我们前期研究了p53及核因子-κB (NF-κB) 在热打击致人脐静脉内皮细胞(HUVECs)凋亡中的作用及机制[3-4],证实了细胞凋亡在HUVECs参与的重症中暑发病机制中起着重要作用。蛋白酶活化受体1(PAR1)是一种损伤处血管内皮细胞生成的多功能蛋白酶,在血管内皮损伤后炎症激活及屏障功能破坏中起着重要作用[5]。前期研究表明,热打击HUVECs可导致PAR1表达增加,且在热打击后8 h 其表达水平达到峰值[6]。Mcl-1、Bax是Bcl-2家族中的重要成员,二者在凋亡调控中具有重要作用[7]。本实验旨在研究PAR1在热打击HUVECs后与Mcl-1、Bax及凋亡的关系,阐明热打击后细胞凋亡的信号转导机制,探讨重症中暑致血管内皮损害的发病机制。
1 材料与方法
1.1主要实验材料HUVECs(中国科学院上海细胞生物学研究所);PAR1抗体(Sigma,美国,鼠抗),Mcl-1、Bax抗体、Caspase3、Cleaved-Caspase3(CST,美国,兔抗),GAPDH抗体(兔抗)、山羊抗兔二抗(北京中杉金桥),凋亡检测试剂盒(上海联科生物科技),PAR1激动剂TFLLR-NH2(TF,Sigma,美国),PAR1抑制剂SCH79797(SCH,Abcam,英国),裂解液、BCA蛋白定量试剂盒(上海碧云天),DMEM-F12培养基、胎牛血清、胰酶、双抗、25 cm2细胞培养瓶、35 mm培养皿(Hyclone,美国),PVDF膜、ECL显影液(Millipore,美国);30%丙烯酰胺(广州捷倍斯),预染蛋白Marker(Fermentas,立陶宛),5×上样缓冲液(广州晶欣),封闭液(Mpbio,美国)。PAR1siRNA 基因序列(20 μmol/L,上海吉玛,中国); PAR1siRNA正义链5'-GAACCCUGCUCGAAGGCUACUATT-3';反义 链5'-UAGUAGCCUUCGAGCAGGGUUCTT-3'。NCsiRNA基因序列(20μmol/L):正义链5'-UUCUCCGAACGUGUCACGUTT-3',反义链5'-ACGUGACACGUUCGGAGAATT-3'。siRNA-MateTM转染试剂(上海吉玛), PAR1腺病毒(山东维真生物科技有限公司):基因序列号NM-001992 ORF克隆至pAD-kan载体。
1.2方法
1.2.1细胞复苏培养HUVECs复苏后收入离心管中,1 000 r/min离心10 min,弃上清,用DMEM-F12完全培养液(含10%胎牛血清,1×105U/L青霉素、100 mg/L链霉素)混匀细胞,转入25 cm2培养瓶中,在37 ℃、5 %CO2浓度及饱和湿度条件下培养,次日换液,以后根据细胞生长情况每48~72 h 更换培养液1次,每周传代1~2次。
1.2.2PAR1siRNA 及阴性对照组(NCsiRNA)转染转染前提前一天将正常细胞接种在35 mm的培养皿上,接种细胞数量控制在 1×105个/皿,使第2天转染时细胞的汇合度控制在30%~50%。转染时移除原有的培养基,加入 500 µl 的无血清培养基,分别取siRNA及NCsiRNA储液(浓度是20 µmol/L)1 µl加入19 µl去核糖核酸酶水,稀释至1 µmol/L,取1 µmol/L的siRNA稀释液11 µl加入到100 µl无血清DMEM培养基,轻轻混匀,室温放置5 min;取10 µl siRNA-MateTM加入到经培养基稀释的siRNA 溶液中,立即用加样器吹打10次以上,充分混匀,轻微离心后,室温放置10 min,以便 siRNA-siRNA-MateTM复合物形成;将siRNA-siRNAMateTM复合物逐滴滴加到每一个包含细胞和培养基的培养皿中,轻轻地前后摇动培养板混合均匀,4~6 h后改换完全培养基。然后放置在37 ℃、5 % CO2培养箱孵育48~72 h。
1.2.3PAR1腺病毒(Ad-PAR1)及空载体腺病毒(Ad-empty)转染①准备细胞:实验前一天接种5×103个目的细胞于96孔培养板中(接种8个孔),加入培养基100 µl,确保进行病毒感染时细胞的融合率约40%~50%。②配制腺病毒溶液:准备6个无菌EP管,在第1个EP管中加入990 µl完全培养基,其余5个各加入 900 µl 完全培养基;取10 µl腺病毒原液加入990 µl EP管中做1∶100稀释;然后以此为起点,再取100 µl稀释液加入到900 µl的EP管中做1∶10稀释,直至稀释到107倍。③观察腺病毒转染对细胞生长状态的影响:从孵箱中取出96孔板,在显微镜下确定每孔的细胞均生长良好;吸弃旧培养液,然后以此将上述不同稀释度的病毒液加入到96孔板中,每种稀释度的病毒取100 µl加入到96孔板中,未加入病毒的细胞孔中加入同样量的完全培养基作为对照组。8~12 h后观察细胞状态,如果细胞状态与未感染组无明显差异,表明该病毒对细胞没有明显毒性作用,可继续培养。④显微镜下观察腺病毒转染情况:腺病毒感染细胞速度快,分别在感染后12、24、48 h观察细胞中荧光表达情况,根据细胞的生长状况、荧光表达情况综合判断病毒在哪个稀释度下作用效果最好,并以此稀释度下的病毒浓度作为后继实验的依据。⑤转染步骤:将HUVECs均匀接种于3.5 cm的培养皿,待细胞长至40%~50%融合时,分别更换含上述确定的最佳稀释度的腺病毒的基础培养基1 ml,继续培养24~48 h后,吸去培养基,PBS洗1~2遍,更换新鲜无血清培养基培养12 h 后进行后续实验。将细胞以合适的细胞数接种在3.5 cm的培养皿上,按照上述腺病毒转染方法在HUVECs中转染PAR1基因过表达腺病毒,通过Western blot方法检测转染效率。
1.2.4PAR1抑制剂SCH及激动剂TF及DMSO的处理取对数生长期细胞,按2×105个/孔密度铺入可拆卸35 mm小皿,待细胞长至90%融合时,取储存浓度为10 µmol/L的SCH 5 µl加入1 ml无血清DMEM-F12,使终浓度为50 nmol/L,弃去旧培养基,将配制好的试剂加入细胞中,培养0.5 h后进行后续实验;取储存浓度为8 mmol/L的TF 6.25 µl 加入1 ml无血清DMEM-F12,使其终浓度为25µmol/L,弃去旧培养基,将配制好的试剂加入细胞中,培养0.5 h后进行后续实验;设置DMSO组为对照,取1 µl 加入细胞培养基中,培养0.5 h后进行后续实验。
1.2.5HUVECs热打击取对数生长期细胞,按2×105个/孔密度铺入可拆卸35 mm小皿,培养6 h贴壁后,更换无血清DMEM培养过夜后,更换DMEM完全培养液,将细胞分为两组,给予相应刺激,每个独立实验重复3次:对照组细胞置于标准37 ℃、5 % CO2培养箱中同其余各组等时间培养;42 ℃热打击组细胞置于42 ℃细胞培养箱中培养2 h,后置于37 ℃、5 % CO2孵箱分别培养0、2、6、12 h。
1.2.6蛋白质免疫印迹试验(Western blot)检测PAR1、Mcl-1、Bax、Caspase 3、Cleaved-Caspase 3、GAPDH蛋白表达BCA 法定量,十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDSPAGE)将蛋白转移至PVDF膜上,用5%封闭液室温封闭 2 h,加入PAR1、Mcl-1、Bax、Caspase3、Cleaved-Caspase 3、GAPDH 抗体(1∶1 000一抗),4 ℃过夜,含吐温20的TBST洗3次后,加入结合辣根过氧化物酶标记的羊抗兔(1∶5 000)二抗室温孵育2 h,用ECL显影液进行反应、曝光。结果以待测蛋白与内参GAPDH的灰度值比值表示。
1.2.7流式细胞仪检测细胞凋亡42 ℃热打击2 h再将标准培养 8 h的HUVECs及正常对照组标准培养8 h的细胞收集至2 ml EP管中,1 000 r/min 离心5 min,每管加入500 μl 1 ×缓冲液 ,按照凋亡检测试剂盒说明书,每个EP管分别加5 μl异硫氰酸荧光素(FITC)标记的 Annexin V和10 μl碘化丙啶(PI),避光混匀,放置室温摇床避光15 min后用流式细胞计数仪检测早期细胞凋亡。
1.3统计学处理所有实验均重复3次以上,数据以表示,统计由SPSS17.0软件完成,多重比较采用单因素方差分析,两组比较应用t检验,P<0.05 表示差异有统计学意义。
2 结 果
2.1热打击HUVECs后Mcl-1、Bax蛋白的表达增加,Caspase3、Cleaved-Caspase3活化与正常对照组比较,热打击后早期Mcl-1的表达显著增多,复温12 h后其表达恢复至正常水平;热打击后Bax表达显著增多,并在复温12 h达到峰值;热打击组Caspase 3及Cleaved-Caspase3较正常组活化。见图1。
2.2蛋白测定显示,抑制PAR1可减轻热打击致HUVECs凋亡,激动PAR1可加重热打击致HUVECs凋亡分别采用DMSO、PAR1抑制剂SCH、PAR1siRNA及PAR1激动剂TF、PAR1腺病毒过表达预处理HUVECs后,42 ℃热打击2 h,于8 h后提取总蛋白,Western blot检测PAR1、Mcl-1、Bax、Cleaved-Caspase 3蛋白水平。与DMSO热打击组比较,PAR1抑制剂联合热打击组Mcl-1表达水平增加,PAR1激动剂组Mcl-1表达水平明显降低;与DMSO常温组及PAR1抑制剂常温组比较,PAR1激动剂常温组Bax表达水平显著增高;与DMSO热打击组及PAR1抑制剂热打击组比较,PAR1激动剂热打击组Bax水平显著增加。与NCsiRNA热打击组比较,PAR1siRNA联合热打击Mcl-1表达水平显著增加,Bax表达水平显著减少,Cleavesd-Caspase3活化水平降低;与Ad-empty热打击组比较,Ad-PAR1联合热打击组Mcl-1表达水平显著降低,Bax表达水平明显增加,Cleavesd-Caspase3活化水平增强。综上所述:抑制PAR1的表达及PAR1siRNA可抑制细胞凋亡,激活PAR1或采用腺病毒使PAR1过表达可促使细胞发生凋亡。见图2~4。
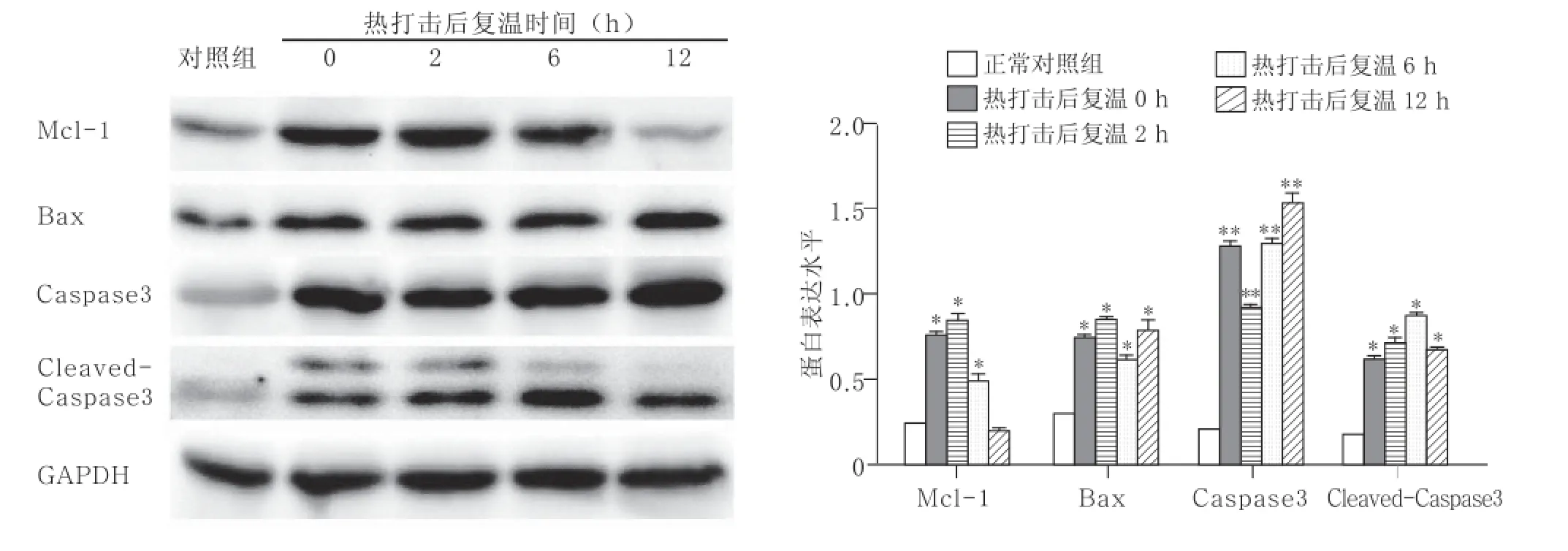
图1 42 ℃热打击对HUVECs的Mcl-1、Bax、Caspase 3及Cleaved-Caspase 3蛋白表达水平的影响
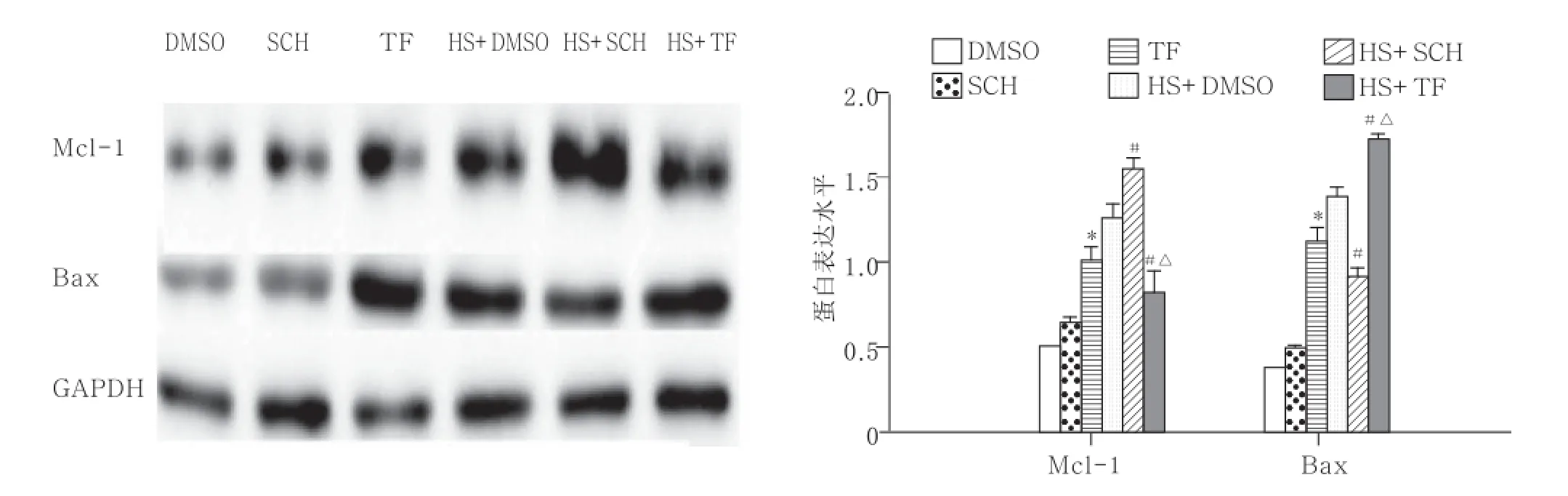
图2 PAR1激动剂和抑制剂对热打击HUVECs表达Mcl-1和Bax水平的影响
2.3流式细胞仪检测结果显示抑制PAR1可减少热打击致HUVECs早期凋亡,激活PAR1可加重热打击致HUVECs早期凋亡与DMSO热打击组比较,PAR1抑制剂联合热打击组细胞早期凋亡数目明显减少,PAR1激动剂联合热打击组细胞早期凋亡数目明显增多。综上所述:抑制PAR1的表达可抑制细胞早期凋亡,激活PAR1加重细胞早期凋亡。见图5和图6。
2.4流式细胞仪检测结果显示,PAR1siRNA可减少热打击致HUVECs早期凋亡,PAR1腺病毒可加重热打击致HUVECs早期凋亡与NCsiRNA联合热打击组比较,PAR1siRNA联合热打击组细胞早期凋亡数目明显减少;与Adempty联合热打击组比较,Ad-PAR1联合热打击组细胞早期凋亡数目明显增多。见图7和图8。综上所述,热打击后PAR1表达增多起着促凋亡作用。
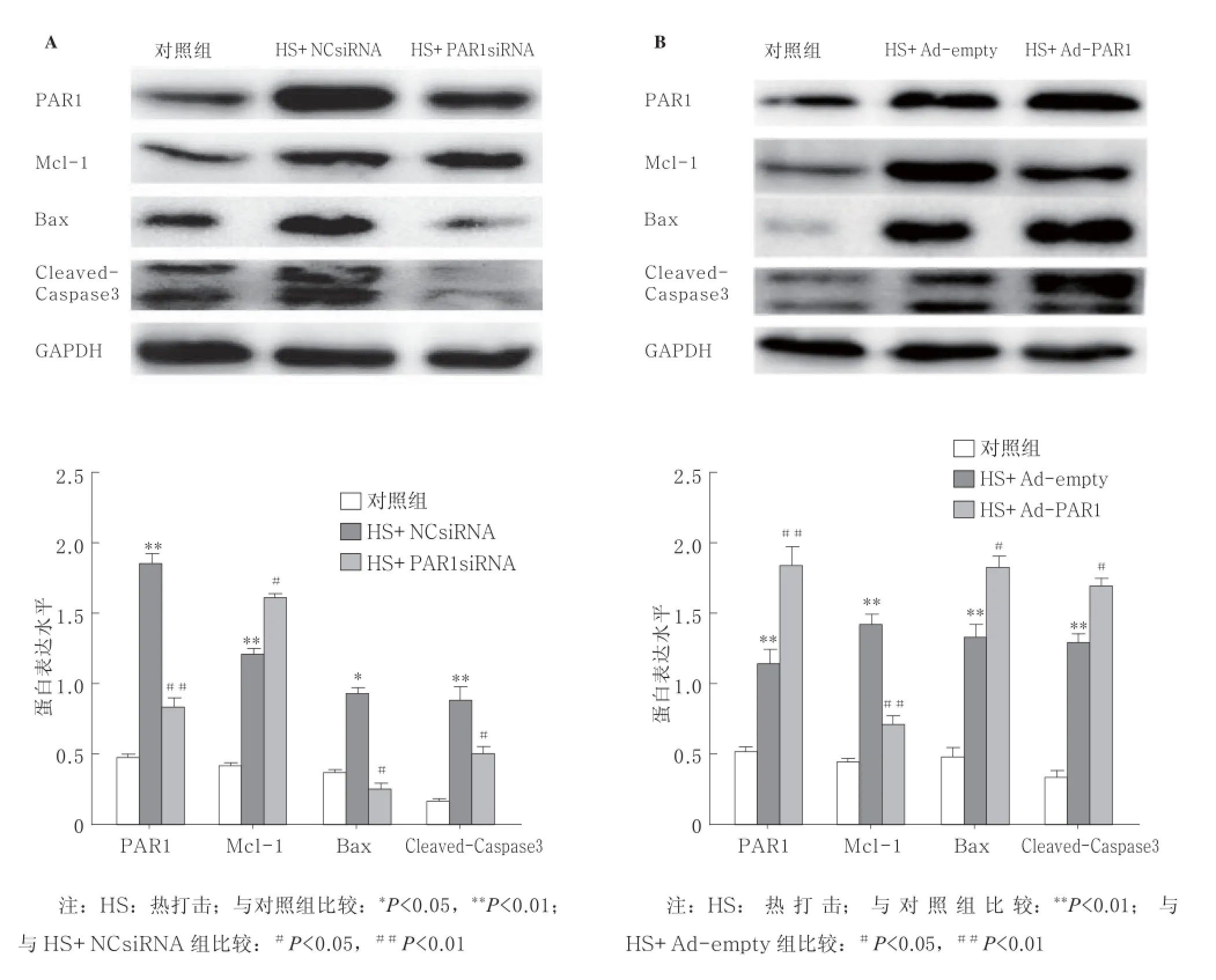
图3 PAR1siRNA转染(A)和PAR1腺病毒转染(B)对热打击HUVECs的PAR1、 Mcl-1、Bax、Cleaved-Caspase3蛋白表达水平的影响
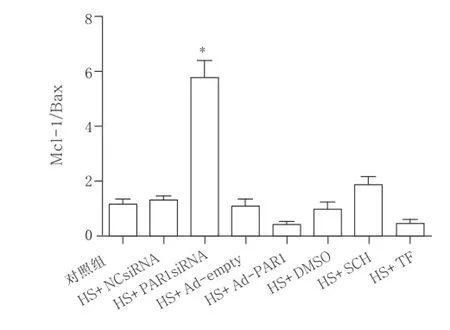
图4 PAR1siRNA、PAR1腺病毒转染及PAR1抑制剂和激动剂处理对HUVECs热打击后Mcl-1/Bax的影响
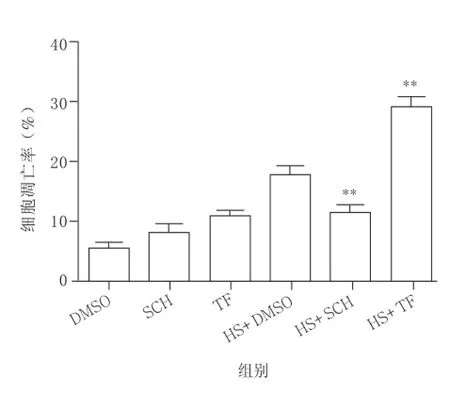
图5 PAR1抑制剂及激动剂对热打击后HUVECs早期细胞凋亡的影响
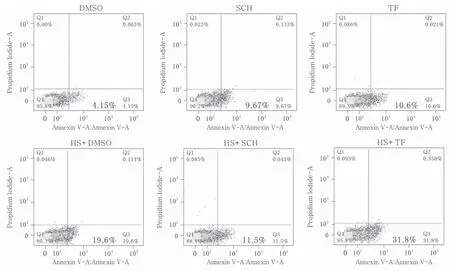
图6 PAR1抑制剂及激动剂作用后热打击HUVECs早期细胞凋亡的流式细胞分析结果
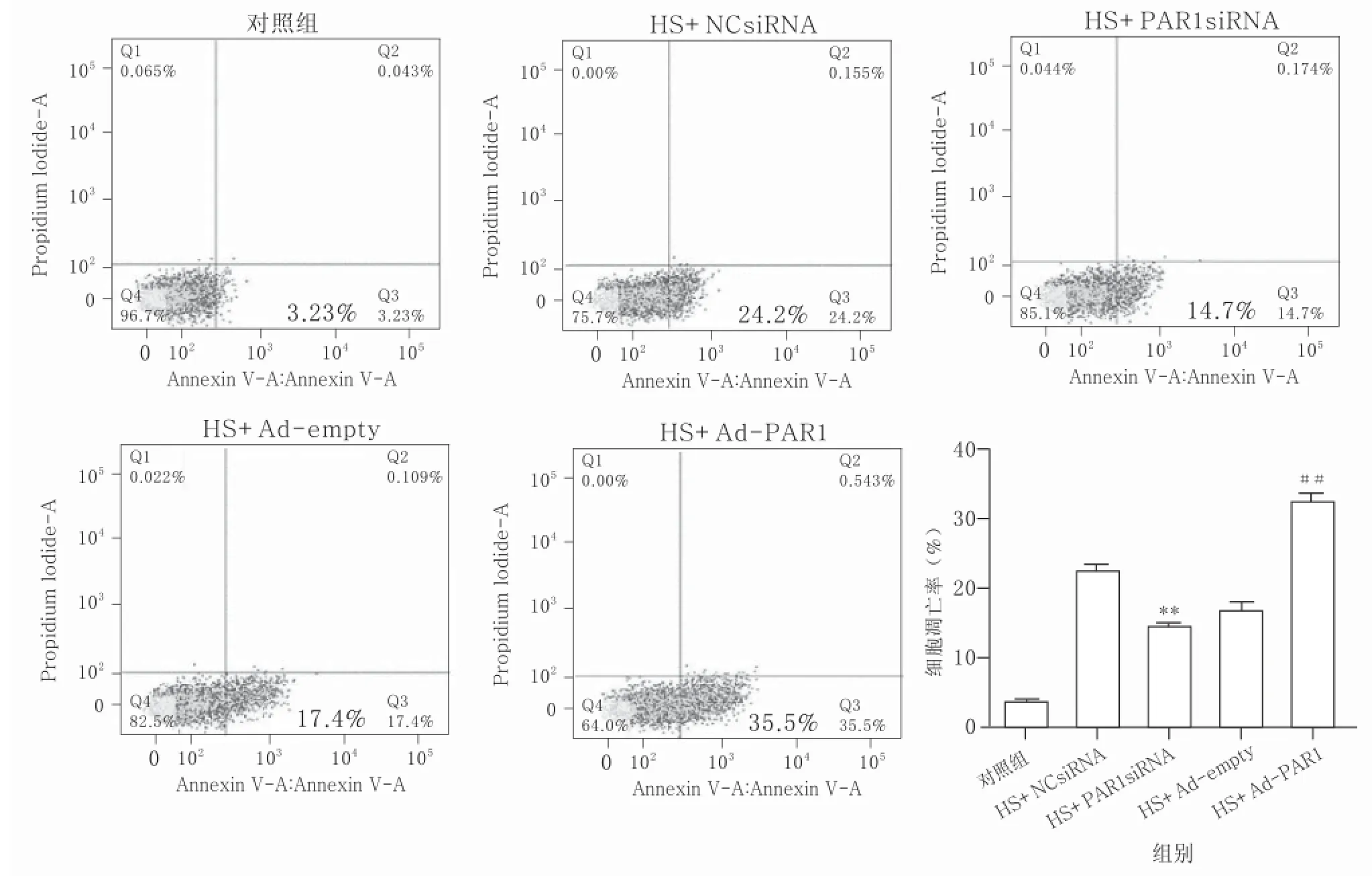
图7 PAR1敲除及腺病毒过表达对热打击HUVECs早期细胞凋亡的影响的流式细胞分析结果
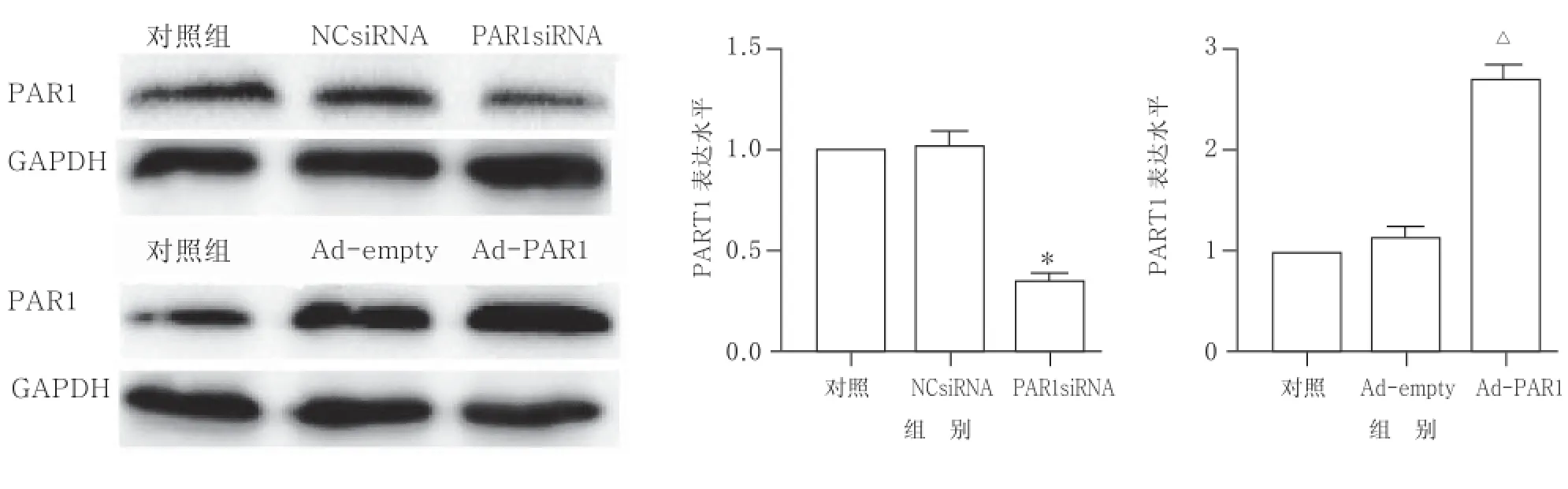
图8 PAR1siRNA和Ad-PAR1处理后HUVECs的 PAR1表达
3 讨 论
重症中暑时,高热刺激可诱导细胞凋亡,这在其病理生理过程中起着不可忽视的作用。研究表明细胞凋亡是重症中暑血管内皮损伤的重要发病机制[3-4,8-9]。凋亡是机体在进化过程中形成的一种保守的死亡途径,细胞凋亡时通常伴随抗凋亡及促凋亡基因及相关蛋白的同时存在。细胞凋亡是中暑细胞死亡的主要方式,研究表明热打击可导致细胞发生凋亡[7,10]。
Bcl-2 是一个多基因家族,按其功能分为两类:抑制细胞凋亡和促进细胞凋亡。Mcl-1作为Bcl-2家族的一个抗凋亡成员,是唯一含有增殖细胞核抗原(PCNA)结构的蛋白分子,其在细胞凋亡调控中处于凋亡信号传导的上游,调节导致细胞色素 C释放的早期级联反应。Bax是Bcl-2家族中最具代表性的促进细胞凋亡基因,是线粒体外膜通透性改变的关键蛋白。Caspase3作为Caspase家族中的一员,是凋亡机制的核心成分、直接诱导细胞凋亡最重要效应蛋白酶之一及凋亡的主要执行者,其一旦活化,凋亡不可避免[10-12]。
PAR1 是G蛋白偶联的血管受体,广泛分布在血管内皮细胞、平滑肌细胞、巨噬细胞、成纤维细胞等细胞膜上[5]。在肿瘤领域研究较多,有研究表明在肿瘤细胞PAR1可通过增加促凋亡蛋白Bax、Caspase3的表达及下调内皮细胞血管生长因子的表达而促使细胞发生凋亡[13]。目前关于PAR1的激活介导细胞凋亡的机制包括:PAR1激活导致细胞屏障功能破坏、通透性增加[6];通过激活JNK、p38信号通路促使细胞发生凋亡[14];通过NF-κB信号转导机制及Bcl-XL机制介导细胞凋亡[15]。另有研究表明,PAR1激动剂可促使运动神经元、星形胶质细胞发生凋亡,而抑制人单核细胞、成肌细胞、肠上皮细胞发生凋亡[16]。
Bcl-2/Bax比值对决定细胞是否进入凋亡状态有重要意义。本研究从PAR1的活化水平及表达水平两个方面研究其对凋亡蛋白的影响,对HUVECs采用PAR1抑制剂SCH及PAR1siRNA降低PAR1活化水平及蛋白表达水平,在给予热打击后PAR1可通过调节凋亡上游信号蛋白Mcl-1及主要促凋亡蛋白Bax表达从而降低细胞凋亡;采用PAR1激动剂TF及PAR1腺病毒使其活化或过表达,在热打击后加重了细胞凋亡,且PAR1siRNA热打击组与PAR1抑制剂热打击组比较,Mcl-1/Bax蛋白比值明显升高,而在Ad-PAR1热打击组和PAR1激动剂热打击组,Mcl-1/Bax蛋白比值无明显差别。结合前期研究可见,热打击可使PAR1表达水平增加[6],其介导了下游促凋亡蛋白Bax表达增加及抗凋亡蛋白Mcl-1表达抑制,使Caspase 3活化水平增加,最终导致细胞凋亡。以往研究表明,当PAR1活化后,Bax表达水平增高[17],这在本研究中也得到证明。PAR1通过调节Mcl-1及Bax表达水平参与热打击致HUVECs发生凋亡,其具体信号转导机制有待进一步研究。本研究将有助于进一步了解重症中暑的凋亡信号转导机制,对重症中暑的防治有指导意义。
[1]BouchamaA, Knochel JP. Heat stroke [J]. N Engl J Med, 2002,346(25): 1978-1988.
[2]古正涛,刘志锋,苏磊.血管内皮细胞损伤与中暑发病机制关系的研究进展[J].中华急诊医学,2013,22(7):807-811.
[3]Gu ZT, Wang H, Li L, Liu YS, Deng XB, Huo SF, Yuan FF,Liu ZF, Tong HS, Su L. Heat stress induces apoptosis through transcription-independent p53-mediated mitochondrial pathways in human umbilical vein endothelial cell[J]. Sci Rep , 2014, 4: 4469.
[4]Liu Y, Zhou G, Wang Z, Guo X, Xu Q, Huang Q, Su L. NF-kappaB signaling is essential for resistance to heat stress-induced early stage apoptosis in human umbilical vein endothelial cells[J]. Sci Rep, 2015, 5: 13547.
[5]刘静娴,徐秋林.蛋白酶活化受体1在内皮细胞中的作用[J].广东医学,2013,34(17):2714-2717.
[6]Xu Q, Liu J, Wang Z, Guo X, Zhou G, Liu Y, Huang Q, Su L. Heat stress-induced disruption of endothelial barrier function is via PAR1 signaling and suppressed by Xuebijing injection[J]. PLoS One , 2015, 10(2): e0118057.
[7]郭进,杨华强.Mcl-1分子研究进展[J].现代生物医学,2012,2:393-405.
[8]刘亚楠,徐秋林,郭晓华,周耿标,王郑莲,陆杰富,邱俊明,苏磊.热打击及中暑小鼠血清对小鼠肺微血管内皮细胞黏附单核细胞能力的影响[J].感染、炎症、修复,2014,9(15):131-135.
[9]耿焱, 彭娜, 刘亚楠,付炜,雷玉梅, 苏磊.热打击对培养人脐静脉内皮细胞增殖能力的影响[J].感染、炎症、修复,2013,3(14):7-10.
[10]李莉,古正涛,刘志锋.活性氧调控 Bcl-2、Bax 表达参与热打击后人脐静脉内皮细胞凋亡的研究[J].中华急诊医学,2014,7(22):458-463.
[11]上官海娟,徐江,官洪山,赵艳峰.当归对心肌梗死后心肌细胞凋亡和心室重构的影响[J].中国中西医结合急救杂志,2008,15(1):39-44.
[12]焦俊霞,高维娟.细胞凋亡的信号转导机制研究进展[J] .中国老年学杂志,2010,30(6):853-856.
[13]Salah Z, Maoz M, Pokroy E, Lotem M, Bar-Shavit R, Uziely B. Protease-activated receptor-1 (hpar1), a survival factor eliciting tumor progression[J]. Mol Cancer Res, 2007, 5(3):229-240.
[14]Wu X, Zhang W, Li JY, Chai BX, Peng J, Wang H, Mulholland MW. Induction of apoptosis by thrombin in the cultured neurons of dorsal motor nucleus of the vagus[J]. Neurogastroenterol Motil, 2011, 23(3): 279-285.
[15]Tantivejkul K, Loberg RD, Mawocha SC, Day LL, John LS,Pienta BA, Rubin MA, Pienta KJ. PAR1-mediated NF-κB activation promotes survival of prostate cancer cells through a Bcl-xL-dependent mechanism[J]. J Cellular Biochem , 2005,96:641-652.
[16]Chin AC, Vergnolle N, MacNaughton WK, Wallace JL,Hollenberg MD, Buret AG. Proteinase-activated receptor 1 activation induces epithelial apoptosis and increases intestinal permeability[J]. Proc Natl Acad Sci USA, 2003, 100(19): 11104-11109.
[17]Bar-Shavit R, Turm H, Salah Z, Maoz M, Cohen I, Weiss E,Uziely B, Grisaru-Granovsky S. PAR 1 Plays a role in epithelial malignancies: transcriptional regulation and novel signaling pathway[J]. Iubmb Life, 2011, 63(6): 397-402.
Early apoptosis of human umbilical vein endothelial cells resulting from heat stress mediated by proteaseactivated receptor 1 through regulating the expressions of Mcl-1 and Bax
Wang Zhenglian*, Xu Qiulin, Liu Ya'nan , Zhou Gengbiao, Liu Yunsong, Qiu Junming, Su Lei.
Department of Critical Care Medicine, Guangzhou General Hospital of Guangzhou Command ,Guangzhou 510010 , Guangdong, China; *Guangzhou University of Chinese Medicine, Guangzhou 510403, Guangdong, China Correspondingauthor : Su Lei( E-mail : slei _ icu@163.com )
Objective: To observe the effect of proteinase-activated receptor 1 (PAR1) on regulation of Mcl-1 and Bax expression and early apoptosis of human umbilical vein endothelial cells (HUVECs) after heat stress for making clear the role of PAR1 in the apoptosis of HUVECs induced by heat stress. Methods: HUVECs were pretreated with PAR1 inhibitor SCH, PAR1 agonist TFLLR-NH2(TF), PRA1siRNA and PAR1 adenovirus respectively and then received heat stress(42℃)for 2 hours. After 8 hours, the total protein was extracted , the protein expressions of Mcl-1, Bax, caspase 3 and cleaved-caspase 3 were detected, and early apoptosis of the cells was determined by flow cytometry for all the groups. Results: Compared to the normal control group, expressions of Mcl-1, Bax and caspase 3 increased after heat stress, with activation of cleaved-caspase 3 (P<0.05). Compard to the heat stress group,expression of Mcl-1 was up-regulated and Bax down-regulated in the groups of PAR1 inhibitor or PAR1siRNA combined with heat stress (P<0.05), while the activation of cleaved-caspase 3 weakened and the number of early apoptotic cells reduced (P<0.05 or P<0.01). Otherwise, increasing PAR1 expression and PAR1 adenovirus-pretreated combined with heat stress lead to the increase of Bax expression (P<0.05), decrease of Mcl-1 expression (P<0.05),activation of cleaved-caspase-3 and increase in number of apoptotic cells (P<0.05 or P<0.01). Conclusions: Heat stress inducesapoptosis of HUVECs, at the same time the expression of apoptosis-related protein Mcl-1 and Bax could increase. PAR1 plays an important role in promoting apoptosis by regulating expressions of Mcl-1 and Bax.Study on the mechanisms of PAR1 mediating endothelial cell apoptosis contributes to further revealing of the pathological process of endothelial cells in heat stress and also provides a theoretical basis for clinical prevention and treatment of heatstroke.
Heat sress;Human umbilical vein endothelial cells;Apoptosis;Protease-activated receptor 1;Mcl-1;Bax
10. 3969/j. issn. 1672-8521. 2016. 02. 001
2016-02-20)
广东省自然科学基金博士启动项目(S2013040015661);中国博士后科学基金(2014M552180)
苏磊,主任医师(E-mail:slei_icu@163.com)
