辐射诱发叶艺兰形态特征和生理特性差异的研究*
2016-10-25苏畅李枝林任智慧王玉英
苏畅,李枝林,任智慧,王玉英
(云南农业大学 园林园艺学院花卉研究所,云南 昆明650201)
辐射诱发叶艺兰形态特征和生理特性差异的研究*
苏畅,李枝林,任智慧,王玉英
(云南农业大学 园林园艺学院花卉研究所,云南昆明650201)
为阐明辐射诱发兰花变异体的产生,以黄色素花虎头兰与黄蝉兰F1代杂交组培苗经60Coγ射线辐射诱变,且经6次继代培养性状稳定的优良变异株系(叶艺兰株TRIR-2、TRIR-3)和原杂交苗F1代TRIR-1(叶片全绿)为试材,通过组织培养方式研究这3种兰株在形态和生理特性方面的差异。结果显示:与原杂交苗F1 TRIR-1相比,(1)随着叶艺艺象程度增加,植株矮化越明显,艺象最明显植株的生物量、株高、叶长、叶宽和根长都下降,但根数不减,叶片数增多;(2)叶艺植株增强了光合产物可溶性糖的合成,而叶片全绿植物有利于促进蛋白质的合成;(3)植株叶艺艺象越明显,叶绿素含量越低,对光能的利用和调节能力较低,同时植株的膜脂过氧化伤害增强,但叶艺植株能通过调节抗氧化物酶活性来应对。研究表明,辐射诱发了兰花叶艺型突变体新品系,可从中选育出叶艺兰新品种。
辐射;叶艺兰;形态特征;生理特性;60Coγ射线;诱变
兰花是中国的传统名贵花卉,其婀娜多姿的叶片具有很高的观赏价值。叶艺兰(线艺兰)是指兰属(Cymbidium)植株的叶片上镶嵌着金黄色或银白色或浓绿色或朱红色或墨黑的嘴、边、点、线、斑的中国兰统称[1]。叶(线)艺兰品种以墨兰(C.sinense)最多,建兰(C.ensifolium)次之,春兰(C.goeringii)、蕙兰(C.faberi)与寒兰(C.kanran)较少,其栽培历史已有千年之久,被誉为“花中君子”,是珍贵的观赏花卉[2]。叶(线)艺最早流行于日本,培育出了‘加冶屋’、‘真鹤’、‘瑞玉’等许多叶(线)艺兰品种。在中国大陆流行则是近几十年的事,虽然起步较迟,但发展迅猛,奇花、奇叶和矮种等各种变异类型层出不穷,市场前景十分广阔。叶艺兰由于叶片艳丽,形态优美,在国内外有极高声誉,被誉为珍贵名花,很受市场欢迎。
只有兰花遗传基因产生变异才能出现真正的叶(线)艺兰,为可遗传的变异,艺性才能够世代稳定遗传[3]。
辐射诱变育种是一种常用的育种手段,可以创造更多的叶艺类型,目前已在月季、菊花、美人蕉、大丽花、叶子花、荷花[4],以及多种兰属植物[5~7]上应用,并获得了多种突变体,主要特征表现为植株失绿。近年来,国内许多科学家用缺乏叶绿素的突变体为材料,对其遗传性、突变体与野生型材料在光合色素的组成、叶绿体结构、功能、蛋白质组分等方面的差异进行了一系列的研究[8~10]。但对兰属植物辐射诱发叶艺兰形态特征与生理特性差异研究未见报道。因此本文以课题组经辐射诱发的叶艺兰突变体与野生型为试材,通过测定分析植株的形态特征与生理特性方面的差异,为阐明辐射诱发了兰花叶艺型变异体的产生奠定理论依据,对指导兰属其他种和变种的人工叶艺新品系的育成具有重要的参考价值。
1 材料与方法
1.1供试材料
供试材料为TRIR-1、TRIR-2和TRIR-3的组培苗(图1)。将黄色素花虎头兰(C.tracyanum)与黄蝉兰(C.iridioides)杂交,获得F1杂交苗,之后通过外观形态筛选出性状稳定、一致的F1代株系(TRIR-1),在云南华源辐射有限公司进行60Coγ射线剂量23.6Gy,剂量率为1 Gy/min,急性照射后,培育2年,发现数株叶艺株系,再经过6年的组培培养,继代10次后,获得2个性状稳定的叶艺兰新品系。一个品系为叶片上的绿色与白色相间,面积基本对等,命名为TRIR-2;另一个品系为叶尖和叶边缘为绿色,叶片其他部位是白色,其叶艺部分观赏价值较高、叶形较为优美,命名为TRIR-3。

图1野生型和辐射诱变的叶艺兰植株
Fig.1Plants of wild type and irradiationCymbidiumwith verge line pattern leaves
1.2材料处理
试验于2013年5月在云南农业大学花卉研究所实验室内进行。在相同的培养时间和培养环境的条件下,在1/2 MS+NAA 1.0mg/L+ 0.1%活性碳的固体培养基中,分别选择植株大小大致相等,叶片数和植株高度、叶色相当的TRIR-1、TRIR-2和TRIR-3组培苗。每组苗设置3个重复,并对植株进行编号。取由基部向上数的第3~5片叶2g,液氮速冻保存于置于-80℃冰箱保存备用,用于测定叶绿素、丙二醛(MDA)、可溶性蛋白、可溶性糖含量及超氧化物歧化酶活性(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性。
1.3测定指标及方法
1.3.1 形态指标测定
用上述选择处理植株的方法,选出另外9个植株。用直尺和天平分别测定单株植株的株高、叶片数、叶长、根长、根数和鲜重。
1.3.2生理指标
叶绿素含量测定采用分光光度计比色法[11];超氧化物歧化酶活性(SOD)采用氮蓝四唑(NBT)法[12],抗坏血酸过氧化物酶(APX)采用陈建勋等的方法进行[12];过氧化物酶(POD)活性采用愈创木酚法[13]、过氧化氢酶(CAT)活性采用Acbi等的方法进行测定[14]。丙二醛含量参照Madhava等[15]的硫代巴比妥酸(TBA)法测定;可溶性蛋白质含量参照Read等[16]考马斯亮蓝法测定;可溶性糖含量参照采用赵可夫[17]蒽酮比色法测定。
1.4数据分析
数据采用大型统计软件SPSS(Inc.,Chicago,IL,USA)的方差分析(ANOVA)和Duncan的多重比较法进行分析,用Excel 2003制图。
2 结果与分析
2.1辐射诱变的叶艺兰植株形态特征差异
由表1可知,TRIR-1、TRIR-2和TRIR-3植株在株高、叶长、叶宽、根长和鲜重方面存在差异。TRIR-1植株的株高分别显著高于TRIR-2和TRIR-3植株21.2%和177.7%(P<0.05)。TRIR-1植株的叶长、叶宽、根长和鲜重分别显著高于TRIR-3植株的161.5%、112.2%、74.90%和193.1%(P<0.05);同时TRIR-1植株的叶长、叶宽、根长和鲜重与TRIR-2植株差异不显著(P>0.05)。TRIR-3植株的叶片数显著高于TRIR-1植株33.3%(P<0.05);TRIR-1 、TRIR-2和TRIR-3植株的根数无差异显著性(P>0.05)。以上结果表明随着叶艺艺象程度的增加,植株矮化越明显,艺象最明显植株的鲜重、株高、叶长、叶宽和根长都下降,但根数不减,叶片数增多,这可能是叶艺艺象程度最高的植株能生长发育的重要原因之一。

表1 辐射诱变的叶艺兰形态特征
注:同列不同字母表示处理间在0.05水平存在显著性差异;下同。
2.2辐射诱变的叶艺兰植株叶绿素含量差异
由表2可知,全绿植株TRIR-1的叶绿素a、叶绿素b、叶绿素a+b含量分别显著高于TRIR-2和TRIR-3植株100%和125.3%、77.8%和144%、93.2%和129.6%(P<0.05);叶艺植株TRIR-3的叶绿素a/b显著高于TRIR-1和TRIR-2植株12.6%和26.7%(P<0.05),TRIR-1和TRIR-2植株的叶绿素a/b差异不显著(P>0.05)。以上结果说明植株艺象越明显,叶绿素含量越低,这与叶艺植株表观呈现的绿色一致。
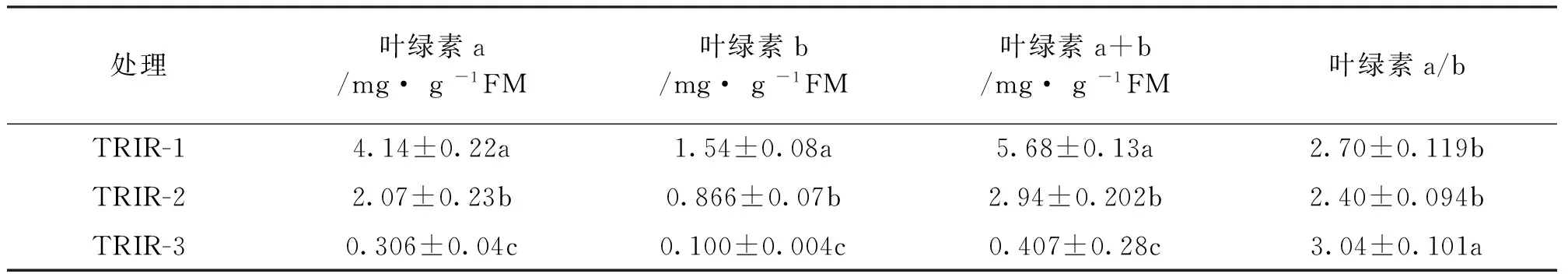
表2 辐射诱变的叶艺兰植株叶绿素含量差异
2.3辐射诱变的叶艺兰植株可溶性糖和蛋白含量差异
由图2A可知,TRIR-2植株的可溶性糖含量分别显著高于TRIR-1和TRIR-3植株74.0%和61.3%(P<0.05),TRIR-1和TRIR-3的植株可溶性糖含量差异不显著(P>0.05);由图2B可知,TRIR-1植株的可溶性蛋白质含量均显著高于TRIR-2和TRIR-3植株的53.9%和191.2%(P<0.05),TRIR-2植株的可溶性蛋白质含量显著高于TRIR-3植株的89.3%(P<0.05)。说明全绿植物在光合作用中,更利于促进蛋白质的合成;叶片上的绿色与白色相间,面积基本对等的植株有利于可溶性糖的合成;叶片叶艺艺象程度最高的植株TRIR-3合成的光合产物量较低。
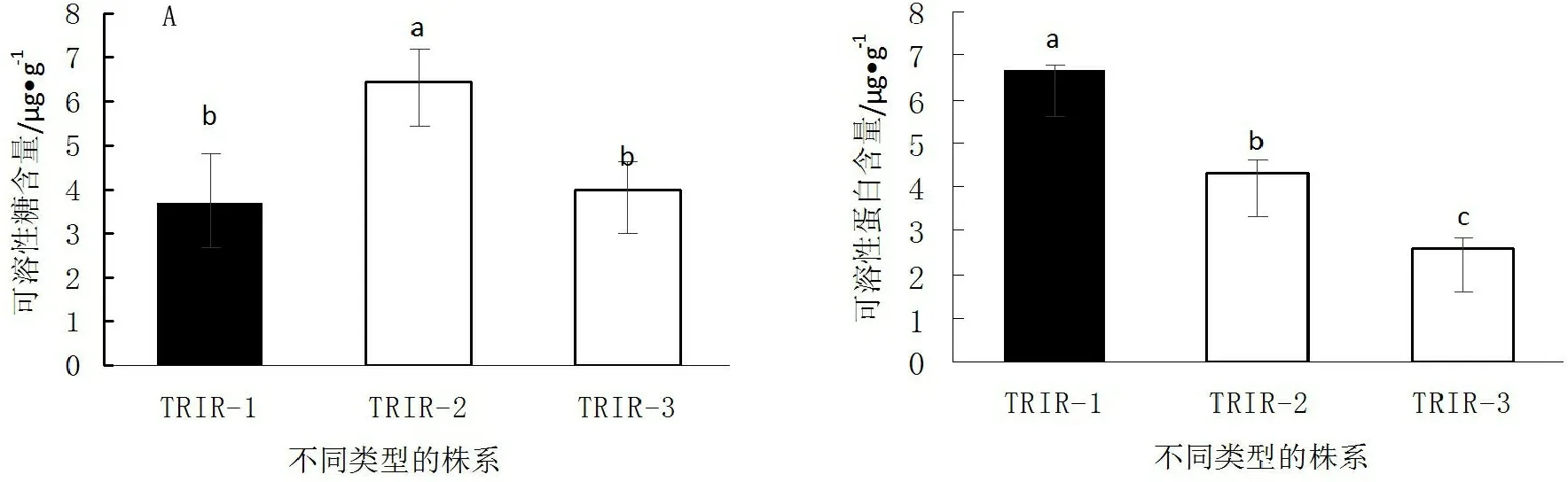
图2辐射诱变的叶艺兰可溶性糖(A)和蛋白含量(B)
Fig.2Total soluble protein (A) and sugar content (B) of irradiationCymbidiumwith verge line pattern leaves
2.4辐射诱变叶艺兰MDA和H2O2含量及抗氧化物酶活性差异
由图3可知,TRIR-1、TRIR-2和TRIR-3植株的MDA和H2O2含量及抗氧化物酶活呈现一致上升的趋势。TRIR-3植株的MDA和H2O2含量,以及SOD、POD、CAT和APX酶活分别显著高于TRIR-1和TRIR-2植株51.5%和33.0%、35.8%和17.7%、18.8%和7.9%、31.5%和9.1%、22.8%和9.1%及60.0%和8.7%(P<0.05)。表明随着叶艺艺象程度增强,植株的膜脂过氧化伤害增加,但植株能通过调节增强抗氧化物酶活性来应对。
3 讨论
变异是生物进化的基础推动力,人为地利用这种方式,用尽可能小的影响基础生命代谢的方式最大限度地追求对物种变异的加速,正是诱导变异的研究目的[15~16],辐射诱变是常用的人为诱导变异手段。陈华等[18]报道的国兰辐射诱变产生出叶片短小型、线艺叶等不同的变异类型和张志胜等[19]用秋水仙素处理墨兰和大花蕙兰(C.hyridus)的杂交F1种子诱导的原球茎,发现变异植株的类型包括植株粗壮、多叶、植株矮化、线艺和叶艺等一致。本文的供试材料是经辐射诱变后再经过6年的组培继代培养,特异性状稳定的叶艺新品系,叶艺兰株同样出现了鲜重、株高、叶长、叶宽和根长降低,植株矮化等现象;同时叶艺艺象程度越高的植株,叶片数显著增加的现象。
光合作用是在叶绿体内进行的,叶绿素对光合作用过程是必不可少的。植物叶片呈现出的绿色是由含于植物叶细胞中的叶绿素产生的[20],而叶绿素在绿色植物中主要包含叶绿素a和b[21]。植物体内的叶绿素在不断地合成和分解中,而在不利条件下,叶绿素的分解速度会大大超过合成的速率,从而使光合作用受到抑制,叶片出现各种伤斑,阴生植物中叶绿素a/b的值要高于阳生植物[22]。范燕萍等[9]报道墨兰3个叶片绿黄组成的花叶线艺兰品种金嘴、阳明锦和大石门叶片色素组成,表明线艺兰叶斑的形成与叶绿素的质量分数有直接的关系。本实验结果表明叶艺植株表观呈现的绿色面积与叶绿素含量一致,这可能由于叶艺艺象程度较高植株的叶绿素分解速度超过了合成速度;同时叶艺艺象最高植株TRIR-3的叶绿素a/b值高,表明在栽培生长过程中,叶艺艺象最高植株TRIR-3较TRIR-1和TRIR-2植株耐阴。
可溶性糖和可溶性蛋白是多种植物的渗透调节剂,也是高等植物的主要代谢产物之一[23]。可溶性糖既是高等植物的主要光合产物,又是碳水化合物代谢和暂时贮藏的主要形式,在植物碳代谢中占有重要位置,可溶性糖的变化大致反映了该植株的碳素营养代谢状况。本实验结果表明叶片上的绿色与白色相间,面积基本对等的TRIR-2组培苗,增强了光合产物可溶性糖的合成;而全绿TRIR-1植株更利于促进蛋白质的合成。这可能是由于植株发生诱变时诱发植物体内的自由基,导致植物体内蛋白质和脂类等物质聚合,交联和过氧化作用使它们的结构功能发生变化,引起植物的生理功能发生变化[24]。

图3辐射诱变的叶艺兰MDA(A)和H2O2(B)及SOD(C)、POD(D)、CAT(E)和APX(F)活性
Fig.3MDA(A),H2O2(B),SOD(C),POD(D),CAT(E) and APX (F)of irradiation cymbidium with verge line pattern leaves
绿色植物在进行光合作用时,由于光合电子传递链总会发生一定程度的电子泄漏,将电子传递给分子O2,从而产生ROS,当细胞内的防御系统无法阻止ROS自增长的自动氧化反应时,细胞将受伤和死亡[25]。MDA是膜脂过氧化产物之一,当植物处于逆境胁迫时,膜脂过氧化加重,MDA含量增加,它是一个反映膜脂过氧化伤害的重要指标[26~27],H2O2是植物叶绿体中光合电子传递链和某些酶反应的天然产物,是具有毒害作用的活性氧[28]。SOD、POD、CAT及APX是植物抗氧化酶,是防御膜脂过氧化的主要酶[29~30],主要作用是清除植株体内的活性氧自由基,当其作用失衡时将会导致膜质过氧化产物的积累[31],研究表明MDA、O2-和H2O2等活性氧自由基含量与细胞内清除活性氧的保护系统呈负相关[32]。本实验结果表明,随着叶艺艺象程度的增加,叶艺兰株的MDA和H2O2含量显著增强。说明辐射诱变的叶艺兰生产了逆境胁迫,并且随着叶艺艺象程度的增加,同时叶艺兰株在逆境中能通过抗氧化酶有效地清除活性氧,来应对活性氧累积造成的伤害。
4 结论
60Coγ辐射诱发了叶艺兰的产生,并且叶艺兰株系在形态特征和生理特性方面表现出了与野生型明显的差异性,有利于叶艺兰新品种的选育,同时为指导兰属其他种和变种的人工叶艺新品系的育成奠定基础。
[1]李丽,罗君琴,聂振鹏,等.线艺兰的组织培养及植株再生研究[J].浙江农业科学,2008(6):679-681.
[2]卢思聪.中国兰与洋兰[M].北京:金盾出版社,1994:34-39.
[3]王元东,赵久然,郭景伦,等.诱变育种在创造玉米新种质中的应用[J].北京农业科学,1999,17(2):2-16.
[4]陈子元.从辐射育种的发展来展望航天育种的前景[J].核农学报,2002,16(5):261-265.
[5]彭绿春,黄丽萍,余朝秀,等.四种兰花辐射育种研究初报[J].云南农业大学学报,2007,22(3):332-336.
[6]傅雪琳,张志胜,何平.60Coγ射线辐射对墨兰根状茎生长和分化效应研究[J].核农学报,2000,14(6):333-336.
[7]蒋彧,何俊蓉,刘菲,等.60Coγ辐射兰花春剑隆昌素根状茎分化苗的ISSR分析[J].核农学报,2013,27(9):1247-1252.
[8]许培磊,范书田,赵滢,等.金心吊兰两色组织的叶绿素荧光参数比较[J].吉林农业大学学报,2013,35(3):269-272.
[9]范燕萍,李慧玲,李浩健.几种花叶线艺兰叶片色斑色素组成和叶绿体超微结构研究[J].华南农业大学学报,2006,27(2):8-12.
[10]石乐娟.线艺春兰再生体系的优化及组织结构解剖学的研究[D].杭州:浙江大学,2006.
[11]张宪政,陈凤玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1994:66-69.
[12]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002:119-120.
[13]Tan W,Liu J,Dai T,etal.Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to post-anthesis water-logging [J].Photosynthetica,2008,46: 21-27.
[14]Acbi H.Catalaseinvitro[J].Methods in Enzymology,1984,105:121-126.
[15]Madhava Rao K V,Sresty T V S.Antioxidative parameters in the seedlings of pigeon pea (Cajanuscajan(L.)Millspaugh) in response to Zn and Ni stresses [J].Plant Science,2000,157: 113-128.
[16]Read S M,Northeote D H.Minimization of yariation in the response to different protein of the coomassic blue G dye-blinding for protein [J].Analytical Biochemistry,1981,116:53-64.
[17]赵可夫.植物抗盐生理[M].北京:中国科学技术出版社,1993:22-24.
[18]陈华,林兵,潘宏.国兰辐射诱变效应研究初报[J].福建农业科技,2005(4):24-25.
[19]张志胜,谢利,萧爱兴,等.秋水仙素处理兰花原球茎对其生长和诱变效应的影响[J].核农学报,2005,19(1):19-23.
[20]Bernard S Meyer,Donald B Anderson.Plant Physiology[M].Toronto:D.Van Nostrand Company,Inc,1952:293.
[21]潘瑞炽,董愚得.植物生理学(上册)[M].北京:人民教育出版社,1979:81.
[22]王洪成,吕庆元,李博,等.汽车尾气胁迫对叶片叶绿素含量和叶绿素a/b值的影响[J].中国林副特产,2014,130(3):28-31.
[23]赵江涛,李晓峰,李航,等.可溶性糖在高等植物代谢调节中的生理作用[J].安徽农业科学,2006,34(24):6423-6425,6427.
[24]李夏.寒兰离体化学诱变研究[D].南昌:南昌大学,2007.
[25]Milier G,Shulaev V,Mittler R.Recative oxygen signaling and abiotic stress[J].Physiol.Plant,2008,133:481-489.
[26]Gunes A,Inal A,Alpaslan M,etal.Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition in maize(ZeamaysL.) grown under salinity[J].journal of plant physiology,2007,164:728-736.
[27]Miller G,Suzuki N,Ciftci-Yilmaz S,etal.Reactive oxygen species homoestasis and signaling during drought and salinity stresses [J].Plant Cell Environ,2010,33:453-467.
[28]李光远,王凤华.植物维生素C过氧化物酶研究进展[J].现代生物医学进展,2008(8):6.
[29]Apel K,Hirt H.Reactive oxygen species: metabolism,oxidative stress,and signal transduction [J].Annual Review of Plant Biology,2004,55: 373-399.
[30]Chen Q,Zhang X D,Wang S S,etal.Transcriptional and physiological changes of alfalfa in response to aluminum stress [J].Journal of Agricultural Science,2011,149(4):737-751.
[31]王玉英,徐慧妮,陈丽梅,等.硝酸盐水平对芹菜幼苗生理及生长特性的影响[J].西北植物学报,2012,32(6):1171-1178.
[32]杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001,17(2):121-125.
Morphology and Physiological Characteristics of Cymbidium tracyanum×C.Iridioides D.Don with Variegation Leaves Induced by Irradiation
SU Chang,LI Zhi-lin,REN Zhi-hui,WANG Yu-ying
(Yunnan Agricultural University College of Horticulture and Landscape,Kunming Yunnan 650201,P.R.China)
For expounding to expound the production mutants ofCymbidiuminduced by irradiation,the tissue culture seedlings ofCymbidiumtracyanum×C.iridioidesD.Don were irradiated by60Coγ-rays,and the new mutant TRIR-2 and TRIR-3 were selected through 6-generation observation.The results showed that:(1) With the degree of verge line pattern leaves increased,the heights,biomass,leaf length,leaf width and root length of the seedlings decreased except the number of root,but the number of leaf increased.(2)The seedlings of verge line pattern leaves enhanced the synthesis of soluble sugar,and the all green seedlings were more inclined to the synthesis of soluble protein during photosynthesis.(3) When the verge line pattern leaves was more obvious,the content of chlorophyll,and the utilization and adjustment ability of light energy became lower,while the damage of membrane lipid peroxidation was more serious,but the seedlings could response by adjusting the antioxidation enzyme activity.Research suggests thatCymbidiumwith verge line pattern leaves induced by irradiation,and could breed new variety.
irradiation;Cymbidiumwith variegation leaves;morphological characteristics;physiological characteristics;60Coγ-rays;induce
10.16473/j.cnki.xblykx1972.2016.03.007
2015-11-16
国家自然科学基金项目(30160074),云南省自然科学基金重点项目(2002C0003P),云南省重点新产品开发项目(2012BB008),
苏畅(1989-),女,硕士研究生,主要从事园艺植物资源的利用及创新研究。E-mail:515718100@qq.com
简介:王玉英(1980-),女,讲师,博士,硕士生导师,主要从事植物资源的利用和创新研究。E-mail:wyysxp@126.com
S 682.31
A
1672-8246(2016)03-0038-06
云南农业大学园林园艺学院院级基金(2014001),云南省昆明市科学技术局重点项目(2015-1-N-00984)。
