过氧化物酶体增殖物激活受体β在老龄脓毒血症大鼠肺部炎症中的作用
2016-10-25周国鹏
曾 增 周国鹏
(北京大学第一医院老年科,北京 110034)
过氧化物酶体增殖物激活受体β在老龄脓毒血症大鼠肺部炎症中的作用
曾增周国鹏
(北京大学第一医院老年科,北京110034)
目的探讨激活过氧化物酶体增殖物激活受体(PPAR)-β对老龄脓毒血症大鼠模型肺部炎症、炎症指标及死亡率的影响。方法选用24月龄雄性SD大鼠,通过盲肠结扎穿孔(CLP)手术建立脓毒血症模型,予GW501516 0.25、0.75 mg/kg为低、高剂量组。分别液体复苏CLP术后大鼠,与空白对照组、单纯CLP手术组比较24、48 h死亡率,运用HE染色、免疫组化染色及RT-PCR等方法了解肺组织中PPAR-β及Akt-1、核转录因子(NF)-κB、白细胞介素(IL)-6的表达。结果(1)24 h死亡率:单纯手术组42.1%,低剂量组10%,高剂量组20%;48 h死亡率:单纯手术组27.3%,低剂量组16.7%,高剂量组50%。(2)RT-PCR:CLP术后24 h PPAR-β表达下调,使用GW501516后上调PPAR-β表达。CLP手术打击可上调IL-6、NF-κB炎症因子表达量,使用GW501516后IL-6、NF-κB表达量下调,Akt-1表达量上调。(3)HE染色:CLP手术打击后肺组织中大量炎性细胞浸润、肺间质水肿充血,GW501516处理组肺部炎性细胞浸润、间质水肿减轻。(4)免疫组化:使用GW501516后肺组织中PPAR-β阳性细胞增多。结论低剂量GW501516(0.25 mg/kg)可降低脓毒血症老龄大鼠早期死亡率,其机制与激活Akt-1、下调NF-κB有关。
脓毒血症;过氧化物酶体增殖物激活受体-β;生物分子信号通路
过氧化物酶体增殖物激活受体(PPARs)是配体激活的转录因子,分为PPAR-α、PPAR-β和PPAR-γ三种亚型,其中PPAR-β可能参与调节体内多种与代谢和炎症相关疾病的病理生理过程〔1〕。脓毒血症发生时,肺部是全身炎症反应的始动器官,其中急性肺损伤(ALI)/呼吸窘迫综合征(ARDS)的发生率高达25%~44%〔2,3〕。脓毒血症致ALI/ARDS发病机制复杂,死亡率高,死亡的主要原因多为多器官衰竭;年龄增高也是导致死亡率增高的重要原因〔3〕。PPAR-β活化是否参与肺部炎症反应调控的研究较少,尤其缺乏关于老年群体的研究。本文通过盲肠结扎穿孔(CLP)的方法建立老龄大鼠脓毒血症模型,观察PPAR-β及相关指标在肺组织的表达。
1 材料与方法
1.1材料
1.1.1动物从北京大学医学部实验动物中心购得雄性SD大鼠。大鼠购进时为3月龄,于实验动物中心饲养至24月龄进行实验。饲养期间使用标准饲料,不限食水,保持12∶12 h昼夜规律。所有动物实验均经过北京大学实验动物委员会批准。
饲养至24月龄时,SD大鼠存活46只,随机分为非CLP手术对照组(CON组,n=5)、CLP手术组(CLP组,n=19)、CLP手术+低剂量激动剂干预组(CLP-LD组,n=10)、CLP手术+高剂量激动剂干预组(CLP-HD组,n=10)、单纯高剂量激动剂干预48 h组(NO-CLP-HD-48组,n=2)。其中CLP、LD、HD组内再分为术后24 h观察组及48 h观察组(CLP-24组,n=8;CLP-48组,n=11;CLP-LD-24组,n=4;CLP-LD-48组,n=6;CLP-HD-24组,n=4;CLP-HD-48组,n=6)。
1.1.2试剂常用普通化学试剂均为市售分析纯;高纯总RNA快速提取试剂盒(离心柱型)(北京百泰克生物技术有限公司);逆转录试剂盒(美国Fermentas公司);引物(北京奥科鼎盛生物科技有限公司);RT-PCR反应体系(Taq酶,dNTP等)(北京全式金生物技术有限公司);普通PCR反应体系(Taq酶,dNTP等)(北京康为世纪生物科技有限公司);辣根过氧化物酶标记的山羊抗兔IgG(北京中山金桥公司);GW501516(Enzo Life Sciences Inc)。
1.2建模雄性SD大鼠于术前6 h停止进食水。术前称重,予3%戊巴比妥钠(1 ml/kg体重)腹腔麻醉。麻醉完成后,将大鼠仰卧位固定于操作台上。建立CLP模型:(1)下腹部备皮,75%酒精局部消毒。(2)行下腹中线切口(3~4 cm),逐层进入腹腔。(3)确认并分离盲肠。(4)结扎盲肠。(5)使用20 ml针头从两侧串通结扎后盲肠造成人为肠穿孔。(6)盲肠还纳腹腔。(7)逐层关腹。(8)按照表1于大鼠背部皮下注射进行液体复苏(37℃,5 ml/100 g体重)。(9)建模完成后将各组老龄大鼠分开放回笼中让其自由饮食。

表1 液体复苏溶液组分
1.3标本采集各组实验动物在预定时相点予3%戊巴比妥钠(1 ml/kg体重)腹腔注射麻醉后固定。打开胸腔,心脏穿刺放血处死。取右肺下叶,4%多聚甲醛固定后,石蜡包埋切片,留做病理学检查及免疫组化染色。取右肺上叶组织约100 mg,放入1.5 ml去RNA酶EP管,液氮冻实后放入-80℃冰箱保存,留做提取RNA用。
1.4RT-PCR将所取标本按照试剂盒说明书提取RNA、逆转录,应用生物学软件Primer3.0设计引物。引物序列:PPAR-β正义链GTGTCAGTACTGCCGCTTCCA,反义链CTCCGGCATCCTTCCAAAG,目的片段长度100 kD,退火温度60℃;Akt-1正义链CTGTGGCTGATGGACTCAAA,反义链CCTCAGCACCTGAGTTGTCA,目的片段长度84 kD,退火温度59℃;NF-κB正义链CCTTCTAAAGGCTGGTGCTG,反义链ATGGCCTCGGAAGTTTCTTT,目的片段长度136 kD,退火温度59℃;β-actin正义链AGCCATGTACGTAGCCATCC,反义链GCTGGGTGGTGAAAGCTGTA,目的片段长度222 kD,退火温度59℃。运用MJ Research公司的Opticon实时荧光定量PCR仪进行PCR扩增,程序:95℃预变性5 min;循环35次:90℃变性30 s,58℃~60℃退火30 s,72℃延伸30 s;72℃延伸10 min。以管家基因β-actin的表达为内参照,用扩增基因/β-actin的灰度比值对该基因的表达进行半定量。
1.5肺组织HE染色及PPAR-β免疫组化染色
1.5.1肺组织HE染色将切片标本逐个经过以下试剂:二甲苯(5 min×3次)、100%乙醇(3 min×3次)、95%乙醇(3 min)、90%乙醇(3 min)、80%乙醇(3 min)、70%乙醇(3 min)、双蒸水(5 min)、双蒸水(5 min)。之后苏木素染核30 s,自来水终止,酒精盐酸分色,依红染色。运用梯度酒精分色、透明后,中性树胶封片,37℃恒温箱烘干,显微镜下观察、照相。
1.5.2PPAR-β免疫组化染色将切片标本逐个经过以下试剂:二甲苯(5 min×3次)、100%乙醇(3 min×3次)、95%乙醇(3 min)、90%乙醇(3 min)、80%乙醇(3 min)、70%乙醇(3 min)、双蒸水(5 min)、双蒸水(5 min),3%双氧水溶液避光浸泡10 min,阻断内源性过氧化物酶的活性。0.01 mol/L磷酸盐缓冲液(PBS)漂洗3次,每次5 min。抗原热修复。0.01 mol/L PBS溶液漂洗3次,每次5 min。用滤纸将水分吸干,1%牛白蛋白封闭,室温放置30 min。滤纸将水分吸干,加一抗,放入湿盒中4℃过夜。0.01 mol/L PBS溶液漂洗3次,每次5 min。用滤纸将水分吸干,滴加二步法试剂盒中的试剂2(标记有辣根过氧化物酶的抗兔的一种结合兔来源的一抗),放入37℃孵育30 min。0.01 mol/L PBS溶液漂洗3次,每次5 min。用滤纸吸干水分,滴加显色液二氨基联苯胺(DAB),显微镜下观察显色情况,双蒸水终止反应。苏木素染核30 s,盐酸酒精分色3~5 s,自来水冲洗反蓝。梯度酒精脱水、透明。中性树胶封片,37℃恒温箱烘干,显微镜下观察、照相。
1.6统计学方法应用GraphPad Prism 5.0软件,各组间比较使用one way ANOVA检验或t检验,不符合条件的使用nonparametric检验。各组间死亡率比较使用χ2检验,不符合条件的使用Fisher检验。
2 结 果
2.1死亡率CLP术后24 h观察点,CLP组术后24 h内死亡8只(42.1%);使用不同剂量GW501516盐水复苏后,CLP-LD组24 h内死亡1只(10.0%),CLP-HD组24 h内死亡2只(20.0%)。以CLP术后48 h观察点,CLP-48组48 h内共死亡3只(27.3%);CLP-LD-48组48 h内死亡1只(16.7%),CLP-HD-48组48 h内死亡3只(50.0%)。
2.2肺组织HE染色见图1。CLP手术打击后肺组织中大量炎性细胞浸润、肺间质水肿充血,GW501516处理组肺部炎性细胞浸润、间质水肿减轻。
2.3PPAR-β免疫组化染色结果见图2。使用GW501516后肺组织中PPAR-β阳性细胞增多。
2.4RT-PCR结果见表2。CLP术后24 h PPAR-β表达下调,使用GW501516后上调PPAR-β表达。CLP手术打击可上调白细胞介素(IL)-6、核转录因子(NF)-κB等炎症因子表达量,使用GW501516后IL-6、NF-κB表达量下调,Akt-1表达上调。见表1。

图1 老龄大鼠肺组织HE染色(×400)

图2 老龄大鼠肺组织PPAR-β免疫组化染色(×200)
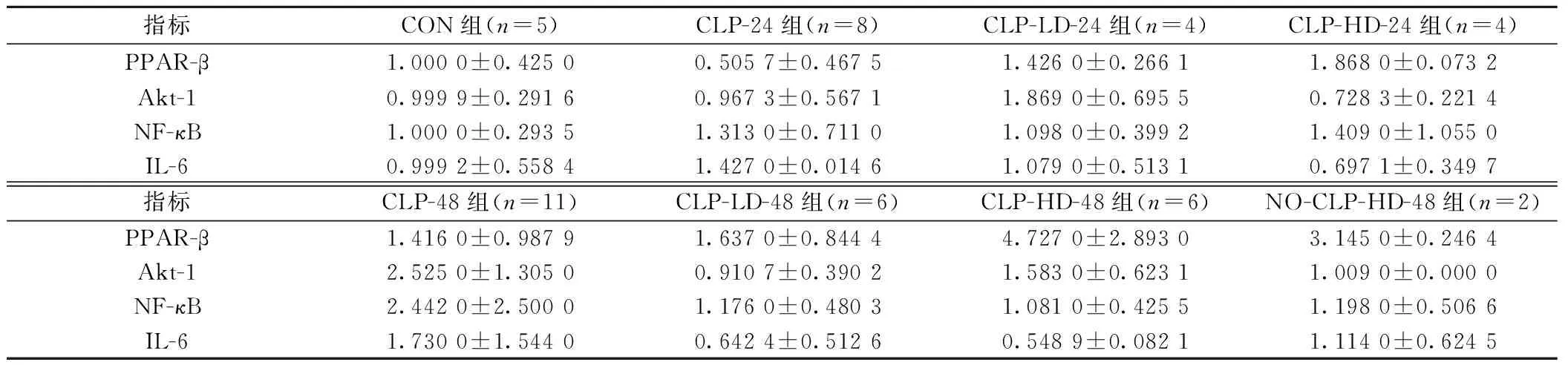
指标CON组(n=5)CLP-24组(n=8)CLP-LD-24组(n=4)CLP-HD-24组(n=4)PPAR-β1.0000±0.42500.5057±0.46751.4260±0.26611.8680±0.0732Akt-10.9999±0.29160.9673±0.56711.8690±0.69550.7283±0.2214NF-κB1.0000±0.29351.3130±0.71101.0980±0.39921.4090±1.0550IL-60.9992±0.55841.4270±0.01461.0790±0.51310.6971±0.3497指标CLP-48组(n=11)CLP-LD-48组(n=6)CLP-HD-48组(n=6)NO-CLP-HD-48组(n=2)PPAR-β1.4160±0.98791.6370±0.84444.7270±2.89303.1450±0.2464Akt-12.5250±1.30500.9107±0.39021.5830±0.62311.0090±0.0000NF-κB2.4420±2.50001.1760±0.48031.0810±0.42551.1980±0.5066IL-61.7300±1.54400.6424±0.51260.5489±0.08211.1140±0.6245
3 讨 论
脓毒血症发生后,肺外炎性介质通过循环系统进入肺内,导致肺血管充血,血管内皮细胞损伤,血管通透性增加及单核细胞、淋巴细胞、多核细胞、血小板等炎性细胞聚集,进而引起肺小血管的充血和肺间质水肿,导致肺泡萎陷。这一病生理过程与许多信号传导通路有关,目前研究证实〔4~6〕,NF-κB信号通路、Janus激酶/信号传导-转录活化因子通路、P38MAPKs通路、PI3K/PKB信号通路均在这一过程中起调控作用。本实验选用GW501516作为PPAR-β的激动剂,结果提示使用GW501516后,肺组织中PPAR-β含量较空白对照组升高,提示激动剂起效。
PPARβ/δ在体内广泛分布,其功能目前仍然不详。现有的研究表明它和脂质代谢、骨代谢、肿瘤、生殖、脑发育及炎症等有关〔7〕,可能参与调节体内多种与代谢和炎症相关的疾病的病理生理过程。目前的研究提示,PPAR-β在炎症反应中可能主要通过NF-κB通路、p38MAPK信号通路及PI3K-Akt信号通路共同调控炎症因子的表达,调控炎症反应的进程〔4~6〕。
Kapoor等〔4〕采用注射内毒素的方法建立小鼠脓毒血症模型,结果发现,给予PPAR-β激动剂GW0742后,与单纯手术处理的组别比较,小鼠肺部炎症反应减轻,炎症因子释放减少,生存率增加,其机制可能与激活Akt及抑制GSK-3β和NF-κB有关,且NF-κB的下调可能通过MAPK-ERK1/2信号通路调控。另一项研究发现〔8〕,给予PPAR-β激动剂GW0742处理内毒素注射诱发的肺炎小鼠,可以明显减少肺部白细胞聚集浸润,降低IL-6、IL-1β及TNF-α的表达。Fan等〔9〕用PPAR-β激动剂处理人原代脐静脉内皮细胞发现,给予PPAR-β激动剂后可明显抑制内皮细胞黏附分子的表达及白细胞的聚集,减少氧化应激,但NF-κB并不被抑制。以上研究都提示,PPAR-β具有抗炎作用,但其抗炎的机制目前尚存争议。本实验通过CLP方法建立脓毒血症模型,此模型的发病机制除了内毒素造成以外,还包括肠道其他细菌毒素的致伤作用及手术打击等,模型病情较重,肺部病理损害明显〔10〕,发病过程和病理表现与危重监护室(ICU)老年脓毒血症病人ALI/ARDS的特点类似。
IL-6在炎症刺激下由多种细胞释放,介导急性时相反应,刺激肝细胞合成急性反应蛋白〔11〕,本实验结果显示CLP手术处理后,老龄大鼠肺组织中IL-6 mRNA含量较空白对照组呈上调趋势,且从肺组织HE染色结果可以看出,CLP术后24 h肺组织内大量炎症细胞浸润,肺间质水肿、充血,说明CLP手术后老龄大鼠体内炎症反应模型建立。有学者认为IL-6能较为可靠的反映肺组织局部损伤的程度〔12〕。本实验结果也提示,激活PPAR-β后可以下调IL-6,脓毒血症致老龄大鼠肺部炎症反应减轻。本文死亡率结果提示PPAR-β活化后,通过下调IL-6,可降低脓毒血症致肺部炎症的老龄大鼠早期死亡率,这种对死亡率的影响尤其以低剂量组明显。
NF-κB在ARDS的发病中起重要作用,与机体非特异性免疫反应具有密切关系,广泛参与炎症介质(TNF-α、IL-1、IL-6)、黏附分子(ICAM-1、VCAM-1和ELAM-1)、趋化因子和一些炎性相关酶类(基质金属蛋白酶、环氧化酶和一氧化碳合酶)等基因的调控;而TNF-α、IL-6等又能作为NF-κB的调节产物激活NF-κB,从而形成能不断延续并逐级放大炎症反应的调节环路〔13〕,导致瀑布效应,导致全身炎症反应综合征的发生,进而造成包括ALI/ARDS在内的多器官衰竭。Blackwell等〔13〕通过腹腔内注射内毒素建立SD大鼠ARDS模型,并运用凝胶电泳迁移率改变法检测肺泡灌洗液中NF-κB的活性,发现注射内毒素后1 h NF-κB显著升高,在2.5 h及7 h均恢复正常水平;而对照组中核蛋白中仅有少量NF-κB。Blackwell还检测了注射内毒素小鼠的肺泡巨噬细胞和肺组织中NF-κB的活性,在这些细胞和组织中均可检测到高活性的NF-κB。提示早期运用拮抗NF-κB活化的药物可以有效控制全身急性炎症反应,改善病情和预后。本实验结果提示,运用低剂量GW501516激活PPAR-β后,可通过下调IL-6等促炎因子,进一步下调NF-κB表达,减低瀑布效应,从而起到抗炎作用,降低老龄大鼠死亡率,此结果与Kapoor等〔4〕的实验结论一致。
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路是细胞内重要信号转导通路之一,由PI3K家族与其下游分子丝氨酸/苏氨酸蛋白激酶Akt或蛋白激酶B(PKB)组成,该通路广泛存在于细胞中,参与细胞增殖、凋亡及分化等功能的调控。活化的Akt激活或抑制其下游靶蛋白Bad、Caspase9、NF-κB、GSK-3、FKHR、p21Cip1和p27Kip1等,进而调节细胞的增殖、分化、凋亡以及迁移等。磷酸化后的Akt可通过调控激活IKKα复合体还可影响NF-κB的活化。Akt活化后,可以下调GSK-3β的表达从而抑制葡萄糖代谢;还可下调Bad的表达,促进细胞凋亡。由此看出,Akt活化后在炎症反应、免疫反应、细胞增殖、细胞凋亡等多种生物过程中发挥重要作用。有实验显示〔14〕,急性肺损伤时肺组织中磷酸化Akt表达减少,肺组织中髓过氧化物酶活性增加。 本实验结果显示,使用低剂量GW501516处理脓毒血症致老龄大鼠肺部炎症后,在早期降低死亡率与上调Akt-1的表达有关,此结果与Kapoor等〔4〕的结论一致。
综上,低剂量GW501516(25 μg/100 g体重)可降低脓毒血症致肺部炎症老龄大鼠早期死亡率,其机制可能与激活PPAR-β后上调Akt-1、下调NF-κB从而减轻肺部炎症反应有关。
1Braissant O,Foufelle F,Scotto C,etal.Differential expression of peroxisome proliferator-activated receptors(PPARs):tissue distribution of PPAR-α,-β,and-γ in the adult rat 〔J〕.Endocrinology,1996;137(1):354-66.
2Garcia-Gonzalez MJ,Dominguez-Rodriguez A,Ferrer-Hita JJ.Unusual etiology of acute lung injury in a patient with acute myocardial infarction〔J〕.Int J Cardiol,2007;117(3):95-7.
3Frutos-Vivar F,Nin N,Esteban A.Epidemiology of acute lung injury and acute respiratory distress syndrome〔J〕.Curr Opin Crit Care,2004;10(1):1-6.
4Kapoor A,Shintani Y,Collino M,etal.Protective role of peroxisome proliferator-activated receptor-β/σ in septic shock〔J〕.Am J Respir Crit Care Med,2010;182(2):1506-15.
5Haskova Z,Hoang B,Luo G,etal.Modulation of LPS-induced pulmonary neutrophil in filtration and cytokine production by the selective PPAR-beta/delta ligand GW0742〔J〕.Inflamm Res,2008;57(7):314-21.
6Yuan TL,Cantley LC.PI3K pathway alterations in cancer:variations on a theme〔J〕.Oncogene,2008;27(41):5497-510.
7Corton JC,Anderson SP,Stauber A.Central role of peroxisome proliferator-activated receptors in the actions of peroxisome proliferators〔J〕.Ann Rev Pharmacol Toxicol,2000;40(4):491-518.
8Haskova Z,Hoang B,Luo G,etal.Modulation of LPS-induced pulmonary neutrophil infiltration and cytokine production by the selective PPAR-beta/delta ligand GW0742〔J〕.Inflamm Res,2008;57(7):314-21.
9Fan Y,Wang Y,Tang Z,etal.Suppression of pro-inflammatory adhesion molecules by PPAR-delta in human vascular endothelial cells〔J〕.Arterioscler Thromb Vasc Biol,2008;28(2):315-21.
10De Campos T,Deree J,Coimbra R.From acute pancreatitis to end-organ injury:mechanisms of acute lung injury〔J〕.Surg Infect(Larchmt),2007;8(1):107-20.
11van der Pouw-Kraan TC,Boeije LC,Smeenk RJ,etal.A Prostaglandin-E2 is a potent inhibitor of human interleukin 12 production〔J〕.Exp Med,1995;181(2):775-9.
12Zingarelli B,Sheehan M,Wong HR.Nuclear factor-κB as a therapeutic target in critical care medicine〔J〕.Crit Care Med,2003;31(1):S105-11.
13Blackwell TS,Blackwell TR,Christman JW.Impaired activation of nuclear factor-kappa B in endotoxin-tolerant rats is associated with down-regulation of chemokine gene expression an inhibition of neutrophilic lung inflammation〔J〕.J Immunol,1997;158(12):5934-40.
14Yang SJ,Chen HM,Hsieh CH,etal.Akt pathway is required for oestrogen-mediated attenuation of lung injury in a rodent model of cerulein-induced acute pancreatitis〔J〕.Injury,2010;42(7):638-6.
〔2016-05-09修回〕
(编辑袁左鸣)
周国鹏(1973-),男,博士,副主任医师,主要从事高龄病人多器官系统疾病的诊治以及老年危重症的抢救和诊治研究。
曾增(1986-),女,博士,主要从事老年患者呼吸及危重症的诊治研究。
R631
A
1005-9202(2016)16-3880-04;doi:10.3969/j.issn.1005-9202.2016.16.005
