一株貂源绿脓杆菌的分离和鉴定
2016-10-25杨朋欣丁国杰刘可姝张春媛王彬
杨朋欣,丁国杰,刘可姝,张春媛,王彬
(哈药集团生物疫苗有限公司黑龙江哈尔滨150069)
一株貂源绿脓杆菌的分离和鉴定
杨朋欣,丁国杰,刘可姝,张春媛,王彬
(哈药集团生物疫苗有限公司黑龙江哈尔滨150069)
为鉴定一株引起水貂发病的致病菌,本研究从患病水貂肺脏中分离获得一株优势菌,分别对该分离株进行形态、生化和培养特性研究;分子生物学和血清型鉴定;半数致死量测定。结果表明,该分离株为血清G型水貂源绿脓杆菌;分离株16S rRNA基因序列与已知的绿脓杆菌相应序列同源性为99.16%;分离菌对小鼠的半数致死量(LD50)为1.17×106CFU,对水貂的LD50为1.5×108CFU。
绿脓杆菌;分离鉴定;LD50;水貂
水貂出血性肺炎是由绿脓杆菌又称铜绿假单胞菌(Pseudomonasaeruginosa)感染引起的一种高度致死性传染病,多发于每年9-11月份,该菌可通过患病水貂形成的飞沫及气溶胶传播[1]。发病急、死亡快,所以又称铜绿假单胞菌肺炎,以呼吸困难、口鼻出血、突发性死亡为主要特征,死后典型症状为口鼻流出血样泡沫,剖检肺脏呈弥漫性出血。本研究无菌采集多份发病水貂病料肺脏样品,分离出一株细菌。对该分离菌株进行形态、生化和培养特性研究,分子生物学和血清型鉴定等方面的综合分析鉴定,并测定分离菌的半数致死量,为水貂养殖中防治该病提供了理论依据。
1 材料和方法
1.1病料来源
从大连某貂场疑似出血性肺炎的病死水貂无菌采集肺脏3份。
1.2主要试剂
绿脓杆菌分型用标准血清系列,购自日本生研株式会社;绿脓素测定用培养基(PDP)购自北京陆桥公司(PDP);rTaq、dNTP和DL2000DNAMarker均购自宝生物工程(大连)有限公司;琼脂糖购自生工生物工程(上海)有限公司。
1.3试验动物
18~20g昆明小鼠购自哈药集团三精制药有限公司;2~5月龄水貂购自尚志五仁养貂专业合作社(绿脓杆菌B型、C型和G型玻片凝集试验抗体阴性)。
1.4分离株的分离培养
分别无菌沾取病料切面划线接种2%牛血清肉汤琼脂平板,37℃过夜培养。挑取疑似阳性菌落接种5mL2%牛血清肉汤培养基,37℃培养过夜,标记为F0代。
1.5分离株形态、生化特性及培养特性
对疑似阳性分离株做进一步的鉴定,取F0代划线培养的典型菌落,分别接种2%牛血清肉汤培养基、PDP斜面和绵羊鲜血琼脂平板;进行革兰氏染色;氧化酶试验。
1.6分子生物学和血清型鉴定
1.6.1分子生物学鉴定将分离纯化的细菌接种于2%牛血清肉汤培养基中培养过夜,煮沸法提取分离菌株的基因组DNA。以绿脓杆菌16SrRNA(GenBank登录号为NR_118644.1)设计引物,上游引物为 5'-GGGGGATCTTCGGACCTC-3';下游引物为5'-TCCTTAGAGTGCCCACCC-3',引物由上海生物工程有限公司合成,目的片段大小为956bp。反应体系 为25 μL:Buffer2.5μL、dNTP2μL、上下游引物各1μL、模板1μL、rTaq0.5μL、去离子水补齐。程序为95℃5min;95℃1min、55℃1min、72℃1min,循环35次;72℃10min。进行1%的琼脂糖凝胶电泳。同时,PCR产物送测序。
1.6.2血清型鉴定用绿脓杆菌分型用标准血清进行血清型检测,进一步筛选不同血清型的绿脓杆菌。操作步骤按说明书进行即可。混感病料不做进一步筛选。
1.7分离株的半数致死量试验
1.7.1分离株对小鼠的半数致死量试验对小鼠进行半数致死量(LD50)的测定,选取健康昆明系小鼠40只,分成4组,每组10只,取10-1~10-4滴度的菌液,滴鼻接种0.1mL/只,观察7d,记录各组小鼠死亡情况,按Reed-Muench法计算LD50
1.7.2分离株对水貂的半数致死量试验对水貂进行LD50测定,选取健康水貂20只,分成4组,分离株菌液进行10倍倍比稀释,选取原倍至10-3滴度,滴鼻接种水貂,0.2mL/只,观察7d,记录各组水貂的死亡情况,按Reed-Muench法计算LD50。
2 结果
2.1分离株的分离培养
对三份病料中的致病菌分别分离培养,仅一份病料初步分离出疑似阳性菌。
2.2形态、生化特性及培养特性
对分离株进行培养,结果表明,该分离株符合绿脓杆菌的形态、生化及培养特性,在2%牛血清肉汤琼脂平板上生长形态正常,革兰氏染色为阴性杆菌;氧化酶试验为阳性;2%牛血清肉汤培养基呈黄绿色浑浊、10%牛血清肉汤琼脂平板成黄绿色,菌落形态正常,在绵羊鲜血琼脂培养基上生长菌落周围出现溶血环,PDP斜面上生长,产绿色素,菌落周围呈浅绿色。
2.3PCR鉴定及序列分析
以提取的分离株的DNA为模板,在1000bp处扩增出1条片段,与预期结果相符,表明该分离株为16SrDNA基因阳性;测序结果预期相符,片段大小为956bp,与 GenBank登(录号为NR_118644.1)16S rDNA 同源性为99.16%。
2.4血清型鉴定
血清型鉴定结果为,生理盐水空白对照组不凝集,血清G型凝集,为血清G型阳性。
2.5分离株半数致死量的测定结果
分离株对小鼠的 LD50为1.17×106CFU,结果(见表1);分离株对2~5月龄水貂LD50为1.5×108CFU,结果(见表2)。
3 结论与讨论
本研究从疑似出血性肺炎水貂肺脏中分离一株血清G型绿脓杆菌,我国于上世纪80年代初首次报道了水貂出血性肺炎病例,此后相继有该病报道,调查发现我国各地水貂出血性肺炎以G型为主,其次是B型和C型。G型菌株流行情况为60%~80%不等,由于各血清型之间无交叉保护,因此制备的单苗具有可针性[2,3]。
本研究病料分离率偏低,分析原因可能与病料运输与保存有关,提示病料采集后应尽快进行分离;白雪等对2011年分离出的2株G型貂源绿脓杆菌进行LD50测定,结果为对水貂的LD50分别为 2×106CFU和 5×106CFU,对小鼠的 LD50分别为3.38×106CFU和8×106CFU[4],对水貂的毒力高于本实验1.5× 108CFU的结果,对小鼠的毒力低于本实验1.17×106,这与计算、攻毒方法以及分离株来源等均具有一定的关系。■(编辑:赵晓松)

表1 分离株对小鼠LD50结果
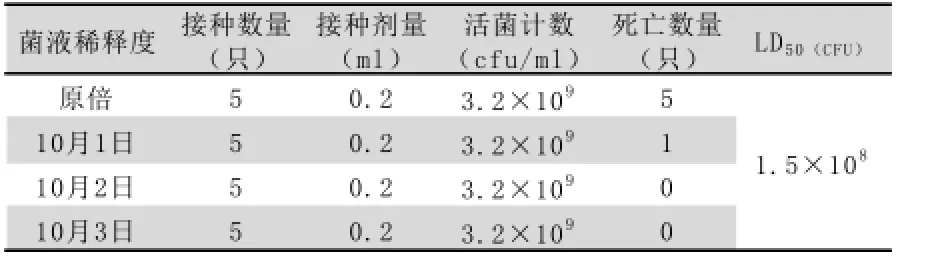
表2 分离株对2~5月龄水貂LD50结果
[1] 陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2002:274-275.
[2] 戴秀美,张永兵,惠涌泉,等.水貂源绿脓杆菌的分离鉴定及致病性试验[J].动物医学进展,2014,35(8):126-129.
[3] 刘德福,赵燕,刘超.水貂暴发出血性肺炎的诊治报告 [J].畜牧兽医杂志,2003,22(4):47-48.
[4] 白雪,柴秀丽,闫喜军.水貂出血性肺炎流行病学调查及铜绿假单胞菌疫苗研究进展[J].现代农业科技,2011(15): 317-318.
Isolation and Identification ofPseudomonasAeruginpsa From theMinks
Yang Peng-xin,Liu Ke-shu,Zhang Chun-yuan,W ang Bin
(Harbin pharmaceutical group bio-vaccine Co.,Ltd.,Harbin HeiLongjiang 150069)
To identify abacterium isolation from themink,the isolatewas investigated through themorphology,biochemical character,cultural character,molecular biology,serotype identification,and LD50test.The results showed that Pseudomonas aeruginosa(P.aeruginosa)type G was isolated from the lung of a dead mink from Dalian of Liaoning Province.The isolate had 99.16%similaritywith P.aeruginosabased on 16SrRNA sequence. The results of LD50testwas 1.17×106CFU formice and 1.5×108CFU formink by using the Reed-Muench calaulationmethod.
Pseudomonasaeruginpsa;Isolation and identification;LD50test;Minks
10.3969/j.issn.1008-4754.2016.9.047
