沸石的转晶行为及其对Cs+、Sr2+吸附—脱附能力研究
2016-10-21郑聪李亚林黎博芝马雪
郑聪 李亚林 黎博芝 马雪
摘要:指出了沸石是一种具有优异的吸附、离子交换性能的硅铝酸盐矿物,在环境治理中有广泛的应用前景。主要研究了13X沸石、4A沸石和天然沸石在200℃水热条件下的转晶行为,对模拟核素离子Cs+、Sr2+的吸附能力,及转晶后的沸石晶相阻滞核素离子发生脱附的能力进行了探究。结果表明:13X沸石和4A沸石转晶形成方钠石,而天然沸石转晶形成方沸石,且MgCl2的加入将促进转晶行为的发生;13X沸石和4A沸石均对Cs+、Sr2+具有良好的吸附能力,吸附率大于90%,而天然沸石对Sr2+的吸附率较低,僅为21.57%;方钠石作为转晶后的晶相能够减少离子的脱附,而钙霞石反而增加离子的脱附率。
关键词:沸石;转晶;方钠石;钙霞石
中图分类号:O7
文献标识码:A 文章编号:16749944(2016)08013404
1 引言
沸石是一类架状构造的含水铝硅酸盐矿物,属于典型的多孔性无机材料,具有均匀的孔道结构,独特的离子交换性,使其在工业领域应用及其广泛,在分子催化、光反应、纳米化学、石油化工等领域承担重要角色[1~4]。在核放射性元素、重金属离子的固化处置领域,沸石也常作为固化材料的重要组成部分[5-7]。沸石是一种介稳态物质,在一定条件下可以产生相变,转变为另一种热力学上更为稳定的沸石结构或盐类[8],转晶行为的研究也是一个重要的课题。研究了13X沸石、4A沸石和天然沸石的转晶行为,分析了三种沸石分别对Cs+、Sr2+的吸附能力,以及转晶后的沸石阻滞两种模拟放射性核素离子脱附的能力,以期为含沸石水泥基材料及地质聚合物材料固化处置放射性废液、重金属废液提供数据。
2 实验
2.1 原材料
13X沸石,来自江苏凯特分子筛有限公司,规格Φ2~3 mm;4A沸石,来自江苏凯特分子筛有限公司,规格Φ2~3 mm;天然沸石,来自浙江缙云浙江神石矿业有限公司,矿物组成主要为丝光沸石、斜发沸石和少量石英,密度2.21 kg/m3,勃氏比表面积268 m2/kg。
2.2 沸石晶相转变研究方法
按原料配比称取样品,混合均匀后加到25 ml坩埚中,用移液管取一定量的去离子水加入养护釜中,然后将坩埚置于支架上,封住不锈钢反应釜盖,在200 ℃温度下晶化一定时间,取出,用蒸馏水洗涤过滤,80 ℃烘干,采用D/max-ШA型X光衍射仪对样品的物相进行分析。
2.3 沸石对模拟核素Sr2+、Cs+的吸附实验
取2.5 g沸石样品分别置入装有50 mL、浓度0.05 mol/L的Sr(NO3)2和CsCl溶液的锥型瓶中,振荡吸附一定时间后离心,取上清液用原子吸收光谱法检测溶液中Sr2+、Cs+离子浓度,计算吸附量、吸附分配比和吸附率。
2.4 模拟核素Sr2+、Cs+从沸石中的脱附实验
称取吸附后的样品1.0 g,加入盛有50 mL去离子水的锥形瓶中,置于振荡器上振荡30 min,静置10 h,离心分离,取上清液移至250 mL容量瓶中,将离心管中沉淀移至原锥形瓶中,用洗涤离心管的15 mL去离子水洗涤沉淀三次,将洗液置于250 mL的容量瓶中,用原子吸收光谱法检测溶液中Sr2+、Cs+离子浓度,计算脱附分数及滞留分数。
3 结果与讨论
3.1 沸石的转晶行为
实验设计了两组实验条件,I条件为沸石:NaOH∶MgCl2·H2O=2∶1∶1,II条件为沸石:NaOH =2∶1。在反应温度为200 ℃条件下,改变反应釜内水的体积,研究了13X沸石、4A沸石及天然沸石的晶相转化行为及产物,结果如表1所示,部分试样晶相转化产物的XRD图谱见图1~3。
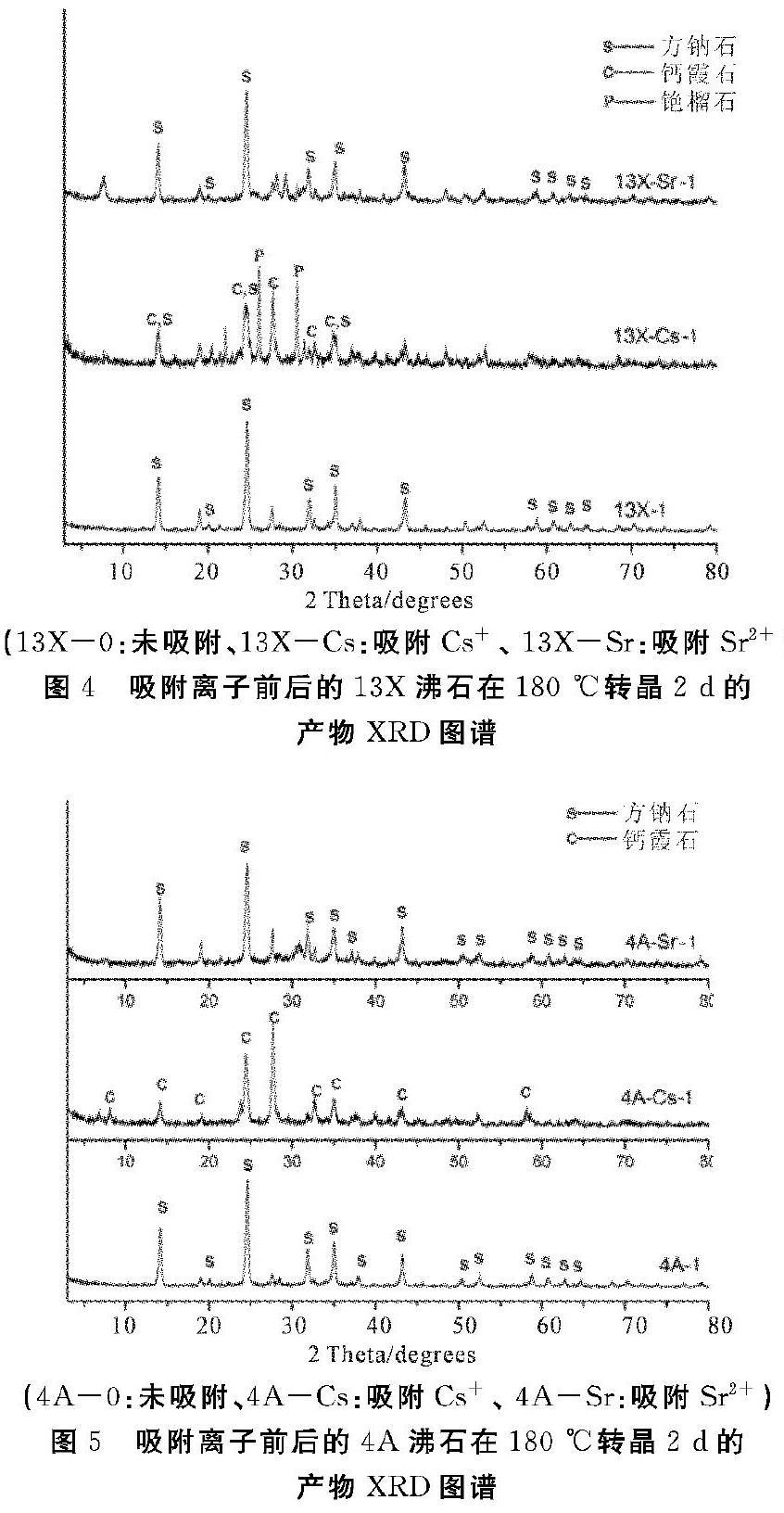
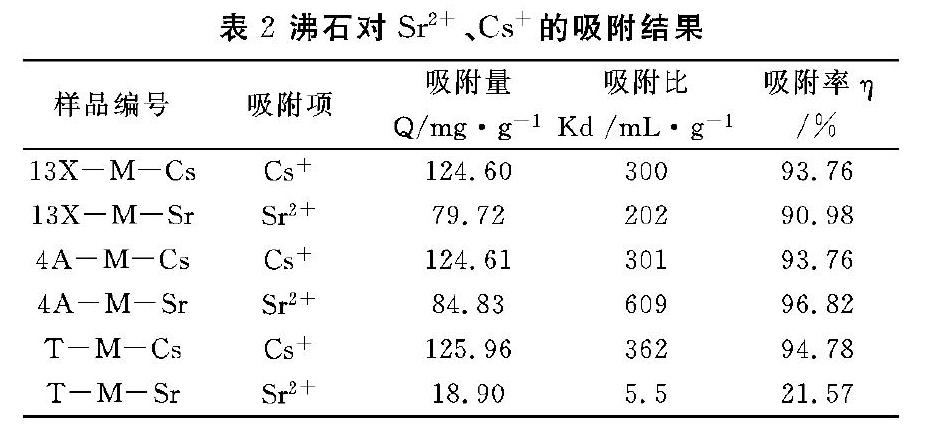
由实验结果可知,13X沸石在强碱环境下,釜内水量为2 mL时,200 ℃反应4 h后,有方钠石和钙霞石产生,仍有部分原始13X沸石的残留,晶相转变不完全;随着时间的延长,13X沸石将完全转变为方钠石(表1,图1)。采用实验条件Ⅰ, 13X沸石在反应8 h后转变为较纯的方钠石。此外,增加釜内水量也可促进晶相转变的发生,当釜内水量增加至5 mL,13X沸石可以在反应2 h后形成较纯的方钠石(表1,图1)。在实验条件Ⅱ下,釜内水量为2 mL时,4A沸石较容易转晶为方钠石(表1 ),当釜内水量为1 mL时,200 ℃反应48 h, 晶相转化产物为钙霞石、钠钾霞石和方钠石(表1,图2),说明蒸汽相的量对晶相转化有明显的促进作用。改变实验条件,在反应中引入MgCl2对4A沸石晶相转变的促进作用并不十分明显,在釜内水量均为2 mL条件下,4A沸石可在反应2 h转晶成为较纯的方钠石(表1)。由图3所示,天然沸石在200 ℃水热反应条件下转晶形成方沸石,随着转晶时间的延长,方沸石的衍射峰更加尖锐,杂相的衍射峰变弱,说明方沸石的纯度在不断提高(图3);实验结果与前面一致,在体系中加入MgCl2 后,可快速生成较纯的方沸石相。以上结果表明,13X沸石、4A沸石和天然沸石在200℃水热条件下可发生转晶得到结晶度较高的方钠石相和方沸石相,MgCl2在体系中的引入,均促进了三类沸石在较短时间内发生晶型转变。
3.2 不同类型沸石对Sr2+、Cs+吸附效果比较
实验比较了吸附时间为7d,不同沸石样品对Sr2+、Cs+的吸附量、吸附比及吸附率,结果如表2所示。由结果可见,三种沸石对Cs+均具有良好的吸附能力,吸附率均在93%以上。沸石对Sr2+的吸附结果则有明显的差异,4A沸石对Sr2+的吸附比为609 mL/g,吸附率达96.82%,大于13X沸石的202mL/g和90.98%,更远远大于天然沸石的5.5 mL/g和21.57%。可见,4A沸石具有更优越的吸附Sr2+的性能,这与文献报告[9]的研究结果相一致,13X沸石对Sr2+、Cs+ 的吸附能力与4A沸石基本相当,而天然沸石对Sr2+吸附能力最差。天然沸石对Cs+与Sr2+的吸附量分别为362 mL/g、5.5 mL/g,分析天然沸石吸附Cs+ 、Sr2+的能力产生明显差异的原因,天然沸石XRD的分析结果表明其主要由丝光沸石和斜发沸石构成,丝光沸石的主孔道为十二元环,孔口呈椭圆形,尺寸为0.65 nm×0.70 nm,主孔道之间有八元环相沟通,八元环孔道尺寸为0.26 nm×0.57 nm。斜发沸石有效孔径为0.4 nm,而Sr2+、Cs+ 的水合离子半径为0.96 nm和0.36 nm,水合半径小的Cs+更容易进入沸石格架进行离子交换。
3.3 转晶前后的沸石对滞留Sr2+、Cs+的滞留能力
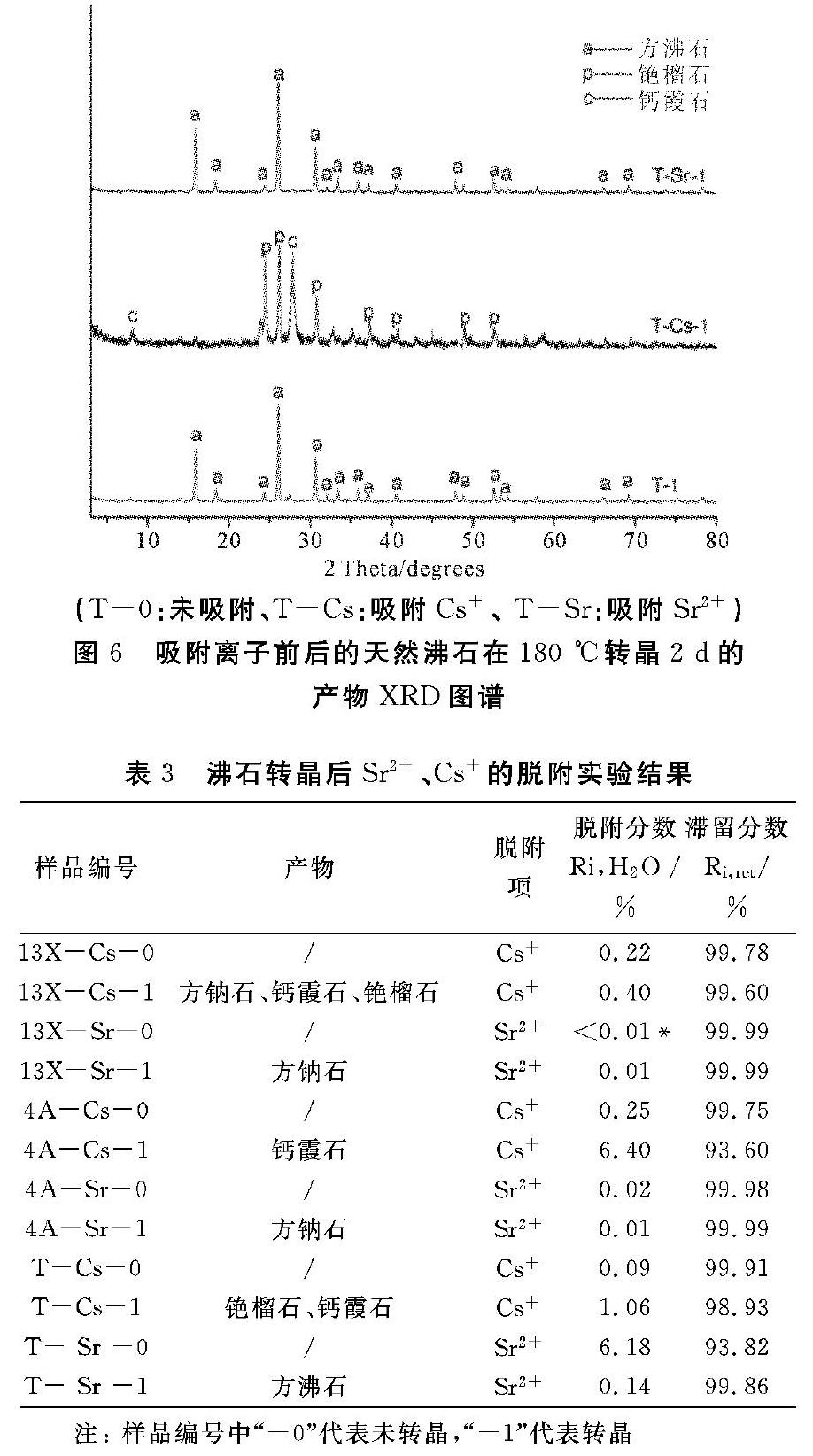
转晶前后沸石试样中Sr2+、Cs+的脱附分数如表3所示。可表可见, 13X沸石、4A沸石、天然沸石对Cs+的脱附分数分别为0.22%、0.25%、0.09%,其中天然沸石对Cs+的脱附分数最小。13X沸石和4A沸石对的Sr2+的浸出率很小,分别为0.01%和0.02%,而天然沸石对Sr2+的脱附分数却很大,为6.18%。
图4~6分别为吸附Sr2+、Cs+前后的13X沸石、4A沸石、天然沸石在180 ℃轉晶2 d的物相分析结果。由图4可见,未吸附与吸附了Cs+的13X沸石都转晶为方钠石相,而吸附Cs+后,13X沸石转晶产物为方钠石、钙霞石(pdf.No.)和铯榴石的混合相;由图5可见,4A沸石在吸附Cs+前后,其在180 ℃、2 d实验条件下的转晶产物一致,均为方钠石相,而4A在吸附Sr2+ 之后,其转晶产物主要为钙霞石相;由图6可见,天然沸石吸附Sr2+后,转晶产物为方沸石相,吸附Cs+的天然沸石则转变成铯榴石、钙霞石晶相。根据表3中Sr2+、Cs+的脱附实验结果可见,13X沸石与4A沸石发生转晶以后未对Sr2+的脱附分数产生较大的影响,而天然沸石转晶为方沸石相后,使Sr2+的脱附分数由6.18%降低至0.14%。其次,吸附Cs+的三种沸石发生转晶以后都有钙霞石相产生,而增大了Cs+的脱附分数,其中4A沸石转晶后钙霞石相含量最多, 其Cs+的脱附分数由0.25%增大至6.40%,从而说明钙霞石相的生成并不利于Cs+在沸石中的滞留能力。钙霞石是由CAN笼按照C轴方向叠加而成,6个CAN笼柱之间通过共用四元环而构成十二元环孔道,有效孔径 0.59 nm,其与4A沸石有效孔径0.42 nm有所增大,这是脱附分数增大的原因之一。
4 结论
(1)13X沸石、4A沸石和天然沸石在200℃水热条件下可发生转晶得到结晶度较高的方钠石相和方沸石相;MgCl2在体系中的引入,均促进了三类沸石在较短时间内发生晶型转变。
(2)三种沸石对Cs+均具有良好的吸附能力,吸附率均在93%以上,以天然沸石的吸附率最高;从Sr2+的吸附效果比较来看,4A沸石优于13X沸石,天然沸石的吸附率较低,仅为21.57%。
(3)吸附了Cs+和Sr2+的沸石转晶形成方钠石或方沸石以后,离子的脱附分数减小,离子由沸石的开放性层间域进入方钠石、方沸石的“晶格笼”中,起到晶格固化的作用;当转晶形成钙霞石以后,离子的脱附分数反而增大,钙霞石相的生成不利于Cs+、Sr2+在沸石中的滞留能力。
参考文献:
[1]陈方明. 多孔方沸石球对含氟水的处理[J]. 矿产保护与利用, 2015(2):45~49.
[2]齐长林,张卫民, 王晓琦, 等. 方沸石的水热合成及其对水溶液中 Pb2+的吸附[J]. 济南大学学报(自然科学版), 2013,27(1):59~62.
[3]H. Kazemian, Z. Naghdali, T. Ghaffari Kashani, et al. Conversion of high silicon fly ash to Na-P1 zeolite: Alkaline fusion followed by hydrothermal crystallization[J]. Advanced Powder Technology, 2010(21): 279~283.
[4]Vikranth Volli, M.K. Purkait. Selective preparation of zeolite X and A from flyash and its use as catalyst for biodiesel production[J]. Journal of Hazardous Materials, 2015(297):101~111.
[5]B.I. El-Eswed, R.I. Yousef , M. Alshaaer, et al. Stabilization/solidification of heavy metals in kaolin/zeolite based geopolymers[J]. International Journal of Mineral Processing, 2015(137):34~42.
[6]高 亚, 李玉香, 马 雪等. 模拟高盐高碱低中水平放射性废液水泥固化工艺的研究[J]. 辐射防护, 2014,34(4): 218~223.
[7]包 健. 沸石对高放废液水泥固化体的中Cs+浸出率的影响[J]. 环境科学与技术,2009,32(7):160~162.
[8]徐如人, 庞文琴, 屠昆岗,等. 沸石分子筛的结构与合成[M]. 长春: 吉林大学出版社, 1987.
[9]易发成, 李玉香, 唐 蓉, 等. 矿物材料对核素Sr、Cs的吸附性能研究[J]. 中国矿业,2004,13(12):67~70.
[10]王瑜,孟长功,吕天明.A型沸石分子筛的制备及其吸附量的测定——介绍一个研究型综合化学实验[J]. 化工高等教育, 2015(4) .
[11]戈明亮,王雁武.麦羟硅钠石对水中Zn2+的吸附性能研究[J]. 中国环境科学, 2015(7) .
[12]李光文,刘建军,左胜利.银-溴化银/麦羟硅钠石可见光催化剂的制备及其光催化性能[J]. 化学研究, 2014(4) .
[13]王侨,刘显灵,金英杰.具有介孔结构丝光沸石的合成与表征[J]. 硅酸盐学报, 2012(3) .
[14]王文兰,刘百军,曾贤君.低硅铝比ZSM-5分子筛上C4烃的催化裂解反应[J]. 物理化学学报, 2008(11) .
Abstract:Zeolite is a kind of silica-aluminamineral with high adsorption capacityand selective ion-exchange property, and it demonstrates an extensive application prospectin environmental governance. The crystal transformation behaviors of 13X zeolite, 4A zeolite and natural zeolite are investigated in hydrothermal condition at 200℃, and the adsorption capacity for simulation of radioactive ions Cs+ and Sr2+ of zeolite and the desorption capacity for simulation of radioactive ions of transformed zeolite phase are also studied in this work. The results show that 13X zeolite and 4A zeolite are transformed into sodalities, and the natural zeolite is transformed into analcime. The addition of MgCl2 can promote the crystal transformation process of zeolite. 13X zeolite and 4A zeolite have high adsorption capacity for simulation of radioactive ions Cs+ and Sr2+, and the value of adsorption rate is more than 90%. However, the adsorption rate of natural zeolite for Sr2+ is lowest in the experiment, the value is only 21.57%. Sodalite can reduce the desorption rate of zeolite for simulation of radioactive ions Cs+ and Sr2, but cancrinite increases the desorption rate.
Key words: zeolite; crystal transformation;sodalite; cancrinite
