茶红素的理化特性及生物学活性研究进展
2016-10-21李山吴周和吴正奇袁海波陈小强
李山,吴周和, 吴正奇,袁海波, 陈小强*
1(湖北工业大学 食品与制药工程学院,湖北 武汉,430068) 2(中国农业科学院 茶叶研究所,浙江 杭州,310008)
茶红素的理化特性及生物学活性研究进展
李山1,2,吴周和1, 吴正奇1,袁海波2*, 陈小强1*
1(湖北工业大学 食品与制药工程学院,湖北 武汉,430068)2(中国农业科学院 茶叶研究所,浙江 杭州,310008)
茶红素是一类异质酸性酚类色素总称,作为茶叶发酵的产物,与茶汤的色泽、品质密切相关。文中针对茶红素形成途径、基本性质及可能结构进行了阐述,概括了目前茶红素分离纯化研究常用分析方法,综述了茶红素在抗氧化、抗癌、抗致畸、改善消化系统、抗毒素等生物学活性相关的研究进展。茶红素作为一种天然色素,在食品、化工和医疗保健行业都将有极大的发展应用前景。
茶红素;理性特性;生物学活性;展望
茶红素(thearubigins,TRs),是茶叶发酵过程中形成的色素。茶色素还包括茶黄素(theaflavins,TFs),茶褐素(theabrownins,TBs)。茶色素与茶汤品质密切相关,茶黄素决定着茶汤亮度,而茶红素直接反映茶汤的口感和茶汤颜色[1]。茶红素研究最先由ROBERTS等人所提出,并推断红茶发酵实质是儿茶素等前体经过酶促氧化,初始形成邻醌,进一步氧化偶合形成茶红素。随着儿茶素以及茶黄素多酚类物质研究的日益完善,茶红素研究也正式拉开序幕。但由于茶红素异质性,其化学结构不甚明晰[2],分离纯化存在一定难度,这些都需要在未来的研究中突破。现有茶红素的药理研究表明,茶红素具有抗氧化、抗突变、抗癌、抗致畸性、预防肥胖等生物学活性。另外,人工合成色素虽稳定性好、价格低廉,但可能具有安全隐患,天然食品色素取代人工合成色素是一种必然趋势。这些方面都使得茶红素在未来产品开发和应用方面都具有很大的潜能。
1 茶红素形成途径
茶红素的形成发生在茶叶发酵过程中,儿茶素经茶叶内源多酚氧化酶(PPO)和过氧化物酶(POD)酶促氧化,研究表明氧化过程中儿茶素类消耗导致茶黄素和茶红素含量增加[3]。因为儿茶素B环上相邻羟基极活泼,初始发酵过程中可生成邻醌。而C2’、C4、C6和C8上的氢活性较强,易进一步发生复杂聚合反应,生成茶黄素和聚酯型儿茶素(theasinensins)等中间产物。最新研究表明,在模拟茶红素形成机制中,基于黄烷-3-醇底物电化学氧化反应,用质谱技术检测反应中间体以及产物,结果得出氧化主要发生在B环和没食子酰基,该氧化偶合形成茶黄素、儿茶素二聚体以及多羟基黄烷-3-醇衍生物[4]。KUHNERT等[5]利用LC-MSn对茶红素结构表征,茶红素组分中存在儿茶素二聚体不同种类的多羟基化衍生物,符合氧化级联假说。儿茶素聚合中间产物具有活性羟基,能作为亲核基团被氧取代形成高聚体物质,也能与蛋白质、核酸等形成高聚合茶红素类物质。李大祥等在现研究基础上提出了茶红素的形成途径示意图[6],如图1所示。
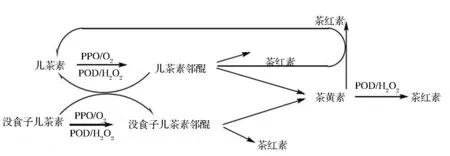
图1 红茶发酵中茶红素形成机制Fig.1 Formation mechanism ofthearubigins during black tea feimentation
2 茶红素的分离制备
茶红素常用分离制备方法有2种——有机溶剂萃取法和色谱分离法。BROWN等[7]根据茶红素极性不同利用乙酸乙酯、正丁醇和酸性正丁醇萃取茶汤分离出5种不同茶红素,TR-1(溶于乙酸乙酯、丙酮,不溶于乙醚)、TR-2(溶于正丁醇、甲醇,不溶于乙醚)、TR-3(溶于正丁醇、丙酮,不溶于乙醚)、TR-4(溶于酸性正丁醇、甲醇,不溶于乙醚)、TR-5(溶于酸性正丁醇、丙酮,不溶于乙醚)。KRISHNAN等[8]在BROWN基础上采用索氏抽提直接进行固液萃取得到(PBP-1~PBP-5),不含其他活性单体和低聚组分。现阶段茶红素分离制备研究也多用于综合此二法,但有机溶剂萃取方法有待于高新技术设备纯化研究进一步完善优化。此外茶多酚氧化和茶褐素酸化是制备茶红素的另一种手段[9]。
应用色谱分离茶红素常用方法有高效液相色谱(HPLC)、SephadexLH-20 柱色谱、高速逆流色谱(HSCCC) 和离心沉淀色谱(CPC)等。STODT等[10]通过分别比较ROBERTS的有机试剂液液萃取、咖啡碱沉淀、高速逆流色谱3种方法制取茶红素,基于时间消耗,产品产量、纯度,发现采用逆流色谱技术对茶红素分离纯化效果更佳。潘宇[11]用有机溶剂提取粗茶红素再利用HSCCC分离得到不同峰值,经鉴定能保留一些活性酚羟基和苯并卓酚酮结构。
3 茶红素基本性质
茶红素是一类分子差异极大的异质性红色或褐红色的酚性物质,分子质量约700~40 000Da,占红茶干重9%~19%及红茶多酚类物质70%左右。因含羧基溶于水呈酸性溶液,pH值在3.2~3.5。茶红素极性较茶黄素强,其结构组分比茶黄素更为复杂。在茶叶发酵过程中,儿茶素经多酚氧化酶(PPO)和过氧化物酶(POD)的酶促氧化,最终聚合形成茶红素,其中涉及到很多复杂多样的中间产物[12]。茶红素主体部分是由儿茶素氧化聚合而成,包括黄烷三醇多聚体以及苯丙卓酚酮结构。但除儿茶素酶促氧化外,中间产物因含大量活性羟基能进一步结合核酸、糖类、蛋白质以及氨基酸[13]等物质。
根据茶红素的溶解性,ROBERTS[14-15]用不同溶剂萃取,得到的茶红素按其在不同溶剂中的溶解性分类,溶于乙酸乙酯为茶红素SI;既溶于水又溶于乙醚为SIa;溶于水为SII。根据茶红素光谱学性质,BAILEY[16]等采用反向高效液相色谱法制备获得3种茶红素,其一是不被色谱柱吸附部分;其二是可溶而且检测显示可辨析峰;其三是组分不可溶且显示“Gaussianhump”型不可辨析峰。
4 茶红素可能的结构
儿茶素以及茶黄素结构已有深入研究,茶黄素4种单体结构也已解析出。对于茶红素,由于其异质性,分子质量差异较大,茶红素的结构组分尚不明晰。前体物儿茶素类经过氧化偶合形成邻醌,之后生成一系列二聚体、低聚体及其衍生物,而茶红素可能是进一步偶合而成的儿茶素高聚合物。OZAWA等[17]通过茶红素化学降解试验研究得出,在儿茶素上C4、C8或C6、C2'和C6位相结合,且B环和B环以及C4和C8或C6位相结合;MENTA等[18]经过MALDI-TOF-MS分析,表明茶红素部分结构存在与茶黄素相似。也就是说,儿茶素酶促氧化过程中,茶红素可能由儿茶素、茶黄素分别氧化形成,也可能共同氧化而来。
KUHNERT等[19-20]经过一系列质谱联用技术,包括基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)、傅立叶变换离子回旋共振质谱(FT-ICR-MS)等,茶红素各分子质量在2 100Da以内,而且在300~1 000Da约1 400~1 517个分子已被确定结构式。这些分子主要由儿茶素、茶黄素以及酚酸结构组成,儿茶素二聚物多达21种(部分结构见图2),其中二聚体类型可分为四大类,I型(theasinensin型),II型(茶黄素型),III型(theacitrin型)和IV型(theanaphthoquinone型)。这些儿茶素二聚物可能作为茶红素形成的中间产物,并对今后茶红素结构解析有着至关重要的作用。YASSIN等[21]以咖啡碱沉淀法得到的SⅡ茶红素,应用ESI-tandem和MALDI-TOF-MS清楚鉴定出黄烷-3-醇类和二聚体氧化偶合形成更高三聚体以及四聚体,以及采用ESI/HPLC-MS发现theanaphthaquinone和theasinensinC结构的多羟基二聚体,而且theasinensinA结构中发现过氧和环氧化合物,进一步说明H2O2在红茶发酵过程中的重要作用[22]。YASSIN[23]的研究也表明,UPLC-MS-MS应用于茶红素中黄烷醇异构体的表征,离子迁移与异构体合理分配密切相关[23]。此外,一种全新的数据处理程序(Petrolomics)也被应用到探测茶红素的复杂结构中。

图2 红茶茶红素中已报道的几种儿茶素二聚体氧化产物Fig.2 Reported severaldimeric catechin oxidation products in black tea Thearubigins
5 茶红素生物学活性
茶与健康备受关注,尤其是对于“三高”人群,饮茶能起到很好的保健功效。而茶多酚、茶多糖、茶色素正是这些功效的生物活性成分。而茶叶发酵过程中儿茶素酶促氧化形成茶红素,其含量较为丰富。茶红素的酚羟基和苯并卓酚酮结构都有较高活性,在药理功能方面起着重要作用。现药理学研究表明,茶红素在自由基清除和抗氧化方面有显著功效,而且在抗癌、抗突变、抗致畸性,抑制毒素以及改善肠道也有突出贡献。
5.1抗氧化作用
通过大量化学模拟实验发现,茶红素也有着与前体物儿茶素以及茶黄素一样的抗氧化能力。LUCZAJ等[24]研究表示,红茶中茶红素的抗氧化机制是通过抑制自由基的产生,清除自由基和螯合过渡金属离子表现的,茶黄素和茶红素可以影响转录因子活化诸如NF-κB或AP-1,结果表示茶红素抗氧化能力低于EGCG和茶黄素。YANG等[25]模拟茶红素在体外反应体系中研究,发现茶红素有较强清除DPPH和OH· 能力。其机制是由于茶红素能激活过氧化氢酶(CAT)的活性,进一步使得H2O2分解成H2O和O2,抑制H2O2和O2在铁离子催化下生成OH·。SHON等[26]从韩国微生物发酵茶中提取茶红素研究表明,茶红素有很好抗氧化性,在80μg/mL浓度下OH·清除率高达79.7%。
5.2抗癌、抗突变、抗致畸作用
茶类高消耗的国家,尤其是红茶,茶红素摄入量约占总黄酮一半,而茶红素摄入量可能更好地预防某些慢性病症,诸如癌症和心血管疾病[27]。GUPTA等[28]对于环磷酰胺和二甲基苯并蒽诱导瑞士小白鼠致畸,在染色体畸变(CA)和姐妹染色单体交换(SCE)试验中,茶红素都起到积极保护作用。同样,茶红素在小鼠骨髓细胞体外试验,对苯并(a)芘致畸性有抑制作用[29]。HALDER[30]还利用人体淋巴细胞体外试验,发现茶红素有较好抗致畸作用,在染色体畸变(CA)试验中,对诱导剂苯并芘和黄曲霉毒素B1保护作用在20%~52%和16%~56% ,而在微核(MN)试验中为19%~43%和16%~56%。此外,SAKAMOTO[31]在人前列腺肿瘤细胞(PC-3)的研究中,茶红素单独存在并不能起到效果,当茶红素和三羟异黄酮共同使用,对抑制人类前列腺肿瘤细胞(PC-3)的增殖有较好的协同效应。
5.3改善消化系统作用
红茶茶色素可以改善人体消化系统肠道微生物环境,维持生理平衡,尤其在中老年人中。主要表现在茶黄素以及茶红素对于肠道细菌有明显抑制作用,提升肠道的免疫功能。MIYATA等[32]通过喂食小鼠茶红素等酚性物质,发现粪便中的类固醇排泄增加,人体胆固醇降低;MURAD等[33]研究表明茶叶提取物BTE4.5%和茶红素6mg/kg可以缓解治疗西地那非引起消化不良;MAITY等[34]根据剂量效应研究表明小鼠在每日摄入40mg/kg茶红素,能清除病原物质减少肠道结构损伤,进而改善腹泻及结肠炎症疾病。
5.4抑制毒素、抗病毒作用
茶红素对毒素也能产生抑制作用,SATOH等[35-36]采用正丁醇可溶茶红素部分,在小鼠体外试验中,发现茶红素能对肉毒毒素A型有较好抑制效果,随后又证明茶红素通过与破伤风毒素结合,能达到防治破伤风的作用。茶红素在抵抗艾滋病病毒也有突出贡献,研究结果表明,茶红素对艾滋病毒(HIV-1)的逆转录酶以及DNA和RNA聚合酶的活性存在不同程度抑制[37]。茶红素对慢性粒白细胞增殖也存在抑制效果,经证明茶红素抑制该病毒细胞DNA合成,而且在体外培养试验中,茶红素能控制细胞停滞细胞分裂第一期,还能调节细胞内蛋白酶基因表达,进而达到预防白血病。
6 展望
在红茶发酵中,茶黄素和茶红素是主要色素组成,而且茶红素含量是茶黄素的5~10倍[38],茶红素水溶性也更好,具有极大的开发前景。近年来在茶色素研究中,已有大量实验探究出茶黄素结构以及生物学活性,并取得很大的进展,而茶红素研究却停滞不前。主要原因在于茶红素异质性,结构极其复杂,尚未分析出茶红素制备分离的高效方法。改进溶剂提取方法和条件来提高提取率,找到一种柱层析或色谱技术分离纯化出更高纯度的茶红素都是首要难题。分离制备出高纯度茶红素单体,进一步解析其结构,才能促进茶红素分子水平的研究。另外,茶红素作为茶叶发酵的重要产物,与红茶茶汤品质密切相关,红茶加工过程中茶红素的产生及组分变化、茶红素在红茶加工中的品质调控作用等这些方面的研究鲜见报道。大量药理实验研究证实,茶红素在抗氧化、抗癌抗突变方面有良好预防和治疗功效。其生物学活性以动物和细胞水平试验为主,构效关系、临床效果方面的工作尚待开展。总之,作为日益被人们关注的天然色素和拥有较好生物学活性的茶红素有待于更深入的研究。
[1]熊昌云, 彭远菊. 红茶色素与红茶品质关系及其生物学活性研究进展[J]. 茶业通报, 2006, 28(4):155-157.
[2]HASLAME.Thoughtsonthearubigins[J].Phytochemistry, 2003, 64(1):61-73.
[3]NGUREFM,WANYOKOJK,MAHUNGUSM,etal.Catechinsdepletionpatternsinrelationtotheaflavinandthearubiginsformation[J].FoodChemistry, 2009, 115(1):8-14.
[4]YASSINGH,KOEKJH,KUHNERTN.Modelsystem-basedmechanisticstudiesofblackteathearubiginformation[J].FoodChemistry, 2015, 180:272-279.
[5]KUHNERTN,CLIFFORDMN,MÜLLERA.Oxidativecascadereactionsyieldingpolyhydroxy-theaflavinsandtheacitrinsintheformationofblackteathearubigins:evidencebytandemLC-MS[J].FoodandFunction, 2010, 1:180-199.
[6]李大祥, 王华, 白蕊, 等. 茶红素化学及生物学活性研究进展[J]. 茶叶科学, 2013, 33(4):327-335.
[7]BROWNAG,EYTONWB,HOLMESAetal.Theidentificationofthethearubiginsaspolymericproanthocyanidins[J].Phytochemistry, 1969, 8(12):742-744.
[8]RAJESHK,GMARUMGB.Isolationandanalysesofpolymericpolyphenolfractionsfromblacktea[J].FoodChemistry, 2006, 94(3):331-340.
[9]房贤坤. 茶红素的制备及生物学活性研究[D]. 大连:大连工业大学,2011:15-24.
[10]STODTUW,STARKJ,ENGELHARDTUH.Comparisonofthreestrategiesfortheisolationofblackteathearubiginswithafocusoncountercurrentchromatography[J].JournalofFoodCompositionandAnalysis,2015, 43:160-168.
[11]潘宇. 红茶香气成分分析及茶红素类物质的初步研究[D]. 长沙:湖南农业大学, 2009:35-42.
[12]胡善国, 苏有键, 罗毅, 等. 茶红素研究进展[J]. 中国农学通报, 2014, 30(18):283-290.
[13]萧伟祥, 钟瑾, 萧慧, 等. 茶红色素形成机理及制取[J]. 茶叶科学, 1997, 17(1):1-8.
[14]ROBERTSEAH,CATRIGHTRA,OLDSCHOOLM.Thephenolicsubstancesofmanufacturedtea.I—Fractionationandpaperchromatographyofwatersolublesubstancesfrommanufacturedtea[J].JournaloftheScienceofFoodandAgriculture, 1957, 8(2):72-80.
[15]ROBERTSEAH.Thephenolicsubstancesofmanufacturetea. Ⅱ-Theiroriginasenzymicoxidationproductsinfermentation[J].JournaloftheScienceofFoodandAgriculture, 1958, 9(4):212-216.
[16]BAILEYRG,NURSTENHE.Comparativestudyofthereversedphasehigh-performanceliquidchromatographyofblacktealiquorswithspecialreferencetothethearubigins[J].JournalofChromatographyA, 1991, 542:115-128.
[17]OZAWAT,KATAOKAM,MORIKAWAK,etal.Elucidationofthepartialstructureofpolymericthearubiginsfromblackteabychemicaldegradation[J].BioscienceBiotechnologyandBiochemistry, 1996, 60(12):2023-2027.
[18]MENETMC,SANGS,YANGCS,etal.AnalysisoftheaflavinsandthearubiginsfromblackteaextractbyMALDI-TOFmassspectrometry[J].JournalofAgriculturalandFoodChemistry, 2004, 52(9):2 455-2 461.
[19]KUHNERTN.Unravelingthestructureoftheblackteathearubigins[J].ArchivesofBiochemistryandBiophysics, 2010, 501(1):47-51.
[20]KUHNERTN,DRYNANJW,OBUCHOWICZJ,etal.Massspectrometriccharacterizationofblackteathearubiginsleadingtoanoxidativecascadehypothesisforthearubiginformation[J].RapidCommunicationsinMassSpectrometry, 2010, 24(23):3 387-3 404.
[21]YASSINGH,GRUNC,KOEKJH,etal.Identificationoftrimericandtetramericflavan-3-olderivativesintheSIIblackteathearubiginfractionofblackteausingESI-tandemandMALDI-TOFmassspectrometry[J].FoodResearchInternational, 2014, 63:317-327.
[22]YASSINGH,KOEKJH,JAYARAMANS,etal.IdentificationofnovelhomologousseriesofpolyhydroxylatedtheasinensinsandtheanaphthoquinonesintheSIIfractionofblackteathearubiginsusingESI/HPLCtandemmassspectrometry[J].JournalofAgriculturalandFoodChemistry, 2014, 62(40):9 848-9 859.
[23]YASSINGH,GRUNC,KOEKJH,etal.Investigationofisomericflavanolstructuresinblackteathearubiginsusingultraperformanceliquidchromatographycoupledtohybridquadrupole/ionmobility/timeofflightmassspectrometry[J].JournalofMassSpectrometry, 2014, 49(11):1 086-1 095.
[24]LUCZAJW,SKRZYDLEWSKAE.Antioxidativepropertiesofblacktea[J].PreventiveMedicine, 2005, 40(6):910-918.
[25]YANGZY,TUYY,XIAHL,etal.Suppressionoffree-radicalsandprotectionagainstH2O2-inducedoxidativedamageinHPF-1cellbyoxidizedphenoliccompoundspresentinblacktea[J].FoodChemistry, 2007, 105(4):1 349-1 356.
[26]SHONMY,PARKSK,NAMSH.Antioxidantactivityoftheaflavinandthearubiginseparatedfromkoreanmierobiallyfermentedtea[J].JournalofFoodScienceandNutrition, 2007, 12(1):7-10.
[27]AMORA-ROSR,KNAZEV,ROMIEUI.ImpactofthearubiginsontheestimationoftotaldietaryflavonoidsintheEuropeanProspectiveInvestigationintoCancerandNutrition(EPIC)study[J].EuropeanJournalofClinicalNutrition, 2013, 67:779-782.
[28]ZGUPTAS,CHAUDHURIT,GANGULYDK,etal.Anticlastogeniceffectsofblacktea(Worldblend)anditstwoactivepolyphenolstheaflavinsandthearubiginsin vivoinSwissalbinomice[J].LifeSciences, 2001,69(23):2 735-2 744.
[29]HALDERB,PRAMANICKS,MUKHOPADHYAYS,etal.Inhibitionofbenzo[a]pyreneinducedmutagenicityandgenotoxicitybyblackteapolyphenolstheaflavinsandthearubiginsinmultipletestsystems[J].FoodandChemicalToxicology, 2005,43(4):591-597.
[30]HALDERB,PRAMANICKS,MUKHOPADHYAYS,etal.Anticlastogeniceffectsofblackteapolyphenolstheaflavinsandthearubiginsinhumanlymphocytesinvitro[J].ToxicologyinVitro, 2006, 20(5):608-613.
[31]SAKAMOTOK.Synergisticeffectsofthearubiginandgenisteinonhumanprostatetumorcell(PC-3)growthviacellcyclearrest[J].CancerLetters, 2000, 151(1):103-109.
[32]MIYATAY,TANAKAT,TAMAYAK,etal.Cholesterol-loweringeffectofblackteapolyphenols,theaflavins,theasinensinAandthearubigins,inratsfedhighfatdiet[J].FoodScienceandTechnologyResearch, 2011,17(6):585-588.
[33]MURADHAS,ABDALLAHHM.Blackteaextractanditsthearubiginsrelievethesildenafil-induceddelayedGutmotilityinmice:Apossibleroleofnitricoxide[J].PhytotherapyResearch, 2014, 28(11):1 687-1 691.
[34]MAITYS,UKILA,KARMAKARS,etal.Thearubigin,themajorpolyphenolofblacktea,amelioratesmucosalinjuryintrinitrobenzenesulfonicacid-inducedcolitis[J].EuropeanJournalofPharmacology, 2003, 470(1):103-112.
[35]SATOHE,ISHIIT,SHIMIZUY,etal.Blackteaextract,thearubiginfraction,counteracttheeffectsofbotulinumneurotoxinsinmice[J].BritishJournalofPharmacology, 2001, 132(4):797-798.
[36]SATOHE,ISHIIT,SHIMIZUY,etal.Amechanismofthethearubiginfractionofblacktea(camelliasinensis)extractprotectingagainsttheeffectoftetanustoxin[J].TheJournalofToxicologicalSciences.2002, 27(5):441-447.
[37]鲁进, 赵燕, 刘箭卫. 红茶及茶色素药理作用研究的动态[J]. 中国药学杂志, 1999, 34(6):361-363.
[38]王华. 茶红素分离制备及清除自由基活性的初步研究[D]. 合肥:安徽农业大学, 2007:9-10.
Thephysicochemicalpropertiesandbioactivityofthearubigins
LIShan1,2,WUZhou-he1,WUZheng-qi1,YUANHai-bo2,CHENXiao-qiang1*
1 (SchoolofFood&Pharmaceuticalengineering,HubeiUniversityofTechnology,Wuhan430068,China)2 (TeaResearchInstitute,ChineseAcademyofAgriculturalSciences,Hangzhou310008,China)
Thearubiginsaremixturesofheterogeneousacidicphenolicpigments,whicharetheproductsofblackteafermentation.Thearubiginsarecloselyrelatedtothecolorandqualityofblackteainfusion.Thispaperreviewedformationpathway,basicpropertiesandstructureofthearubigins.Thecommonseparationandpurificationmethodsofthearubiginsaresummarized.Furthermore,theresearchprogressofthearubiginsbiologicalactivityarereviewed,includingantioxidant,anti-cancer,anticlastogenic,improvementofthedigestivesystemandantitoxin.Thearubigins,asanaturalpigment,willhavethegreatpotentialusedinfood,andchemicalandmedicalhealthindustry.
thearubigins;physicochemicalproperties;bioactivity;prospect
10.13995/j.cnki.11-1802/ts.201608046
硕士研究生(袁海波副研究员、陈小强副教授共为通讯作者,电子邮箱分别为,E-mail:192168092@tricaas.com,biomed528@163.com)。
国家茶叶产业技术体系红茶加工岗位(CARS-23);中国农业科学院科技创新工程(CAAS-ASTIP-TRICAAS);湖北工业大学基金项目(BSQD13007)
2015-10-28,改回日期:2016-01-04
