吡啶基查尔酮类化合物合成及其抑菌活性
2016-10-21詹帅军金洪陶科侯太平
詹帅军,金洪,陶科,侯太平
四川大学生命科学学院生物资源与生态环境教育部重点实验室,四川成都610064
吡啶基查尔酮类化合物合成及其抑菌活性
詹帅军,金洪,陶科,侯太平*
四川大学生命科学学院生物资源与生态环境教育部重点实验室,四川成都610064
为了发现高效、低毒的农用先导化合物,本文采用活性亚结构拼接原理,设计并合成了一类含吡啶基查尔酮类化合物。初步抑菌活性测试结果表明,在测试浓度为100 μg/m L时,大多数化合物对供试的水稻纹枯病菌(Rhizoctorzia solani)、苹果轮纹病(Physolospora piricola)、小麦赤霉病菌(Fusarium graminearum)、玉米小斑病菌(Bipolaris maydis)四种植物病原菌均具有一定的抑菌活性,其中化合物I9,I15和I16对水稻纹枯病菌的抑制率在90%以上。病原菌毒力测试表明,化合物I16的EC50值为35.43 μg/m L,高于对照药多菌灵(40.56 μg/m L)的值,此外,化合物I16还表现出了较宽的抑菌谱,其对四种植物病原菌的抑菌率均大于80%。
吡啶基;查尔酮;合成;抑菌活性
农业科学的不断发展,各种高效的农药不断的被开发出来,且广泛应用与农业病虫害的防治当中。化学农药的使用使得单位面积内的农业生产效率有了明显提高,保障了粮食的供应,基本解决了原来失误短缺的问题[1]。但是,随着农药品种的日益增多,农药使用量的逐年增大,其带来的负面效应如:农药残留问题、病虫害的抗药性问题,对人畜健康的危害问题等都在不断的增加。因此,开发新型高效、低毒、环保的绿色农药成了农药工作者的首要目标[2,3]。
查尔酮(1,3-二苯基丙烯酮)是芳香酮的一种,其结构是两个芳香族化合物由α,β-不饱和烯酮双键链接组成的,大量存在于可食用或药用的植物当中[4]。在过去的几十年里,科学家对天然的和合成的查尔酮及其类似物都做了大量的系统的研究,并且发现它们具有多种生物活性,例如:抗肿瘤活性、细胞毒性、抗有丝分裂、抗炎、抗结核、抗菌、抗疟疾等[5-7]。此外,一些研究发现,查尔酮也可以应用于农业领域,一些含有查尔酮结构的化合物被发现具有如昆虫拒食活性、杀线虫活性、灭蚊活性、杀小菜蛾活性以及抗植物病原真菌活性等生物活性[8-10]。
吡啶是含氮杂环化合物的典型代表,其在医药和农药中的应用历来都是杂环研究领域最值得关注的结构之一[11]。研究表明,在农药分子中引入吡啶环后,多数情况下会得到毒性更低、活性更高、选择性更好或内吸性更高的化合物。据不完全统计,进入21世纪后,新上市和发开的70多个农药中有10个含有吡啶基,约占14%。同时,在新上市的90多个新的医药中有11个化合物含有吡啶的结构,约占11.5%。如图1列举了代表性的含有吡啶的医药和农药产品分子结构[12-14]。
2001年,本课题组第一次在瑞香狼毒中分离得到了一个具有二苯酮类结构的高活性化合物[15],并在后续对其结构改造中发现:当用呋喃替代二苯酮骨架中的一个苯环,且将原来的Ar-C5-Ar结构替换为查尔酮类化合物的结构时,新得到的化合物的生物活性明显好于先导化合物(图2)[16,17]。因此,本论文以课题组前期得到的一些具有高活性化合物作为先导结构,采用生物电子等排原理以及活性亚结构拼接法,将具有广泛生物活性的吡啶引入到查尔酮的结构中,设计合成了一系列含吡啶的查尔酮类化合物(图3),以期得到一些活性更高、抑菌谱更宽的高效农用化合物。

图1 商品化的含吡啶的化合物Fig.1 Commercial compounds with a pyridyl

图2 课题组前期工作成果Fig.2 The previous results from the subject team

图3 目标化合物的设计方案Fig.3 Design for the target compounds
1 材料与方法
1.1试剂与仪器
R-201型旋转蒸发仪(郑州长城科工贸有限公司);SHZ-D(III)循环水式多用真空泵(郑州长城科工贸有限公司);81-2型恒温磁力搅拌器(上海司乐仪器公司);薄层层析板(烟台江友硅胶开发有限公司);Bruker-400 MHz型核磁共振仪(CDCl3作溶剂,TMS作内标)。其他化学试剂如无特别说明则均为市售分析纯或化学纯。
1.2目标化合物的合成
1.2.1目标化合物I1-I18的合成目标化合物的合成路线(图4)称取5 mmol取代苯甲醛加入到100 mL三口瓶中,加入15 mL无水乙醇使其完全溶解后再加入2 mL 5.0%NaOH溶液。随后将三口瓶置于冰浴中冷却,待反应液温度降到0℃后,取5 mmol 4-乙酰吡啶溶于5 mL无水乙醇后,慢慢滴加到上述反应液中。滴加完后,冰浴下继续搅拌,用TLC监测反应进度。反应完全后将反应液倒入冰水中,有大量黄色固体析出,用稀盐酸调节PH到中性后,过滤收集产物,产物用清水洗三次后,干燥,用无水乙醇重结晶得目标物[18,19]。

图4 目标化合物I1-I18的合成路线Fig.4 Synthesis route for target compounds I1-I18
3-(2,4-二氯苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I1)
淡黄色晶体,产率88%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.07(d,J=15.8 Hz,1 H),7.80(d,2 H),7.72(d,1 H),7.52(d,1 H),7.40(d,J=15.8 Hz,1 H),7.35(d,1 H)。
3-(2,3-二氯苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I2)
黄色晶体,产率85%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.06(d,J=15.1 Hz,1 H),7.86~7.71(m,3 H),7.43(t,1 H),7.35(d,1 H),7.30(d,J=15.3 Hz,1 H)。
3-(2,5-二氯苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I3)
淡黄色晶体,产率93%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.07(d,J=15.8 Hz,1 H),7.80(d,2 H),7.72(d,1 H),7.52(d,1 H),7.40(d,J=15.8 Hz,1 H),7.35(d,1 H)。
3-(2,6-二氯苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I4)
黄色晶体,产率98%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.07(d,J=15.1 Hz,1 H),7.82(d,2 H),7.73(d,2 H),7.63(d,1 H),7.34(d,J=15.3 Hz,1 H)。
3-(3,4-二氯苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I5)
黄色固体,产率95%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),7.89~7.78(m,3 H),7.71(d,1 H),7.66(d,1 H),7.32(d,J=14.9 Hz,1 H)。
3-(2,4-二氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I6)
黄色晶体,产率88%;1H NMR(400 MHz,CDCl3):δ 8.88(d,8 2 H),8.07(d,J=15.3 Hz,1 H),7.92(d,2 H),7.71(d,1 H),7.61~7.52(m,1 H),7.43(d,1 H),7.31(d,J=15.1 Hz,1 H)。
3-(2,5-二氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I7)
淡黄色晶体,产率85%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.05(d,J=15.1 Hz,1 H),7.91(d,2 H),7.62~7.32(m,3 H),7.23(d,J=30.1 Hz,1 H)。
3-(2,6-二氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I8)
黄色晶体,产率95%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.07(d,J=15.1 Hz,1 H),7.92(d,2 H),7.62~7.42(m,1 H),7.38~7.25(m,2 H),7.17(d,J=15.3 Hz,1 H)。
3-(3,4-二氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I9)
黄色晶体,产率88%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),7.90~7.74(m,3 H),7.70(d,1 H),7.42~7.39(m,1 H),7.28~7.25(m,1 H),7.11(d,J=15.3 Hz,1 H)。
3-(2-氯-4-氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I10)
淡黄色晶体,产率86%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.03~7.88(m,2 H),7.82(d,2 H),7.67(d,1 H),7.53(d,1 H),7.34(d,J=15.3 Hz,1 H)。
3-(4-氯-2-氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I11)
淡黄色晶体,产率90%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.05~7.88(m,2 H),7.82(d,2 H),7.57~7.33(m,2 H),7.24(d,J=15.1 Hz,1 H)。
3-(4-溴-2-氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I12)
黄色晶体,产率95%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.07(d,J=15.1 Hz,1 H),7.81(d,2 H),7.54(d,2 H),7.47~7.30(m,1 H),7.23(d,J=15.1 Hz,1 H)。
3-(2-溴-4-氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I13)
淡黄色晶体,产率93%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.05(d,J=15.1 Hz,1 H),7.87(d,2 H),7.61~7.49(m,1 H),7.48~7.30(m,2 H),7.28(d,J=15.3 Hz,1 H)。
3-(2,4-二甲氧基苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I14)
黄色晶体,产率90%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.43~8.27(m,1 H),8.07(d,J= 15.1 Hz,1 H),7.82(d,2 H),7.65~7.43(m,2 H),7.24(d,J=15.3 Hz,1 H),3.88(d,6 H)。
3-(2-三氟甲基苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I15)
淡黄色晶体,产率86%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.05(d,J=15.1 Hz,1 H),7.89(d,2 H),7.69(d,1 H),7.53~7.44(m,2 H),7.40~7.27(m,1 H),7.24(d,J=15.3 Hz,1 H)。
3-(4-三氟甲基苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I16)
淡黄色晶体,产率86%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),7.90~7.78(m,4 H),7.76~7.65(m,3 H),7.41(d,J=15.3 Hz,1 H)。
3-(2-甲氧基苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I17)
淡黄色晶体,产率86%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.08~7.91(m,2 H),7.82(d,2 H),7.73(d,1 H),7.63~7.45(m,2 H),7.34(d,J=15.3 Hz,1 H),3.91(s,3 H)。
3-(2-氟苯基)-1-(吡啶-4-基)-2-烯-1-丙酮(I18)
淡黄色晶体,产率86%;1H NMR(400 MHz,CDCl3):δ 8.88(d,2 H),8.04(d,J=15.1 Hz,1 H),7.89(d,2 H),7.77~7.53(m,1 H),7.41~7.32(m,2 H),7.27~7.19(m,1 H),7.11(d,J=15.1 Hz,1 H)。
1.3生物活性测定
1.3.1抑菌活性初步筛选采用生长速率法[20,21],以水稻纹枯病菌(R.solani)、苹果轮纹(P.piricola)、小麦赤霉病菌(F.graminearum)和玉米小斑病菌(B.maydis)为供试对象,对供试的目标化合物(I1-I18)的抑菌活性进行了初步筛选。
称取50 mg待测样品,溶于丙酮后,加入一定量的灭菌的0.1%TW60水溶液,配制成10000 μg/mL的母液备用。配制一定量的PDA培养基,然后分别取49 mL装于150 mL三角瓶中,灭菌后备用。取1 mL配制好的母药液加入到49 mL的PDA培养基中,配制成浓度为100 μg/mL的含药培养基。将配制好的含药的50 mL PDA培养基(55~60℃),摇匀后将其倒入灭菌培养皿中,每个锥形瓶到3个培养皿,以等量的溶剂作为为空白对照,以等剂量的多菌灵为对照药。用打孔器将活化好的待测试的的菌落制成若干菌饼,备用,再用接种环将制备好的菌饼接种到每个培养皿的中央,每个培养皿接一个菌饼,最后置于28℃饱和湿度恒温培养箱中培养.当对照组长到6~8 cm时,测量每个菌落的直径。每个菌落用十字交叉法测量2次,计算出平均数代表菌落的大小。相对抑制率的计算公式如下:
相对抑制率(%)=对照组平均直径-处理组平均直径/对照组平均直径-菌饼直径×100
1.3.2化合物抑菌活性EC50的测定为了更好跟踪化合物的抑菌活性,测定了抑菌活性较好的化合物的EC50值。实验方法与初步筛选方法一致,配制6个不同浓度梯度的含药培养基,测试它们在不同浓度时的抑菌活性(所配浓度的抑菌率应大致分布在50%两侧,全部大于或全部小于50%时则没有统计学意义),然后根据统计学要求,采用线性分析法即可以得到不同化合物的线性回归方程,然后即算出不同化合物的EC50值。
2 结果与分析
2.1抑菌活性初步筛选结果分析
从表中可以看出,该类化合物在100 μg/mL时对四种植物病原菌均表现出了一定的抑菌活性,其中对水稻纹枯病菌的抑菌活性最好,有3个化合物的抑菌率达到90%以上,它们分别是化合物I9(91.36%)、I15(91.20%)和I16(98.47%)。化合物I1和I7表现出了中等的抑菌活性,它们的抑菌率分别为83.71%和80.33%。同时,该类化合物对小麦赤霉病菌也表现出了较好的抑菌活性,其中化合物I16的抑菌率达到93.21%,此外,化合物I9的抑菌率也达到了85.65%。相反的,该类化合物对玉米小班病菌和苹果轮纹病菌两种病菌表现出了中等的抑菌活性,在100 μg/mL的浓度下,大部分化合物对这两种菌的抑制率均分布在30~70%之间不等,其中有几个化合物的抑制率达到了80%以上。化合物I16显示出了较宽的抗菌谱,它对这两种病菌的抑制率仍是最高的,其抑制率分别为89.14%和83.25%。

表1 目标化合物I1-I18的抑菌活性Table 1 Anti-fungal activity of target compounds I1-I18
2.2部分化合物的EC50值
在初步活性筛选时,发现共有3种化合物(I9,I15,I16)对水稻纹枯病菌表现出了大于90%的抑菌活性.因此,选取了(100、75、50、25、20、10 μg/mL)的浓度梯度测试了它们在不同浓度时的抑菌率,得到线性回归方程后,使用SPSS19软件,采用线性回归法计算得它们的EC50值,结果见表2所示.化合物I9,I15,I16的EC50值分别为44.65,45.28,35.43 μg/mL,其中化合物I16的值低于对照药多菌灵(40.56 μg/mL)的值。
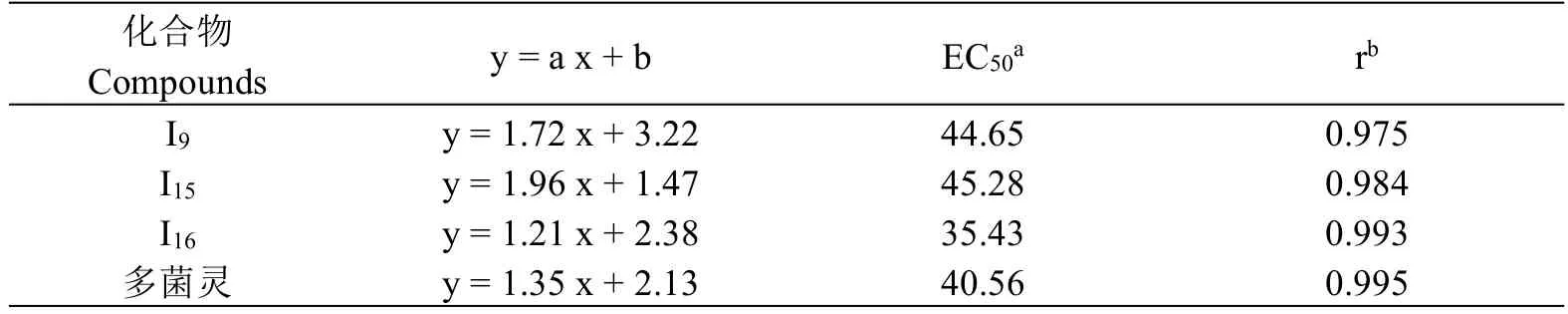
表2 化合物I9,I15和I16的EC50值Table 2 EC50values of compounds I9,I15and I16
2.3化合物的构效关系分析
从表1中抑菌活性数据可以看出:含氟取代基可以明显增强该类化合物的抑菌活性,其中,三氟甲基取代基的效果最明显,化合物I15和I16对四种供试病菌的抑制率均大于80%,且化合物I16对水稻纹枯病菌的抑制率高于对照药多菌灵的值;甲氧基取代基会明显降低化合物的抑菌活性,化合物I14和I17对供试的四种病菌的活性均较低。
3 结论
本文以4-乙酰基吡啶和不同取代基苯甲醛为原料,经过缩合反应得到了18种含吡啶基查尔酮类化合物。采用生长速率法测试了目标化合物对水稻纹枯病菌(R.solani)、小麦赤霉病菌(F. graminearum)、玉米小斑病菌(B.maydis)和苹果轮纹病菌(P.piricola)的抑菌活性,结果表明部分化合物对四种植物病原菌表现出了较好的抑菌活性,其中I16对水稻纹枯病菌表现出了优异的活性,高于对照药多菌灵,其EC50值为35.43 μg/mL。同时化合物I9和I15对水稻纹枯的抑制率也在90%以上。初步构效关系分析表明,当该类化合物的取代基中含有氟特别是三氟甲基时,其抑菌活性明显高于含有其他取代基的同类化合物。此外,化合物I16除了具有较宽的抑菌谱,其对四种病菌的抑菌率都大于80%,它可以作为先导化合物进行更深入的研究。
[1]张一宾.从世界粮食的需求及世界农业发展看农药的重要性[J].世界农药,2009,31(1):1-3
[2]刘建超,贺红武,冯新民.化学农药的发展方向-绿色化学农药[J].农药,2005,44(1):1-4
[3]钱旭红.我国绿色化学农药的基础研究进展—先导结构和作用靶标[C]北京:中国植物保护学会2008年学术年会,2008
[4]Sahu NK,Balbhadra SS,Choudhary J,et al.Exploring pharmacological significance of chalcone scaffold:a review[J]. Curr Med Chem,2012,19(2):209-225
[5]Dimmock JR,Elias DW,Beazely MA,et al.Bioactivities of chalcones[J].Curr Med Chem,2000,6(12):1125-1149
[6]金磊,闫聪彦,甘淋玲,等.查尔酮类化合物生物活性研究新进展[J].中国生化药物杂志,2010(5):358-361
[7]Martin CR.Structure,function,and regulation of the chalcone synthase[J].Int Rev Cytol,1993,147:233-284
[8]Zhao PL,Liu CL,Huang W,et al.Synthesis and fungicidal evaluation of novel chalcone-based strobilurin analogues[J]. J Agr Food Chem,2007,55(14):5697-5700
[9]Svetaz L,Tapia A,Lopez SN,et al.Antifungal chalcones and new caffeic acid esters from Zuccagnia punctata acting against soybean infecting fungi[J].JAgr Food Chem,2004,52(11):3297-3300
[10]Begum NA,Roy N,Laskar RA,et al.Mosquito larvicidal studies of some chalcone analogues and their derived products:structure-activity relationship analysis[J].Med Chem Res,2011,20(2):184-191
[11]Padwa A,Bur SK.The domino way to heterocycles[J].Tetrahedron,2007,63(37):5341-5378
[12]张一宾.含吡啶基的新医药和农药品种及其合成方法[J].精细化工中间体,2010,40(6):1-7
[13]裴娟娟,欧阳贵平,邹骆波.吡啶类农药研究进展[J].精细化工中间体,2014,44(1):1-9
[14]杨吉春,戴荣华,刘允萍,等.吡啶类农药的研究新进展及合成[J].农药,2011,50(9):625-629
[15]Gao P,Hou TP,Gao R,et al.Activity of the botanical aphicides1,5-diphenyl-1-pentanone and 1,5-diphenyl-2-penten1-one on two species of Aphididnae[J].Pest Manag Sci,2001,57(3):307-310
[16]Jin H,Geng Y,Yu Z,et al.Lead optimization and anti-plant pathogenic fungi activities of daphneolone analogues from Stelleracha maejasme L[J].Pestic Biochem Phys,2009,93(3):133-137
[17]Liu W,Shi HM,Jin H,et al.Design,synthesis and antifungal activity of a series of novel analogs based on diphenyl ketones[J].Chem Biol Drug Des,2009,73(6):661-667
[18]Agarwal A,Srivastava K,Puri SK,et al.Synthesis of 2,4,6-trisubstituted pyrimidines as antimalarial agents[J].Bioorg Med Chem,2005,13(15):4645-4650
[19]Kamal A,Reddy JS,Ramaiah MJ,et al.Design,synthesis and biological evaluation of imidazopyridine/pyrimidine-chalcone derivatives as potential anticancer agents[J].Med Chem Commun,2010,1(5):355-360
[20]周国萍,刘伟,金洪,等.新型酰胺类化合物的合成及抗植物病原真菌活性研究[J].四川大学学报:自然科学版,2012,49(4):871-878
[21]周丽,高飞,滕云,等.17种高原草地有毒植物对植物病原真菌生物活性的初步研究[J].四川大学学报:自然科学版,2008,45(1):214-218
Synthesis and Anti-fungal Activity of Chalcones with Pyridyls
ZHAN Shuai-jun,JIN Hong,TAO Ke,HOU Tai-ping*
Key Laboratory of Bio-resource and Eco-environment,Ministry of Education/College of Life Sciences/Sichuan University,Chengdu610064,China
In order to find new anti-fungal leading compounds with high performance and low toxicity,this paper designed and synthesized a series of chalcone analogs with pyridyls according to a principle of splice.Bioassays showed that most of target compounds had a certain anti-fungal activities against Rhizoctorzia solani,Physalospora piricola,Fusarium graminearum and Bipolaris maydis at a dosage of 100 μg/m L.Inhibition rates of compounds I9,I15and I16were more than 90%.The EC50value of compound I16was 35.43 μg/m L,which was higher than the control group Carbendazim(40.56 μg/m L).Furthermore,compound I16showed a broad-spectrum fungicidal activity,its fungicidal rate against four kinds of fungi were greater than 80%.
Pyridyl;Chalcone;synthesis;anti-fungal activity
S482.2
A
1000-2324(2016)02-0166-06
2015-01-11
2015-03-20
国家自然科学基金(31272068)
詹帅军(1988-),男,在读硕士研究生.E-mail:736156374@qq.com
Author for correspondence.E-mail:houtplab@scu.edu.cn
