基于磁纳米颗粒和G-四链体DNA酶的Hg2+传感器研究
2016-10-20邓星辰叶郑堃
张 何,邓星辰,张 洁,傅 昕,叶郑堃
(湖南工程学院 化学化工学院,湘潭 411104)
基于磁纳米颗粒和G-四链体DNA酶的Hg2+传感器研究
张 何,邓星辰,张 洁,傅 昕,叶郑堃
(湖南工程学院 化学化工学院,湘潭 411104)
以磁纳米颗粒(MNPs)为固定DNA探针的固相载体,发展了一种基于分子间裂分G-四链体-血红素DNA酶以及T-Hg2+-T结构的Hg2+“Turn on”检测生物传感器.考察了多种因素对检测体系的影响,在最优实验条件下,该传感器体现出良好的选择性、灵敏度以及抗干扰能力,而且具有可靠的实际水体样品检测能力.以磁纳米颗粒为固相载体,可实现高效、快速及简单的分离,有效的提高检测灵敏度和降低背景信号.
磁纳米颗粒;分子间裂分G-四链体;DNA酶;比色分析;Hg2+
0 引言
近年来由于汞和汞盐的大量生产、使用和不当排放,汞污染已成为全球性重大环境问题之一.水、土壤及大气中的汞,通过食物链在生物和人体内不断富集,可损害中枢和末梢神经,引发水俣病、运动失调、胎儿脑损伤等多种疾病,严重危害着人类的生存和健康[1].在汞污染治理和控制的同时,发展灵敏度高、响应快且抗干扰能力强的Hg2+检测方法具有重要的现实意义.
目前比较成熟的汞检测技术多为仪器分析方法,如原子荧光光谱法[2]、电化学法[3]等.这些方法具有较好的特异性、准确性及灵敏性,但该类技术依赖大型仪器、样品前处理步骤复杂、不适合廉价快速的现场实时检测.利用DNA生物传感器检测 Hg2+,主要是依据核酸中的胸腺嘧啶可以特异性识别Hg2+,形成特殊的T-Hg-T结构[4].Ono A等[5]首次报道了一种基于Thymine-Hg2+-Thymine配位的Hg2+检测新技术,该技术以DNA作为Hg2+的识别元件,具有灵敏度高、特异性好、检测流程不复杂且检测快速等特点,该技术的建立为Hg2+的快速、高效检测开辟了新思路.这类型方法优势虽然明显,但仍然存在一定的局限性,由于传感器没有构建有效的分离体系,在复杂生物样品检测时容易受到干扰.
磁纳米颗粒是一种纳米级磁性材料,因其具有磁导向性和良好的生物相容性,可以与许多生物功能分子结合,在生物组分分离领域得到了广泛的应用[12-13].在传感器的研究进程中,通过体外筛选和SELEX扩增技术,人们发现了一种由富含G碱基的寡核苷酸序列与卟啉铁(hemin)结合形成的具有过氧化物酶催化活性的DNA酶,其具有G-四链体空间结构[14-15].Hemin嵌入式G-四链体DNA酶的催化性能远比游离hemin的强,这种新型的DNA酶制成生物传感器后,被广泛地用于生物分子和金属离子分析[6].
本研究以磁纳米颗粒为DNA探针的固相载体,发展了一种基于分子间裂分G-四链体-血红素DNA酶以及T-Hg2+-T结构的新型Hg2+“Turn on”检测生物传感器,因为Hg2+识别和催化显色步骤分开,通过磁分离有效排除了非特异性干扰,实现了实际水体样品中Hg2+的快速、灵敏、特异的比色分析.
1 实验部分
1.1 仪器与试剂
UV-1800型紫外-可见分光光度计(日本岛津公司);台式冷冻恒温摇床(太仓市实验设备厂);超纯水器(德国默克密理博公司);pH酸度计(杭州陆恒生物科技有限公司);磁分离架(无锡百运纳米科技有限公司).DNA序列A(5’-GGGTAGGGCGGGAACTTTGATTTTGTTTTATCA TGGACGTGCGTGTGAC-C10-Biotin 3’)和DNA序列B(5’-GTCACACGCACGTCCATGATTTTTCATTTT CTTTGAAGGGT-3’)由上海生工生物工程股份有限公司合成并经HPLC纯化;链霉亲和素功能化的磁纳米颗粒(MNPs,直径100nm,德国Chemicell公司);氯化血红素(hemin)、2,2’-连氮基-双-(3-乙基苯并二氢噻挫啉-6-磺酸(ABTS)、30%H2O2、二甲亚砜(DMSO)、HgCl2、Pb(NO3)2、CdCl2、FeCl2及其他金属离子均购自上海生工生物工程股份有限公司;牛血清白蛋白(BSA)购自上海华蓝化学科技有限公司.
1.2 实验方法
1.2.1 磁纳米颗粒功能化
离心管用1%的BSA溶液润洗后,加入15μL包裹链霉亲和素的MNPs(直径为100nm,10mg/mL),同时加入100μL柠檬酸盐缓冲液(150mM NaCl,15mM柠檬酸三钠,pH=7.0),漩涡搅拌,磁分离后弃去上层液,以除去磁珠溶液中的叠氮化钠,重复清洗 3次.然后向MNPs中加入15μL柠檬酸盐缓冲液和15μL DNA序列A (100pmol),混匀后37℃条件下恒温摇床振荡反应1h,使得反应中磁纳米颗粒始终处于悬浮状态.反应结束后,加入150μL PBS(pH=7.4)清洗3次,以去除多余的DNA序列A.在4℃条件下,功能化的MNPs用100μL 2%的BSA溶液封闭 1h,以减少非特异性吸附,命名为MNPs/DNA-A.将上述溶液磁分离后,加入50μL Tris缓冲液(25mmol/L Tris-HCl,100mmol/L NaCl,2mmol/LmgCl2,5mmol/LkCl)和15μL DNA序列B(10μmol/L),37℃条件下恒温摇床振荡反应 30min,形成部分互补的双链DNA,命名为MNPs/DNA-A/DNA-B.溶液磁分离后,用PBS洗涤3次去除多余的DNA序列B,再加入50μL Tris缓冲液4℃下保存待用.
1.2.2 检测方法
取10μL杂交后的磁纳米颗粒(MNPs/DNA-A/DNA-B),用PBS洗涤1次,加入200μL检测试样(含不同浓度Hg2+的Tris缓冲液或者实际样品),搅拌均匀后加入1μL 100μmol/L的hemin于37℃条件下避光反应1h,形成MNPs/DNA-A-Hg2+-DNA-B G-四链体酶,用Tris缓冲液洗涤去除未反应的hemin.当MNPs/DNA-A-Hg2+-DNA-B G四链体酶磁分离后,加入4mmol/L ABTS和4mmol/L H2O2各50μL,37℃反应8min后,将磁珠沉降直接对上层清液进行紫外吸收检测.我们选择 420nm 处的吸光度作为测量值,定义 ΔA420nm=A420nm-A0,其中A420nm为样品测量值,A0为Hg2+浓度为0时的背景值.
2 结果与讨论
2.1 检测原理
本研究借助T-Hg2+-T碱基对的形成以及G-四链体DNA酶的氧化还原催化特性,在磁纳米颗粒上构建了一种Hg2+的“Turn-on”检测新方法.该方法使用了两条寡聚核苷酸探针链(图1,序列A和序列B),序列A 中3’端带有生物素标记和C10延长链,通过生物素和链霉亲和素的特异性结合,固定到链霉亲和素修饰的磁纳米颗粒表面.序列A和序列B部分反向互补,两者杂交形成部分互补的dsDNA.序列A的5’端含有三组GGG重复序列,序列B的3’端含有一组GGG的重复序列,它们各自都不满足G-四链体的形成条件(G-四链体的形成至少需要4组连续的G序列).在没有Hg2+存在时,由于T-T碱基错配导致序列A的5’端和序列B的3’端距离较远,无法形成G-四链体,因此检测体系基本上不显示酶活性.当加入Hg2+时,Hg2+插入T-T碱基形成稳定的T-Hg2+-T配位,从而使序列A的5’端和序列B的3’端的两段富G序列相互接近,进而折叠形成分子间裂分G-四链体,hemin插入G-四链体,导致明显增强的类过氧化物酶的催化活性,能催化ABTS-H2O2体系,生成浅绿色的ABTS+,在420nm处有紫外吸收.
磁纳米颗粒具有很好的生物相容性.环境水样或者生物医学样品都含有一定的检测干扰成分,这些复杂成分在一定程度上会对G-四链体的显色体系产生影响.因此以磁纳米颗粒作为分离手段,在复杂实际样品中与被测物Hg2+反应后可通过磁分离手段与样品中的复杂成分分离,这对检测体系的稳定性是有益的.同时,分离过程中,过量的hemin被除去,屏蔽了由于hemin存在时导致的背景升高的影响,检测时空白背景降低,提高了检测灵敏度.
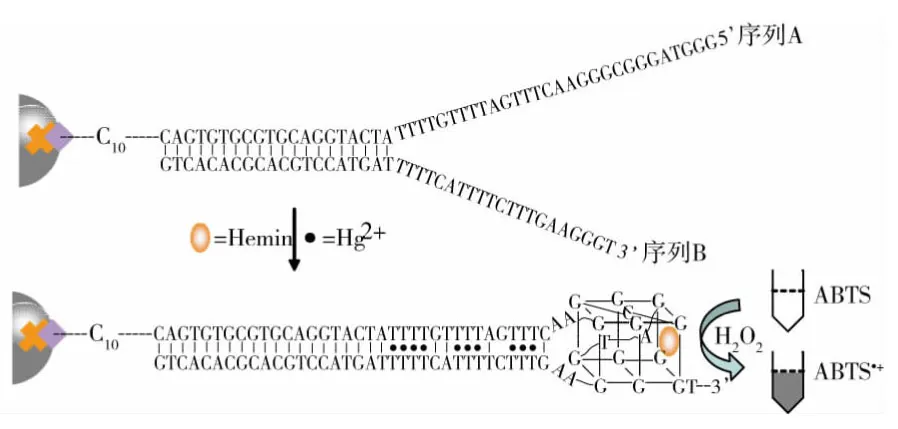
图1 组装的DNA酶传感器检测Hg2+原理图
2.2 “Turn-on”型Hg2+传感器的紫外表征
图2为“Turn-on”型Hg2+传感器的紫外表征图.由于mNPs 本身也具有一定的辣根过氧化物酶催化活性[7],但购买的MNPs表面已经包裹链霉亲和素,另外我们用2% BSA溶液对mNPs/DNA-A表面做封闭处理,使得功能化的磁性纳米颗粒只具有极低的过氧化物酶活性(见图2),经BSA处理后的mNPs 还可以有效降低DNA在磁颗粒表面的非特异吸附.向MNPs/DNA-A中分别加入hemin(图2c)和DNA-B 与hemin的混合溶液(图2d),其各自的催化效率都较低,这是因为体系中没有目标物 Hg2+存在,由于T-T碱基错配的存在导致DNA-A的5’端和DNA-B的3’端距离较远,无法形成G-四链体.在加入Hg2+后(浓度为200nmol/L),420nm处的吸光值大幅上升,这是由于ABTS-H2O2催化反应急剧增加(图2a).这说明当体系中存在Hg2+时,由于T-Hg2+-T 结构的形成使DNA-A的5’ 端和DNA-B的3’ 端的两段富G序列相互接近,进而折叠形成分子间裂分G-四链体DNA 酶,使得催化 H2O2存在下的 ABTS 氧化反应活性增强,这也说明420nm 处吸光度值的升高与 Hg2+有关.ABTS在未氧化成ABTS+前在400~500nm范围内的吸收信号很低(如图2e所示).
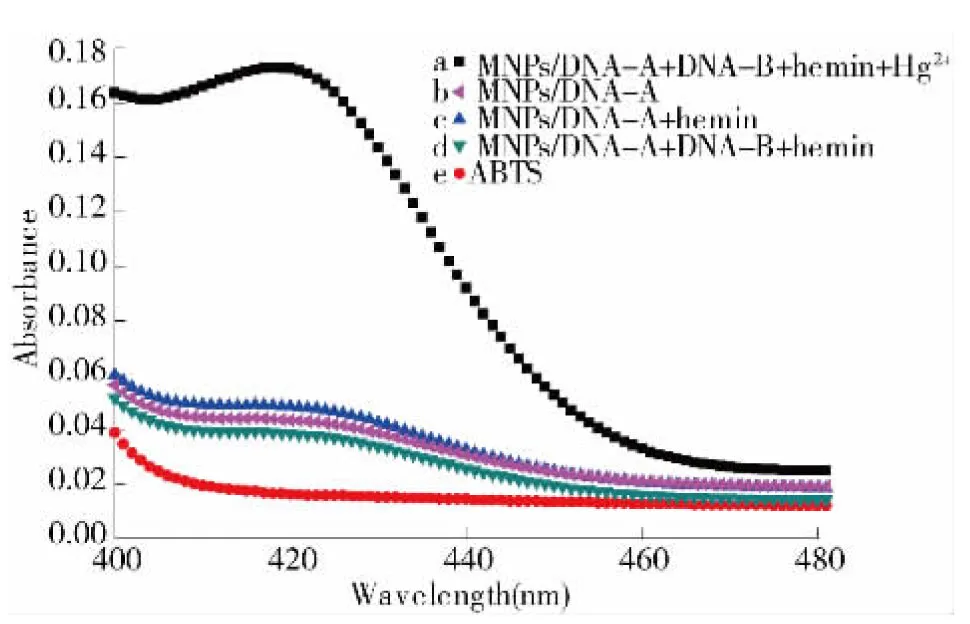
图2 不同组分体系中Hg2+传感器的紫外吸收曲线
2.3 实验条件的优化
为获得最好的实验结果,我们对实验的最佳条件进行了摸索.根据磁纳米颗粒产品的性能,100μL(含1mgmNPs)的MNPs可以结合150pmol生物素化探针,本实验取出的15μL 包裹链霉亲和素的MNPs则可以结合22.5pmol生物素化探针,优化实验Hg2+浓度均为200nmol/L.考察了修饰体系中DNA序列A的量为25pmol、50pmol、75pmol、100pmol、125pmol、150pmol时对G-四链体DNA酶催化性能的影响.结果如图3(a)所示,当修饰时序列A的量为100pmol时MNPs表面的探针固定量达到最高,催化性能达到饱和.ABTS和H2O2按照1∶1比例发生氧化还原反应,参照文献[8-9],实验中ABTS和H2O2的用量均为2mmol/L.考察了DNA酶传感器与Hg2+的反应时间对检测性能的影响.如图3(b)所示,当反应时间从15min增加到60min时,反应体系的ΔA420nm增加,说明随着时间的延长,G-四链体DNA酶的组装量增加,催化性能增强,反应时间达到60min时体系的ΔA420nm达到最大,说明此时Hg2+的捕获趋于饱和,所以选择60min作为Hg2+的捕获时间.另外,在对DNA酶催化反应的最适温度进行了考察,选择了6个不同的温度:20℃、25℃、30℃、37℃、40℃、45℃.如图3(c)所示,随着DNA酶催化反应温度的升高,其酶活性增加,体现在反应体系ΔA420nm的增加,当温度达到37℃时,该酶活性达到最高,这主要是由于DNA在37℃时其生物活性较高.
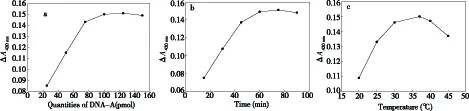
图3 (a)DNA-A的量对ΔA420nm的影响;(b)Hg2+的捕获时间对ΔA420nm的影响;(c)DNA酶催化温度对ΔA420nm的影响
2.4 方法的选择性
为了考察组装的传感器对汞及其他金属离子的选择性,选择了Pb2+、Cd2+、Ca2+、Zn2+、Co2+、Cu2+、Ni2+、Fe2+、Mn2+作为共存离子,共存离子的浓度与汞离子的浓度之比为100∶1.由图4可知,在最佳实验条件下,当Hg2+与其他金属离子共存时,其ΔA420nm值与相同浓度的Hg2+单独存在时相比,相对误差在-7.4%~1.4%之间,说明水样中存在的大量共存离子不影响传感器对Hg2+的高选择性分析.
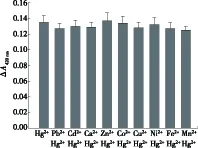
图4 Hg2+传感器的特异性,柱状图表示100nmol/L Hg2+与10μmol/L其他干扰离子共存时的ΔA420nm值
2.5 Hg2+的定量分析
2.5.1 线性范围及检出限
在优化实验条件下,考察了基于G-四链体DNA酶的Hg2+“Turn-on”型检测传感器对不同浓度Hg2+(2~300nmol/L)的响应情况.如图5所示,当Hg2+浓度在150nmol/L以下时,随着Hg2+浓度的增加,ΔA420nm值也随之增加,但增至150nmol/L以上后,ΔA420nm值几乎不再变化.当Hg2+离子浓度在2~80nmol/L 之间时,呈现良好的线性,回归方程为ΔA420nm=0.015+0.0013CHg2+(C: nmol•L-1),线性相关系数r2为0.996.以空白的3倍标准偏差除以标准曲线的斜率得到本方法的检出限为0.7nmol/L.重复6 次测定10nmol/L 的汞离子,其相对标准偏差(RSD)为2.7%.与其他比色分析Hg2+DNA传感器比较,如:基于金纳米颗粒的Hg2+比色传感器(检出限60nmol/L[10]、检出限100nmol/L[9])、基于DNAzyme/ABTS-H2O2体系的Hg2+比色传感器(250nmol/L[8]、19 nmol/L[11]),本方法可以检测复杂试样体系,而且具有较高检测灵敏度.
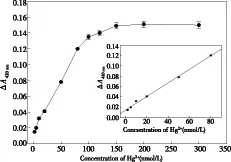
图5 Hg2+浓度在2~300nmol/L范围内的校正曲线,插图为线性范围图
2.5.2 实际水样的测定
我们选择了三种实际水体样品进行分析,分别来自自来水、湖水、河水,过滤去除悬浮颗粒及杂质,用本方法对实际水体样品中的Hg2+含量进行了检测,结果如表1所示.自来水和河水中的Hg2+含量很低,超出了我们的线性范围.采用加标回收法测得样品的平均回收率为96.5%~102.5%之间,RSD在1.4%~2.7%之间,说明设计的传感器可用于天然水体中Hg2+检测,具有很好的准确度.

表1 水体样品分析结果及加标回收实验(n=5)
3 结果与讨论
综上所述,本研究以磁纳米颗粒和分子间裂分式G-四链体-氯化血红素DNA酶为基础发展了一种“Turn-on”型Hg2+比色传感器.磁纳米颗粒的引入极大的增强了传感器的抗干扰能力,降低了背景信号,可以实现天然水体中痕量Hg2+的快速检测,加标回收率误差在允许的范围内.本方法操作简单、灵敏度高、特异性好,适合发展为环境监测现场实时分析技术.
[1] Lin Y,Vogt R,Larssen T.Environmentalmercury in China: a Review[J].Environ.Toxicol.Chem.,2012,31(11) : 2431-2444.
[2] Zheng C B,Li Y,He Y,ma Q,Hou X D.Photo-induced Chemical Vapor Generation with Formic Acid for Ultrasensitive Atomic Fluorescence Spectrometric Determination ofmercury: Potential Application tomercury Speciation in Water[J].J.Anal.At.Spectrom.,2005,20(8): 746-750.
[3] Lu J Q,He X W,Zeng X S,Wan Q J,Zhang Z Z.Voltammetric Determination ofmercury (II) in Aqueousmedia Using Glassy Carbon Electrodesmodified with Novel Calix Arene[J].Talanta,2003,59 (3):553-560.
[4] Yang S Y,Wu C,Tan H,Wu Y,Liao S Z,Wu Z Y,Shen G L,Yu R Q.Label-free Liquid Crystal Biosensor Based on Specific Oligonucleotide Probes for Heavymetal ions[J].Anal.Chem.,2013,85(1): 14-18.
[5] Ono A,Togashi H.Highly Selective Oligonucleotide-based Sensor formercury(II) in Aqueous Solutions[J].Angew.Chem.Int.Ed.,2004,43(33): 4300-4302.
[6] Zhou X H,kong Dm,Shen H X.Ag+and Cysteine Quantitation Based on G-quadruplex-hemin DNAzymes Disruption by Ag+[J].Anal.Chem.,2010,82(3): 789-793.
[7] Gao L Z,Zhuang J,Nie L,Zhang J B,Zhang Y,Gu N,Wang T H,Feng J,Yang D L,Perrett S,Yan X.Intrinsic Peroxidase-like Activity of Ferromagnetic Nanoparticles[J].Nat.Nanotechnol.,2007,2(9): 577-583.[8] Li T,Dong S J,Wang Ek.Label-free Colorimetric Detection of Aqueousmercury Ion (Hg2+) Using Hg2+-modulated G-quadruplex-based DNAzymes[J].Anal.Chem.,2009,81(6): 2144-2149.
[9] 高晓霞,贾玉华,杨金凤,李继山,杨荣华.核酸酶催化放大传感体系的设计及其在铅离子比色检测中的应用[J].分析化学,2013,41(5): 670-674.
[10] Wu Jk,Li L Y,Zhu D,He P G,Fang Y Z,Cheng G F.Colorimetric Assay formercury (II) Based onmercury-specific Deoxyribonucleic Acid-functionalized Gold Nanoparticles[J].Anal.Chim.Acta,2011,694(1-2): 115-119.
[11]kong Dm,Wang N,Guo X X,Shen H X.Turn-on detection of Hg2+Ion Using a Peroxidase-like Split G-quadruplex-hemin DNAzyme[J].Analyst,2010,135(3): 545-549.
Sensor for Detection ofmercury Ions Based onmagnetic Nanoparticles and G-quardruplex DNA Zymes
ZHANG He,DENG Xing-chen,ZHANG Jie,FU Xin,YE Zheng-kun
(School of Chemistry and Chemical Engineering,Hunan Institute of Engineering,Xiangtan 411104,China)
Based on intermolecular split G-quardruplex-hemin DNAzymes and T-Hg2+-T bindingmotif,a biosensor for “Turn on” detection ofmercury ions is developed withmagnetic nanoparticles (MNPs) as carrier to immobilize the DNA probes.The effects of several factors on detection system are investigated.Under optimal conditions,this sensor displays good selectivity,sensitivity and anti-interference capability,and can reliably be used for defection of real water samples.The efficient,fast and simple separation is achieved by usingmagnetic nanoparticles as a solid phase carrier to effectively increase the detection sensitivity and decrease the background signal.
magnetic nanoparticle; intermolecular split G-quardruplex; DNA zymes; colorimetric assay; Hg2+
2016-01-06基金项目:国家自然科学基金资助项目(21005067);湖南省自然科学基金资助项目(2015JJ2039,14JJ3133);湖南省教育厅优秀青年科研资助项目(12B029).作者简介:张 何(1977-),男,博士,副教授,研究方向:微纳流控及纳米传感.
TP391.41
A
1671-119X(2016)02-0056-06
