GC检测鲜切草鱼产品中氯霉素前处理条件优化
2016-10-19刘伟宋志强侯温甫
刘伟 宋志强 侯温甫
摘要:为探究气相色谱法(GC)检测鲜切草鱼中氯霉素(CAP)含量的最佳前处理条件,对加标溶剂、净化方法、C18柱活化过程、C18柱洗脱剂选择、衍生环境、衍生温度、衍生时间7个试验条件进行优化研究。结果表明,水为加标溶剂,选用C18柱为净化萃取柱,萃取柱活化方法为甲醇、氯仿、甲醇、水依次加入5 mL,甲醇为洗脱剂,用量为2 mL×2 mL,在70 ℃恒温条件下衍生25 min,回收率可达到118.8%~120.0%,RSD为0.12%~0.96%。
关键词:鲜切草鱼;氯霉素;气相色谱;前处理条件
中图分类号:TS207 文献标识码:A 文章编号:0439-8114(2016)08-2093-04
DOI:10.14088/j.cnki.issn0439-8114.2016.08.044
Abstract:To explore the best pretreatment conditions through gas chromatography method to detect the content of chloramphenicol in fresh cut grass carp. Optimized 7 experimental conditions: spik standard solvent, extraction method, the method of activating the C18 column, the eluting agent of the C18 column, derivative environment, derivative temperature and derivative time. The experimental conditions of gas chromatography method was optimized that the spiked standard solvent was water;extraction column was C18 column;the method of activating the extraction was adding 5 mL methanol,5 mL chloroform,5 mL methanol,5 mL water in order;the eluting agent was methanol with the amount of 2 mL×2 mL;the derivative condition was 70 ℃ for 25 min. The recovery was reached between 118.8%~120.0%, and the value of RSD was between 0.12%~0.96%.
Key words: fresh cut grass carp; chloramphenicol;gas chromatography;pretreatment condition
氯霉素屬广谱抗生素,曾在畜牧业、水产业中广泛使用[1]。氯霉素有较强的毒副作用,如果氯霉素在食用动物中残留,可通过食物链传给人类,长期微量摄入氯霉素,不仅使人体肠道正常菌群失调,而且还会引起多种疾病,对人类的健康造成危害。世界上许多国家禁止氯霉素用于生产食品动物,并规定了在畜产品中氯霉素不得检出。美国[2]和芬兰[3]规定氯霉素不得检出,欧共体规定氯霉素残留量不得超过10 ng/g,中国则规定氯霉素含量≤2 ng/g[4]。中国农业部明文禁止在所有食品动物中使用氯霉素药物[5]。一方面,氯霉素的代谢需要一定的周期,其影响可能持续1~2年;另一方面,个别养殖户不顾国家禁令继续使用该抗生素也将使得氯霉素对水产品的食用安全构成严重危害[6]。
目前,氯霉素检测方法虽有酶联免疫法、气相色谱法、液相色谱法、液质联用法、微生物法等多种,但气相色谱法为检测氯霉素含量的常规方法。然而,气相色谱法检测过程中样品前处理较复杂,操作技术要求高,易出现回收率偏低的现象[7-11]。同时,不同样品由于基质不同,前处理条件存在较大差异。鲜切草鱼产品是继冷鲜肉、鲜切蔬菜等后逐步发展起来的新型鱼肉销售产品,为保证食用安全,氯霉素残留的检测必不可少。目前,针对鲜切草鱼产品中氯霉素含量的检测研究较少,利用气相色谱法检测鲜切草鱼肉中氯霉素含量的文章鲜有报道,本研究通过对气相色谱法检测草鱼产品中氯霉素含量的前处理条件进行优化,确定鲜切草鱼中氯霉素含量的最佳前处理条件,以期为采用GC法检测鲜切草鱼中氯霉素含量提供参考。
1 材料与方法
1.1 材料与试剂
草鱼购自于武汉市常青花园武商量贩超市,去内脏后运回实验室,清洗预冷后进行分割,加工成鲜切草鱼鱼腩产品。
氯霉素标准品、阿拉丁试剂,上海晶纯实业有限公司;BSTFA+TCMS(99:1),美国Regis公司;乙酸乙酯(色谱纯)、甲醇(色谱纯)、正己烷(色谱纯)、三氯甲烷(分析纯)、无水硫酸钠(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
TGL-16A型医用离心机,长沙平凡仪器仪表有限公司;Milli-Q Integral型超纯水机,美国Millipore公司;SB-5200DTN型超声波清洗机,宁波新芝生物科技股份有限公司;MIR-154型低温恒温培养箱,三洋电机株式会社;DHG-9140A型电热鼓风干燥箱,上海一恒科学仪器有限公司;RE-2000A型旋转蒸发仪,上海亚荣生化仪器厂;XH-C型旋涡混合器、FSH-2A型可调高速匀浆机、HH-S2型数显恒温水浴锅,金坛市医疗仪器厂;ASE-16型固相萃取仪、MTN-2800D型氮吹浓缩装置,天津奥特赛恩斯仪器有限公司;移液器(100 μL、1 mL、5 mL),德国Eppendorf公司;HP-5毛细管色谱柱(30 m×0.32 mm×0.25 μm)、Agilent 7890A型气相色谱系统(配有7693自动进样器),美国Agilent公司。
1.3 方法
1.3.1 加标溶剂优化 分别称取0.01 g氯霉素标准品3份,2份分别用甲醇和乙腈将其溶解后定容到100 mL,另1份用少量甲醇将标准品进行溶解,用水定容到100 mL,然后分别配成0.1、0.5、1.0 μg/mL浓度的标准溶液。分别取1 mL加入到鲜切草鱼肉制品中,按标准SC/T3018-2004进行前处理,气相色谱检测,优化加标溶剂。
1.3.2 净化方法优化 称取鱼肉样品5 g,添加浓度为0.1、0.5、1.0 μg/mL的氯霉素标准溶液,相当于添加量为0.05、0.10、0.20 μg/g。按照标准SC/T 3018-2004进行提取,分别采用无水硫酸钠柱、C18柱、无水硫酸钠柱+C18柱3种净化方法对提取液进行净化处理,每组做3个平行,净化处理后按照标准方法进行衍生化处理,最后采用气相色谱法对氯霉素进行GC检测。
1.3.3 C18柱活化 称取鱼肉样品5 g,分别加入1 mL浓度为0.1、0.5、1.0 μg/mL的氯霉素标准溶液,按照标准方法提取。采用2种方法对C18柱进行活化,4步法:按甲醇、氯仿、甲醇、水各5 mL的顺序分别过柱活化;2步法:10 mL甲醇、10 mL水过柱活化。
1.3.4 洗脫剂的选择 称取鱼肉样品5 g,加入0.1、0.5、1.0 μg/mL浓度的氯霉素标准溶液1 mL,按照标准方法进行提取。按甲醇、氯仿、甲醇、水各5 mL的顺序分别过柱活化,提取液过柱净化后,分别选用2 mL×2 mL的甲醇和乙腈进行洗脱。
1.3.5 衍生环境优化 取浓度为0.5 μg/mL的标准溶液1 mL于10 mL试管内,氮气吹干,避免吸潮。加入100 μL BSTFA+TCMS(99∶1)后分别于烘箱、水浴、超声波3种衍生环境下进行衍生,每组3个平行,衍生温度均为70 ℃,衍生时间为30 min。衍生后氮气吹干,进行GC检测。
1.3.6 衍生温度优化 分别将1 mL 浓度为0.1、0.5、1.0 μg/mL的氯霉素标准溶液加入到10 mL的玻璃试管内,氮气吹干,避免吸潮。加入100 μL BSTFA+TCMS(99∶1)于“1.3.5”中最优衍生环境进行衍生,分别在50、60、70、80 ℃温度下衍生,30 min后氮气吹干,进行GC检测。
1.3.7 衍生时间优化 分别取浓度为0.1、0.5、1.0 μg/mL的氯霉素标准溶液1 mL于10 mL试管内,氮气吹干,避免吸潮。加入100 μL BSTFA+TCMS(99∶1)硅烷化试剂进行衍生,在其最适温度下分别反应10、20、30、40、50、60 min后进行GC检测,每组3个平行,对衍生的最适反应时间进行优化。
2 结果与分析
2.1 加标溶剂对加标回收率的影响
分别用甲醇、乙腈和水3种溶剂溶解氯霉素标准品,分别稀释为0.1、0.5、1.0 μg/mL加入到鲜切草鱼鱼肉产品中。通过GC检测,比较3种溶剂对加标回收率的影响,结果见表1。由表1可以看出,水作为加标溶剂时回收率及RSD分别为96.18%~107.00%和2.99%~4.18%;而乙腈作为加标溶剂时回收率和RSD分别为86.93%~90.31%和2.06%~15.88%;甲醇作为加标溶剂时,当加标浓度增大时,回收率下降为87.98%,而且RSD较大。水作为加标溶剂时,回收率相对较高,乙腈则相对较差,仅为86.93%~90.31%,且平行性较差。当加标浓度较高时,甲醇与乙酸乙酯、水两者互溶会造成少量损失。氯霉素易溶于乙酸乙酯,但水与乙酸乙酯两者不互溶,因此氯霉素全部被萃取到乙酸乙酯相中,回收效果较好,选取水为最优加标溶剂。
2.2 净化方法对回收率的影响
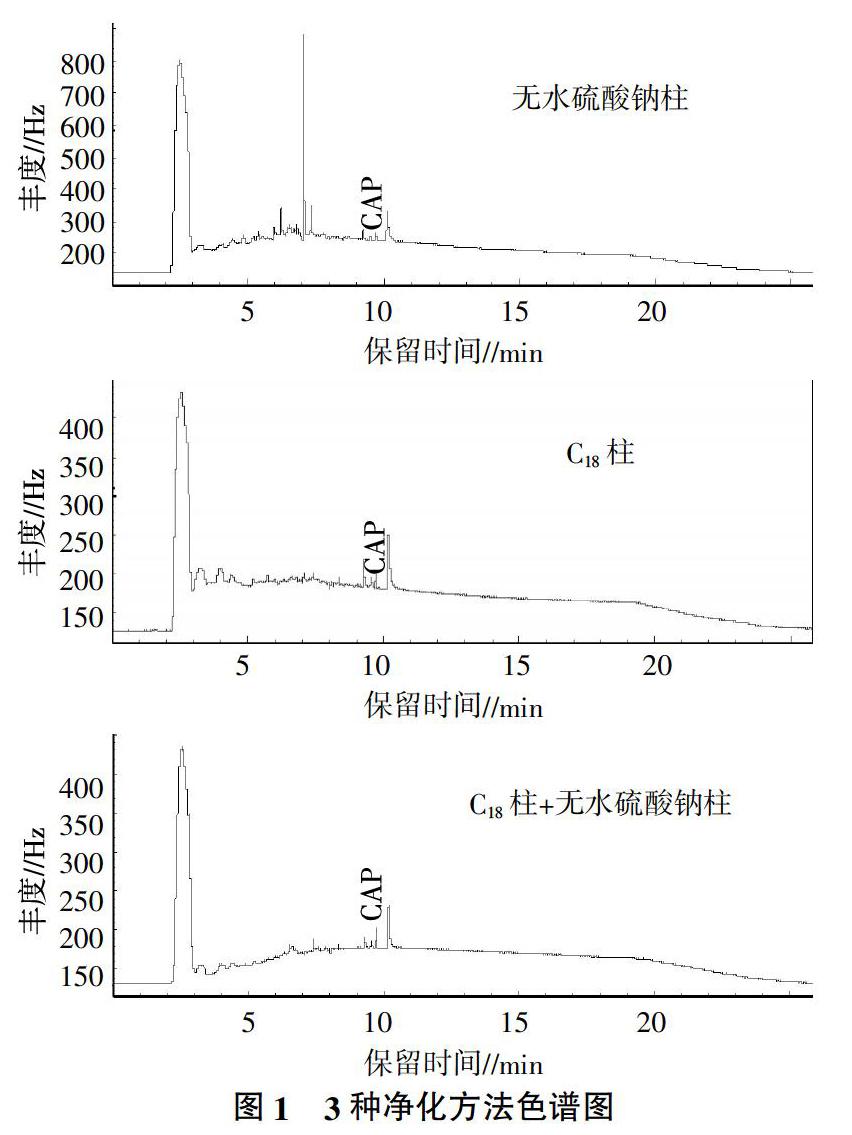
分别将0.1、0.5、1.0 μg/mL 3种浓度氯霉素样品加入到不含氯霉素的草鱼鱼肉样品中,用乙酸乙酯进行提取,提取液分别经3种净化处理,通过比较回收效果和出峰效果,选取出最优净化方法。由表2可以看出,无水硫酸钠柱、C18柱、无水硫酸钠柱+C18柱3种净化方法在0.02、0.10、0.20 μg/g不同加标浓度下回收率分别为82.56%~93.73%、74.49%~92.44%、86.12%~107.97%。因此,无水硫酸钠柱+C18柱组合净化方法的回收效果最好,其次为C18柱,无水硫酸钠柱的净化效果最差,但总体差别不显著。
由图1可以看出,无水硫酸钠柱净化后出现较多杂峰,C18柱、无水硫酸钠+C18柱净化效果较好。但无水硫酸钠柱+C18柱组合净化方法中无水硫酸钠净化操作复杂,需要二次旋蒸浓缩,耗费检测时间。C18柱无论在净化效果还是回收率都已满足要求,而且操作简单,一次可进行多个样品同时净化,节省检测时间,选定C18柱为最佳净化方法。
2.3 C18柱活化方法对回收率的影响
向鲜切草鱼鱼肉产品中分别加入0.1、0.5、1.0 μg/mL浓度的氯霉素溶液,通过C18柱净化方法进行处理,过柱前对C18固相萃取柱进行活化处理。活化选用2种方法,回收效果见表3。图2为1.0 μg/mL标准溶液在2种活化方法下的色谱图。由图2可以看出,2步法和4步法的回收率在低浓度时,4步法活化效果较好,回收率为92.83%,而2步法仅为88.39%。在3个浓度下4步法的平行性相对较好,RSD为0.55%~1.28%,而2步法RSD为0.98%~9.07%,因此选择4步法。
2.4 C18柱洗脱剂对回收率的影响
C18柱净化后,分别选用2 mL×2 mL的乙腈、甲醇洗脱目标物再进行GC检测,检测结果见表4。由表4可以看出,甲醇洗脱目标物时,回收率为86.00%~103.82%,RSD为0.68%~3.18%,而乙腈洗脱时回收率为78.30%~97.67%,RSD为0.62%~6.84%。甲醇作为洗脱剂,回收率高、稳定性好,因此甲醇作为C18柱的净化洗脱剂效果较好。
2.5 衍生环境对衍生结果的影响
将1 mL的0.5 μg/mL标准溶液,在氮气下吹干后,置于3种环境中70 ℃衍生30 min,衍生结果见表5。从表5中可以看出,在烘箱环境中,衍生效果最好,回收率为99.24%,衍生完全,但RSD为15.09%,稳定性较差。而超声环境和水浴环境下的回收率仅为73.97%和64.03%,这是因为硅烷化试剂易吸潮,遇水会分解、失效。虽然水浴、超声处理时已做密封处理,但在70 ℃条件下,水蒸气较多,容易进入衍生环境,因此选择烘箱为最佳衍生环境。
2.6 衍生温度对衍生结果的影响
将1 mL 的0.5 μg/mL标准溶液,在氮气下吹干后,置于50、60、70、80 ℃ 4个温度下烘箱环境反应30 min,结果见表6。由表6可以看出,温度为50 ℃时回收率低于60%,当温度为60 ℃时回收率上升,到70 ℃时回收率最高,回收率达到113.40%。在50~60 ℃条件下,未达到BSTFA+TCMS(99∶1)硅烷化试剂与氯霉素的反应温度,部分硅烷化试剂没有充分反应,造成回收率较低。当温度达到80 ℃时由于温度过高,部分衍生物挥发损失,造成回收率的降低。因此70 ℃左右為氯霉素最佳衍生温度,硅烷化试剂衍生完全,回收效果最佳,选取70 ℃为最适衍生温度。
2.7 衍生时间对衍生结果的影响
将1 mL的0.5 μg/mL标准溶液,在氮气下吹干后,在70 ℃烘箱环境下反应10、20、30、40、50、60 min 6个时间段,衍生结果见图3。由图3可以看出,当反应时间在10 min时回收率已经达到99.6%,20~30 min时回收率最高,而30 min后回收率降低。BSTFA+TCMS(99∶1)硅烷化试剂在70 ℃下可以快速与氯霉素反应,最佳反应时间为20~30 min,回收率达到118.8%~120.0%,RSD为0.12%~0.96%,因此,衍生时间可设定为25 min。反应时间过长,回收率降低,可能因为时间过长引起衍生物的气化损失,但这与沈美芳等[7]研究的结果不同。
3 小结
本研究优化了鲜切草鱼中氯霉素含量的气相色谱检测方法的前处理条件。结果表明,①选用超纯水做为加标溶剂,回收效果和稳定性均较甲醇和乙腈作为加标溶剂的好;②选用C18柱进行净化,该方法不仅操作简单,净化速度快,而且可以同时净化多个样品,回收效果和稳定性也相对较好;③C18柱的活化则选用甲醇、氯仿、甲醇、水各5 mL的顺序进行活化,活化效果完全,净化效果较好;④选择2 mL×2 mL甲醇作为目标物的C18柱净化后洗脱剂,洗脱效果较好,回收率高;⑤衍生环境为烘箱,烘箱简单易得,并能保证反应时处于完全干燥的环境下,避免硅烷化试剂吸潮失效;⑥最适衍生温度为70 ℃,回收率最高;⑦衍生最适反应时间为25 min。通过对上述条件的优化,获得了适用于鲜切草鱼产品氯霉素含量检测的气相色谱检测法的最优前处理条件,优化后的前处理方法操作简便、耗时少、回收效果好、准确性和稳定性高,为鲜切草鱼氯霉素的检测提供了有效的参考。
参考文献:
[1] 谢守新,林海丹,秦 燕,等.液相色谱—电喷雾串联质谱内标法测定水产品中氯霉素药物残留[J].中国卫生检验杂志,2006, 16(11):1298-1300.
[2] CAMPBELL G S,MAGEAU R P,SCHWAB B,et al.Detection and quantitation of chloramphenicol by competitive enzyme-linked immunoassay[J]. Antimicrob Agents Chemother,1984,25(2):205-211.
[3] KEUKENS H J,BEEK W M J,AERTS M M L,et al. High-perfomance liquid chromatographic screening and confirmation method for chloramphenicol residues in meat with off-line cartridge sample clean-up and on-line diode array UV-VIS detection[J]. Journal of Chromatograpgy,1986,352:445-453.
[4] 朱蓓蕾.动物性食品药物残留[M].上海:上海科学技术出版社,1994.
[5] 庄 宛,叶 玫.动物性食品中氯霉素(CAP)残留检验方法概述[J].福建畜牧兽医,2004,26(1):8-10.
[6] 黄志勇,李 森,孙茂营,等.养殖水产品中氯霉素残留量的高效液相色谱测定方法[J].食品科学,2005,26(5):191-194.
[7] 沈美芳,吴光红,费志良,等.气相色谱法测定水产品中氯霉素残留前处理方法的比较[J].水产学报,2005(2):103-108.
[8] SC/T 3018-2004,水产品中氯霉素残留量的测定气相色谱法[S].
[9] 陶昕晨,黄 和.水产品中氯霉素类药物残留检测技术的研究进展[J].中国畜牧兽医,2012,39(7):94-98.
[10] 杨 方,陈国南.高效液相色谱法同时检测水产品中氯霉素,甲砜霉素与氟甲砜霉素残留[J].福建分析测试,2005,14(1):2112-2113.
[11] 刘永涛,李 荣,袁科平,等.气相色谱法同时测定水产品中氯霉素,氟甲砜霉素和甲砜霉素残留量[J].淡水渔业,2007, 37(2):44-47.
