榕江小香羊GnRH基因多态性及其与繁殖性状关联性分析
2016-10-19李志惠李德
李志惠 李德

摘要:为了探讨GnRH基因SNP与榕江小香羊繁殖性状关联性,试验以榕江小香羊为研究对象,采用DNA池法及PCR-SSCP技术检测GnRH基因单核苷酸多态性。结果表明,榕江小香羊GnRH基因內含子3检测到1个SNP位点T-68G,该位点表现为3种基因型,分别命名为TT、TG和GG。基因型与繁殖性状关联分析显示,榕江小香羊GG基因型个体的产羔数显著高于TT和TG基因型个体(P<0.05)。研究结果提示GnRH基因可能是影响山羊产羔数的主效基因或与主效基因连锁,T-68G位点可望作为提高山羊个体繁殖性能的分子遗传标记。
关键词:榕江小香羊;GnRH基因;PCR-SSCP;繁殖性状
中图分类号:S827;S813 文献标识码:A 文章编号:0439-8114(2016)08-2058-04
DOI:10.14088/j.cnki.issn0439-8114.2016.08.035
Abstract:In order to analyze the link between polymorphisms of GnRH gene and reproduction traits in Rongjiang small xiang goat. Selecting Rongjiang small xiang goats as testing subjects, the single-nucleotide polymorphism(SNP) of GnRH gene was detected by applying DNA pooling method and PCR-SSCP technology. The results showed that, one SNP loci T-68G was detected in intron 3 of GnRH gene in Rongjiang small xiang goats. The SNP loci assumed three genotypes named as TT, TG and GG respectively. The association analysis of genotypes and reproduction traits revealed that individuals of Rongjiang small xiang goat with genotype GG have obvious litter size more than those with genotype TT and TG (P<0.05). The finding indicated that, GnRH gene was primarily deduced to be a potential major gene or linked to major gene effecting goat litter size, and the T-68G loci might be a candidate molecular marker for improving individual reproduction traits of goat.
Key words:Rongjiang small xiang goat;GnRH gene; PCR-SSCP;reproduction traits
促性腺激素释放激素(Gonadotropin releasing hormone,GnRH),是一种由脑组织分泌的十肽神经激素,它是下丘脑-垂体-性腺轴的关键神经内分泌调节因子。这种十肽小分子由下丘脑的神经内分泌细胞分泌,然后进入门静脉系统随血流进入垂体,并与位于垂体前叶的促性腺激素细胞上的特异性受体结合,从而刺激垂体细胞分泌黄体生成激素和卵泡刺激激素,进而促进性腺的生长、成熟和调控哺乳动物的繁殖力[1-3]。MacColl等[4]研究发现,若GnRH基因的蛋白表达受到抑制或突变,则会导致不育;Okubo等[5]发现GnRH及GnRHR的相互作用对动物的繁殖性能具有调节作用。
本试验以榕江小香羊为研究对象,采用PCR-SSCP(单链构象多态性,Single-strand conformation polymorphism,SSCP)技术对GnRH基因部分外显子4及内含子3进行单核苷酸多态性(Single nucleotide polymorphism,SNP)检测,并通过SNP分析其与榕江小香羊繁殖性状相关性,以期为寻找山羊繁殖性状的遗传标记奠定基础,同时为地方山羊品种的选育和种质鉴定提供理论依据。
1 材料与方法
1.1 试验材料
试验均采集具有前3胎产羔记录的榕江小香羊,且饲养管理条件相同。榕江小香羊130只来自贵州省雷山县。每只山羊颈静脉采血5 mL,收集于加入抗凝剂的采血管中,置于冰盒带回实验室于 -40 ℃低温冰箱保存备用。
1.2 主要试剂
Ezup柱式血液基因组DNA抽提试剂盒,聚丙烯酰胺凝胶,琼脂糖凝胶,2×Es Taq Master Mix,DM2000,6×DNA Loading,Buffer1×TBE缓冲液均购自贵州鼎国生物工程有限公司。
1.3 DNA提取与DNA池构建
贵州鼎国生物工程有限公司Ezup柱式血液基因组DNA抽提试剂盒提取DNA,1%琼脂糖凝胶电泳检测DNA提取效果,NanoDrop2000超微量分光光度计测定DNA样品浓度,置于-20 ℃冰箱中保存备用。调整所有个体DNA样品浓度至相同的100 ng/μL,分别取5 μL混合构建DNA池。
1.4 引物设计与合成
根据NCBI中GenBank数据库中绵羊GnRH基因序列进行引物设计, GnRH基因登录号为BC120472。利用Primier-BLAST在线软件针对外显子4和内含子3区域设计特异性引物,引物信息见表1。引物由生工生物工程(上海)股份有限公司合成。
1.5 PCR反应体系及条件
1.5.1 DNA池PCR PCR反应体系为10 μL:基因组DNA 1 μL,2×Es Taq Master Mix 5 μL,上、下游引物(10 pmol/μL)各0.75 μL,雙蒸水2.5 μL。PCR反应程序为:95 ℃预变性3 min;95 ℃ 变性30 s,60 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃延伸5 min,4 ℃保存。PCR产物于1%琼脂糖凝胶电泳检测,凝胶成像系统观察结果。选择特异性好的PCR产物送北京诺赛基因组研究中心有限公司进行测序。
1.5.2 PCR-SSCP PCR反应程序为95 ℃预变性 3 min;34个循环(95 ℃变性30 s,59 ℃退火 30 s,72 ℃延伸3 min);72 ℃延伸5 min;4 ℃保存。PCR反应体系为20 μL:2×Es Taq Master Mix 10 μL,DNA模板2 μL,上、下游引物各1.5 μL,加水至20 μL。SSCP所需PCR产物用10%的聚丙烯酰胺凝胶电泳检测。取5 μL PCR产物于1%琼脂糖凝胶电泳检测。取8 μL的PCR产物和8 μL的变性剂,100 ℃水浴10 min后置于-20 ℃冰箱中20 min。250 V电压预电泳30 min,去除PAG胶中杂质,点样完成后先进行250 V电压预电泳30 min,后110 V电压进行16 h左右电泳,最后经固定、银染、显色后进行分辨条带带型。
1.6 PCR产物测序
用1%琼脂糖凝胶电泳对PCR产物进行检测,凝胶成像系统观察电泳结果。选择条带单一、产量高的PCR产物送交北京诺赛基因组研究中心有限公司进行双向测序。用DNAStar软件对序列结果进行校正,Blast分析确定SNPs。
1.7 统计分析
建立了一般线性模型进行标记与繁殖性状的关联分析:Yijk=u+FTi+Gj+Eijk。式中,Yijk为个体表型,u为群体平均值,FTi为胎次效应,Gj为基因型效应,Eijk为随机误差。利用SPSS19.0统计软件对数据进行分析,并采用最小二乘法拟合线性模型对个体基因型和产羔数进行差异显著性检测,以P<0.05为差异显著水平,P﹤0.01为差异极显著水平,结果均以“最小二乘均值±标准误”表示。
2 结果与分析
2.1 基因组DNA提取结果
对提取的基因组DNA经1%的琼脂糖凝胶电泳检测,结果见图1。由图1可知,所提DNA完整性较好,条带整齐、单一,经紫外分光光度计检测,其OD260 nm/OD280 nm在1.6~1.8之间,表明所提基因组DNA纯度较好,无须纯化,可直接用于PCR扩增试验。
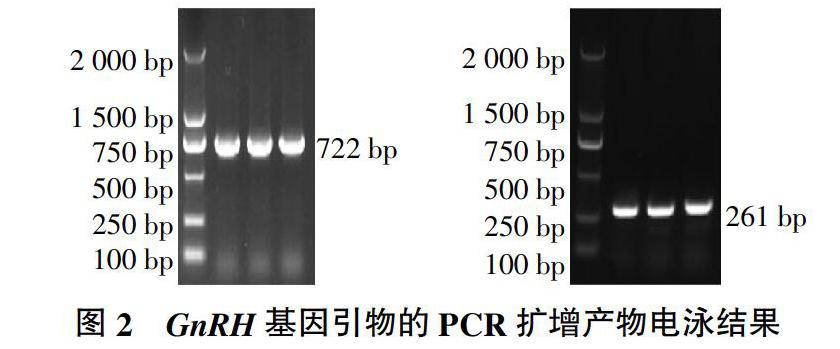
2.2 PCR产物检测
用1%的琼脂糖凝胶对PCR产物进行电泳检测(图2)。由图2可见,各引物的扩增片段条带清晰、明亮、无拖尾现象,表明扩增片段与目的片段大小一致,说明所设计引物特异性较好,可直接用于测序。
2.3 PCR产物序列分析
2.3.1 DNA池PCR产物测序结果 以上述构建好的DNA池为模板DNA进行PCR扩增反应,选取条带好的PCR产物送北京诺赛基因组研究中心有限公司进行测序。应用DNAStar软件中MegAlign和sequMan程序对测序结果进行组装、拼接和比对,结果见图3。由图3可见,在榕江小香羊中GnRH基因内含子3发现一个SNP,命名为T-68G(本文中SNP位置均以外显子4第一位碱基为第一位计算)。
2.3.2 PCR-SSCP分型及测序 SSCP分析发现,在榕江小香羊GnRH基因内含子3第1 461 bp处均检测到2种等位基因T和G,在榕江小香羊试验群体中发现3种基因型,分别定义为TT、TG和GG。GnRH基因内含子3扩增产物经变性显色后电泳图谱见图4。
选择榕江小香羊不同基因型个体PCR产物送北京诺赛基因组研究中心有限公司测序(图5),通过SepMan程序分析测序结果并比对,结果T-68G位点发现3种不同的基因型,TT型为与GenBank上提交的序列(登录号:NC_019468.1)一致的野生型基因型个体,GG型定义为纯合突变型,TG型定义为杂合突变型。
2.4 GnRH基因第3内含子SNP位点群体遗传变异分析
对SNP位点T-68G进行遗传参数统计,结果见表2。由表2可见,榕江小香羊以TT基因型为优势基因型,其基因型频率为0.554。等位基因T为优势等位基因,其频率为0.735。该基因纯合度为0.610,杂合度为0.390。榕江小香羊群体表现为中度多态(0.25 2.5 GnRH基因内含子3多态性与繁殖性状关联性分析 对GnRH基因T-68G位点多态性与榕江小香羊试验群体繁殖性状指标进行差异显著性检验,结果见表3。由表3可知,在榕江小香羊试验群体中,T-68G位点GG基因型的产羔数显著高于TT和TG基因型(P﹤0.05),而TT和TG基因型之间产羔数差异不显著(P >0.05)。 3 讨论 国内外对GnRH在山羊上多态性的研究较少,主要是集中在人类性早熟和一些禽类上的多态性的研究。Sedlmeyer等[6]对GnRH基因进行了多态性的分析,检测出T171C、G1215C和A1251C 3处突变,分析发现这些突变可能与人类的青春期推迟有关;Wu等[7]对文昌鸡GnRH基因研究发现,300日龄和400日龄的产蛋数受GnRH基因型影响显著(P﹤0.05);吴旭等[8]采用PCR-SSCP技术对番鸭GnRH基因5端研究发现,300日龄番鸭的产蛋量以及最长连产天数与该位点显著相关(P﹤0.05);颜泉梅等[9]采用PCR-SSCP技术检测布尔山羊和西农莎能奶山羊GnRH基因第4外显子的多态性,发现两种山羊群体中,CC和CT基因型个体的平均产羔数均显著高于TT基因型个体(P<0.05);An等[10]在波尔山羊、西农莎能奶山羊和关中奶山羊的群体中研究发现GnRH基因存在两个突变位点,这两个突变位点对于不同胎次母羊的产羔数影响不同。由以上研究结果可推测GnRH基因可以作为山羊产羔性状候选基因的分子标记。
本试验采用混合DNA池、PCR-SSCP技术和直接测序方法对榕江小香羊GnRH基因进行了多态性检测和验证,在GnRH基因内含子3检测到1个SNP位点T-68G。针对该SNP位点设计一对特异引物,采用SSCP结合直接测序技术对其进行验证。结果显示小香羊试验群体T-68G位点处存在3种基因型TT、TG和GG。与产羔数的相关性分析显示,T-68G位点与榕江小香羊试验群体繁殖性状显著相关,具体表现为小香羊GG基因型个体的产羔数显著高于TT和TG基因型的个体。由此可以推断GG基因型可能是榕江小香羊繁殖性能的有利基因型,该基因的T-68G位点可望作为榕江小香羊繁殖性能选择的遗传标记而应用于榕江小香羊的分子选育。
4 结论
本研究运用PCR-SSCP技术结合PCR产物直接测序法对筛选到的多态位点进行检验并验证了DNA池快速筛查SNP的可行性,同时对多态性位点T-68G表现的3种基因型与榕江小香羊繁殖性状进行了关联性分析,发现T-68G基因型GG对榕江小香羊产羔数存在显著影响。GnRH基因为利用分子遗传标记辅助选择来提高山羊个体繁殖性能指标提供了参考,有望作为改善山羊繁殖性状的候选基因。
参考文献:
[1] CASA?譙 E M, RAGA F, BONILLA-MUSOLES F, et al. Human oviductal gonadotropin-releasing hormone: Possible implications in fertilization, early embryonic development, and implantation[J]. The Journal of Clinical Endocrinology & Metabolism, 2000,85(4):1377-1381.
[2] 卢月娇,胡 炜,朱作言.鲤鱼发育早期HPG轴和GH/IGF轴相关因子的转录起始分析[J].水生生物学报,2009(6):1126-1131.
[3] 徐元青,王建林,宋国强,等.GnRH在妊娠期黄牛下丘脑—垂体—卵巢轴中的表达[J].畜牧兽医学报,2010,41(12):1649-1654.
[4] MACCOLL G,QUINTON R, BOULOUX P M G. GnRH neuronal development: insights into hypogonadotrophic hypogonadism[J].Trends in Endocrinology & Metabolism,2002,13(3):112-118.
[5] OKUBO K,NAGATA S,KO R,et al. Identification and characterization of two distinct GnRH receptor subtypes in a teleost, the medaka Oryzias latipes[J]. Endocrinology,2001,142(11):4729-4739.
[6] SEDLMEYER I L,PEARCE C L,TRUEMAN J A,et al. Determination of sequence variation and haplotype structure for the gonadotropin-releasing hormone(GnRH) and GnRH receptor genes: Investigation of role in pubertal timing[J]. The Journal of Clinical Endocrinology & Metabolism,2005,90(2):1091-1099.
[7] WU X, LI H F,YAN M J,et al.Associations of gonadotropin-releasing hormone receptor (GnRHR) and neuropeptide Y (NPY) genes' polymorphisms with egg-laying traits in Wenchang chicken[J]. Agricultural Sciences in China,2007,6(4): 499-504.
[8] 吳 旭,严美姣,刘丽平,等.促性腺激素释放激素基因(GnRH)和生长激素基因(GH)对番鸭产蛋性能的遗传效应分析[J].农业生物技术学报,2012,20(3):289-295.
[9] 颜泉梅,陈秋菊,崔易虹,等.西农莎能奶山羊和布尔山羊GnRH基因多态性与产羔数的相关分析[J].中国兽医学报,2011,31(11):1667-1671.
[10] AN X P,HOU J X,ZHAO H B,et al. Polymorphism identification in goat GNRH1 and GDF9 genes and their association analysis with litter size[J]. Animal genetics,2013,44(2):234-238.
