水杨酸修复老化玉米种子活力的研究
2016-10-19黄守程刘爱荣叶梅荣钱立生
黄守程 刘爱荣 叶梅荣 钱立生
摘要:初步研究了水杨酸(salicylic acid, SA)对人工老化玉米(Zea mays L.)种子活力的修复作用。以人工老化的玉米种子为材料,采用0(CK)、0.01、0.10和1.00 mmol/L四个浓度的SA分别浸种6 h后,测定种子活力及幼苗生物量等相关指标。结果表明,与CK相比,除1.00 mmol/L SA处理显著提高了种子浸出液电导率外,其他浓度SA浸种对其电导率无显著影响;0.01和0.10 mmol/L SA处理能有效降低浸出液的可溶性糖含量,而1.00 mmol/L SA处理则引起可溶性糖含量上升;此外,0.01和0.10 mmol/L SA处理不会引起浸出液光密度(OD260 nm)增加,但1.00 mmol/L SA处理则导致其光密度增加。研究还发现不同浓度SA均能提高老化玉米种子的发芽率、发芽势、发芽指数和活力指数。0.10 mmol/L SA处理有利于幼苗鲜重和干重的增加,并提高幼苗叶绿素的含量,而其他浓度均无显著影响。综合分析认为,0.10 mmol/L SA浸种对老化玉米种子活力的修复作用最好,可作为生产实践的参考。
关键词:种子老化;玉米(Zea mays L.);水杨酸;活力修复
中图分类号:S513 文献标识码:A 文章编号:0439-8114(2016)08-1917-03
DOI:10.14088/j.cnki.issn0439-8114.2016.08.004
Abstract: Effects of salicylic acid (SA) on the vigor repair of artificial aging corn (Zea mays L.) seeds were studied in this work. The artificial aging corn seeds were soaked with different concentrations of SA (0,0.01,0.10 and 1.00 mmol/L) for 6 h and some vigor-related indicators were measured. The results indicated that, compared with the control, different concentrations of SA treatment had no influence on the electric conductivity except for 1.0 mmol/L SA.The content of soluble sugar decreased obviously when the seeds were treated with 0.01 and 0.10 mmol/L SA,whereas increased under 1.0 mmol/L SA treatment.In addition,0.01 and 0.10 mmol/L SA treatment did not result in the elevation of OD260 nm, while 1.00 mmol/L SA treatment led to significant increase of OD260 nm. We observed that all concentration SA treatments could improve the germination percentage,germination potential, germination index and vigor index of aging corn seeds. Furthermore, only 0.10 mmol/L SA treatments resulted in enhanced fresh weight,dry weight and chlorophyll content of seedlings. According to these findings, 0.10 mmol/L SA treatment could effectively improve the vigor of aging corn seed which could be taken as an important reference in production practice.
Key words: seed aging;corn(Zea mays L.);salicylic acid;vigor repair
种子生理成熟后出现不可逆的质量下降变化称为种子老化,是种子自然衰退的生理过程[1]。老化不仅影响种子品质和活力,还会影响后期幼苗的生长,导致弱苗,进而降低产量[2]。此外,老化还导致种质遗传资源变异性减小,影响种质资源安全[3]。目前关于种子活力修复的措施较多,主要有化学方法和物理方法。其中化学方法包括种子引发技术(priming technology)[4]、营养元素调节[5]以及植物激素处理等[6]。研究表明,激素处理可以提高老化高羊茅种子在干旱条件下的抗氧化酶活性,提高种子活力[7]。水杨酸(salicylic acid,SA)是一种重要的植物内源激素,在植物的生长发育等方面具有多种生理作用[8]。李永洁等[9]研究发现SA处理能显著提高黑果枸杞种子的萌发,陈贵华等[10]研究表明适宜浓度的SA浸种能增强老化菜豆种子发芽率和发芽势,并提高幼苗的鲜重和干重。Chandan等[11]研究发现,向日葵种子经SA预处理后能在后期的人工加速老化过程中保持较高的活力,并具备良好的苗期生长性能。
提高老化种子活力是种质保存和提高后期作物产量的重要措施。玉米是世界第二大重要的谷類作物,中国玉米年产量约1.28亿t,约占粮食总产量的1/4,而玉米种子老化给农业生产造成了较为严重的经济损失[12]。目前关于玉米种子老化过程中生理生化特性的研究较为充分[13-15],而关于SA修复老化玉米种子的研究尚未见报道。本研究初步探讨了SA浸种处理对人工加速老化的玉米种子活力修复的作用,旨在为农业生产中老化种子的修复提供一定的参考,并为进一步研究其机制提供依据。
1 材料与方法
1.1 种子人工加速老化处理
本试验选用郑单958玉米种子作为材料。将余海兵等[16]的方法略作修改对种子进行人工老化。在干燥器底部加2.5 cm的水层,在白瓷板上铺一层干净的纱布,然后将玉米种子均匀地放在纱布上,最后干燥器严密加封并放入密封的恒温箱中,在温度为(43±2) ℃、相对湿度为85%的条件下处理5 d后,取出已被老化的玉米种子,放在(33±2) ℃的干燥箱中干燥至原来的含水量,备用。
1.2 SA浸种处理及发芽试验
将老化的玉米种子先用0.1%升汞表面消毒30 min,然后用蒸馏水冲洗干净。设置4个浓度处理,即分别用0(蒸馏水处理作为CK)、0.01、0.10、1.00 mmol/L SA浸种6 h。浸种处理后用蒸馏水冲洗5次以上,洗净种子表面的残留SA,在室温条件下自然晾干后备用。
参照国际种子检验规程进行种子发芽试验。将每组种子用等量的蒸馏水浸泡24 h后,将每组种子的浸泡液分别收集起来备用。采用培养皿纸上发芽法,将各处理的种子放在铺有三层滤纸的培养皿中,每皿50粒种子,设3次重复。在25 ℃条件下进行发芽试验,每天定时加水并记录发芽种子数至第8天为止,第6天统计发芽势,第8天统计发芽率。
1.3 发芽率、发芽势、发芽指数及活力指数测定[17]
发芽势GP=G6 /N×100%,发芽率GR=G8 /N×100%,发芽指数GI=∑Gt/Dt,活力指数VI=∑Gt/Dt×S。式中,G6为第6天时的总发芽数;G8为第8天时的总发芽数;N为供试种子的总粒数;Gt为发芽开始后第t天的发芽数;Dt为相应的发芽天数;S为幼苗鲜重(g)。
1.4 种子浸出液电导率、可溶性糖、OD值、鲜重及干重测定
浸出液电导率、可溶性糖、OD260 nm值测定采用颜启传等[17]的方法进行。种子发芽的第8天称量幼苗鲜重,105 ℃烘干至恒重后称量干重。
1.5 数据处理与分析
数据处理采用Microsoft Excel软件进行,单因素方差分析采用SPSS数据处理系统进行。
2 结果与分析
2.1 SA处理对老化玉米种子浸出液电导率、可溶性糖和光密度的影响
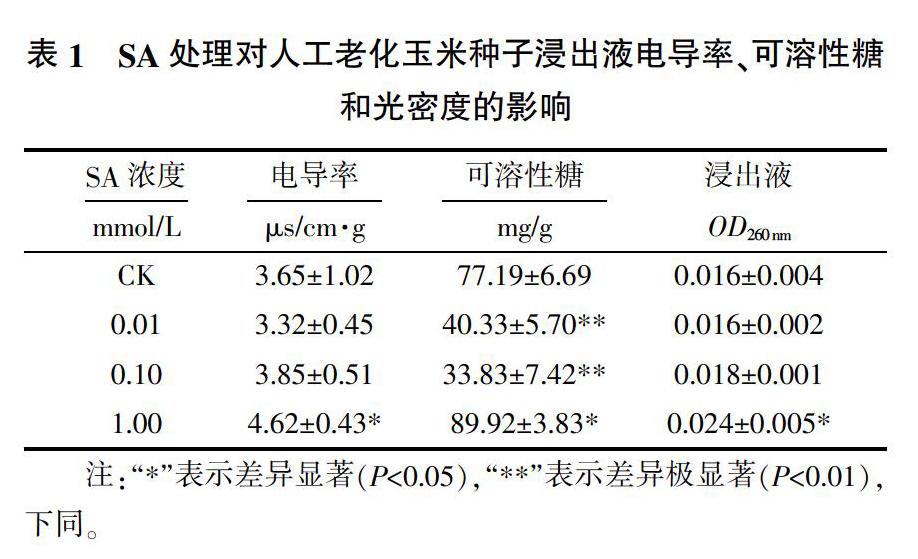
由表1可知,与CK相比,0.01和0.10 mmol/L SA处理对浸出液电导率无显著影响,但1.00 mmol/L SA处理却显著提高了浸出液的电导率;0.01和0.10 mmol/L SA处理可极显著降低种子浸出液可溶性糖含量,分别较对照下降了47.8%和56.2%,而1.00 mmol/L SA处理引起浸出液可溶性糖含量显著上升,较CK提高了16.5%。此外,SA处理后,种子浸出液光密度值(OD260 nm)随SA浓度增加呈现出一定的上升趋势,但仅1.00 mmol/L SA处理导致OD260 nm显著增加,而其他浓度SA处理后OD260 nm变化不显著。
2.2 SA处理对老化玉米种子发芽率、发芽势、发芽指数及活力指数的影响
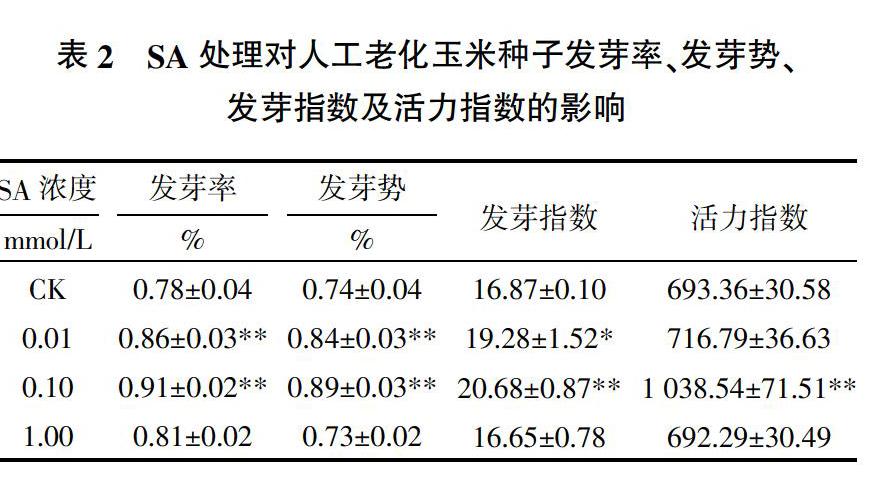
由表2可知,与CK相比,0.01和0.10 mmol/L SA处理均能显著或极显著提高老化玉米种子的发芽率、发芽势、发芽指数,其中发芽率分别较CK提高了10.3%和16.7%,发芽势分别提高了13.5%和20.3%,而发芽指数分别提高了14.3%和22.6%;0.10 mmol/L SA处理后,种子活力指数极显著提高,较CK提高了49.8%。
2.3 SA处理对玉米幼苗鲜重、干重以及叶绿素含量的影响
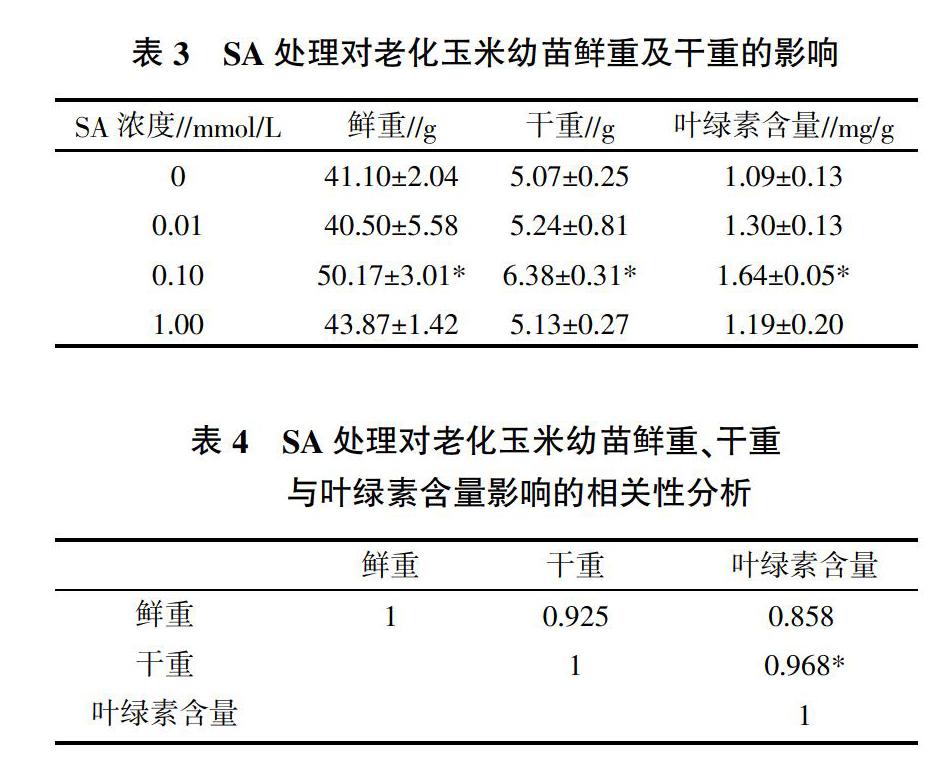
由表3可知,老化的玉米种子经0.10 mmol/L SA浸种处理后,幼苗的鲜重、干重和叶绿素含量均显著增加,分别较CK提高了22.1%、25.8%和50.5%。相关性分析表明,鲜重与干重、叶绿素含量呈现较强的正相关性,干重与叶绿素含量呈显著正相关(表4)。
3 小结与讨论
细胞膜的完整性对于维持细胞正常的功能至关重要。种子老化过程中ROS积累引起膜脂过氧化,破坏细胞膜的完整性,导致细胞内含物渗漏增加[14],这是细胞受到伤害的标志之一。本试验中,0.01和0.10 mmol/L SA处理没有对老化种子浸出液的电导率和OD260 nm产生显著影响,而1.00 mmol/L SA处理却导致电导率以及OD260 nm增加,这表明较高浓度的SA处理会引起细胞膜的渗漏,导致细胞内电解质以及遗传物质的外流。研究发现,老化种子浸出液的可溶性糖含量升高[18]。本试验中,0.01和0.10 mmol/L SA处理使老化种子浸出液可溶性糖含量极显著下降,而1.00 mmol/L SA处理却显著提高了可溶性糖含量,这可能是由于适宜浓度的SA能够促进种子对可溶性糖的吸收与利用。此外,研究发现1.00 mmol/L SA处理显著增加浸出液可溶性糖含量,这表明较高浓度SA处理可能加剧了老化种子的细胞膜损伤,破坏了细胞膜的完整性。
种子活力是衡量种子质量的重要指标。种子老化会导致发芽率、发芽势、发芽指数和活力指数降低[13],这可能是由于老化种子细胞内抗氧化酶(POD,CAT和APX等)活性下降[12],导致活性氧积累[19]。本试验中,0.01和0.10 mmol/L SA处理均能显著或极显著提高人工加速老化玉米种子的发芽势、发芽率和发芽指数,且0.10 mmol/L SA处理极显著提高种子的活力指数,这与陈贵化等[10]的研究结果一致。Chen等[20]研究指出,种子老化过程中氧化脅迫相关基因显著表达上调,活性氧(ROS)与种子老化过程密切相关。SA作为一种重要的信号分子,调控植物ROS的信号转导途径[21],如SA处理抑制杏果实O2-·和H2O2的含量[22]。据此,推测SA提高老化种子活力可能与其促进抗氧化酶活性、降低种子活性氧水平有关。同时,ROS水平的降低也有助于减轻其对细胞膜的伤害,从而对维持细胞膜的完整性具有重要作用。
种子老化对后期营养体的生长也有重要影响。有研究表明,适宜浓度的SA处理能显著提高老化菜豆种子幼苗的鲜重及干重[10]。本试验中,0.10 mmol/L SA处理能显著提高幼苗的鲜重、干重以及叶绿素含量,由于鲜重与干重具有较强的正相关性(r=0.925),表明鲜重的增加是由于幼苗干物质积累所致;另外,干重与叶绿素含量呈显著正相关,这表明干重的增加是由于适宜浓度的SA处理能够促进老化种子苗期的光合作用,从而促进幼苗的生长。
综上所述,适宜浓度的SA处理不会对老化玉米种子的细胞膜造成损伤,可促进种子对糖的吸收与利用,提高老化玉米种子的发芽率、发芽势、发芽指数和活力指数,并促进幼苗的生长,其中,0.10 mmol/L SA处理对提高老化玉米种子活力的效果最好。该研究结果可为农业生产中应用SA修复老化玉米种子活力提供一定的依据。
参考文献:
[1] 李 颖,毛培胜.牧草种子老化生理与修复研究进展[J].种子,2013,32(1):48-52.
[2] STEWART R R C,BEWLEY J D. Lipid peroxidation associated with accelerated aging of soybean axes[J].Plant Physiology, 1980, 65(2):245-248.
[3] 张 晗,卢新雄,张志娥,等.种子老化对玉米种质资源遗传完整性变化的影响[J].植物遗传资源学报,2005,6(3):271-275.
[4] 付静尘,韩烈保.引发、老化对生菜种子萌发的影响[J].种子, 2008,27(3):71-73.
[5] 吴友根,黎庆培,陈祥伟.不同质量浓度的Ca2+溶液浸种对黄瓜种子萌发的影响[J].海南大学学报(自然科学版),2005,23(3):257-260.
[6] 张福平,魏玲玲.IAA等对紫罗勒种子发芽及幼苗生长的影响[J].种子,2007,26(10):94-97.
[7] EISVAND H R,TAVAKKOL-AFSHARI R,SHARIFZADEH F, et al. Effects of hormonal priming and drought stress on activity and isozyme profiles of antioxidant enzymes in deteriorated seed of tall wheatgrass(Agropyron elongatum Host)[J]. Seed Science and Technology,2010,38(2):280-297.
[8] RASKIN I. Role of salicylic acid in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43(1):439-463.
[9] 李永洁,李 进,吕海英,等.不同浓度水杨酸(SA)浸种对盐旱交叉胁迫下黑果枸杞种子萌发的影响[J].种子,2014,33(8):34-38.
[10] 陈贵华,石 岭,王 萍,等.外源水杨酸对陈旧菜豆种子萌发的影响[J].内蒙古农业大学学报,2014,35(2):19-22.
[11] CHANDAN K P. Sunflower seed invigoration by chemical manipulation[J].Agricultural Journal,2011,5(1):67-72.
[12] 劉建军,马俊华,孟俊文,等 玉米种子老化过程中抗氧化酶活性的变化[J].山西农业科学,2013,21(3):907-910.
[13] 王长进,程昕昕,胡 曼,等.人工老化对甜玉米种子活力及抗氧化指标变化分析[J].安徽科技学院学报,2013,27(5):27-30.
[14] 刘明久,王铁固,陈士林,等.玉米种子人工老化过程中生理特性与种子活力的变化[J].核农学报,2008,22(4):510-513.
[15] 张加强,田树云,李晓辉.人工老化过程中玉米种子活力与一些生理指标变化的研究[J].种子,2007,26(6):46-48.
[16] 余海兵,刘 正,吴跃进,等.玉米种子人工加速老化方法的选择[J].江苏农业学报,2011,27(3):672-674.
[17] 颜启传,胡伟民,宋文坚.种子活力测定的原理和方法[M].北京:中国农业出版社,2006.
[18] 孙春青,杨 伟,戴忠良,等.人工老化处理对结球甘蓝种子生理生化特性的影响[J].西北植物学报2012,32(8):1615-1620.
[19] 王 琼,汪晓峰.家榆种子老化过程中ROS类Caspse-3途径的初步研究[J].西北植物学报,2012,32(5):948-955.
[20] CHEN H, OSUNA D, COLVILLE L, et al. Transcriptome-wide mapping of pea seed ageing reveals a pivotal role for genes related to oxidative stress and programmed cell death[J]. PLos One, 2013, 8(10): DOI: 10.1371/journal.pone.0078471.
[21] HORVTH E,SZALAI G,JANDA T.Induction of Abiotic Stress Tolerance by Salicylic Acid Signaling[J]. Journal of Plant Growth Regulation,2007,26(3): 290-300.
[22] 侯媛媛,朱 璇,王 英,等.水杨酸处理对杏果实冷害及活性氧代谢的影响[J].食品科学,2014,35(4):195-199.
