不同粒径鹿茸总氨基酸的含量及体外溶出度的测定
2016-10-19白珺宋宁李杨李昕光陈新
白珺 宋宁 李杨 李昕光 陈新


[摘要] 目的 建立鹿茸细粉、超微粉总氨基酸的含量测定方法,并以总氨基酸为指标测定两种粉体的体外溶出度。方法 采用单因素试验和正交试验优选总氨基酸的提取工艺;以甘氨酸为对照品,采用紫外分光光度法测定总氨基酸含量;测定鹿茸细粉、超微粉在pH值1.2、4.0、6.8三种溶出介质中溶出度。 结果 总氨基酸提取最优工艺为100倍量70%乙醇,超声提取60 min,提取1次;细粉和超微粉总氨基酸含量分别为4.16、4.30 mg/g;细粉在pH值1.2、4.0、6.8介质中的溶出率分别为38.55%、56.42%、107.88%;超微粉在pH值1.2、4.0、6.8介质中溶出率分别为30.97%、50.85%、99.67%。 结论 提取工艺合理、可靠;含量测定方法简便、准确;鹿茸两种粉体的总氨基酸均在pH值6.8的磷酸盐缓冲液中溶出度高,为鹿茸肠溶剂型的开发提供了一定的思路。
[关键词] 鹿茸;细粉;超微粉;总氨基酸;溶出度;含量测定
[中图分类号] R927.2 [文献标识码] A [文章编号] 1673-7210(2016)03(c)-0144-05
[Abstract] Objective To establish the determination method for total amino acids of antler powders and superfine powders, and measure in vitro dissolution of two powders with total amino acids as indexes. Methods Orthogonal test and single factor tests were adopoted to investigate extractions of total amino acids. Total amino acids were measured by UV spectrophotometry with glycine as reference. Two powders' dissolution were determined at pH 1.2, 4.0 and 6.8 three dissolution mediums. Resluts The optimum process: 100 times 70% ethanol, ultrasonic extracting 60 min, extracted once. The total amino acids content of two powders was 4.16 mg/g and 4.30 mg/g. Medium value of powder dissolution rate at pH 1.2, 4.0, 6.8 was 38.55%, 56.42%, 107.88% respectively. Medium value of superfine powder dissolution rate at pH 1.2, 4.5, 6.8 medium value was 30.97%, 50.85%, 99.67% respectively. Conclusion The extraction technology is reasonable and reliable. The measurement is simple and accurate. Both two powders have high contents at pH 6.8 phosphate buffer dissolution, which provides some certain ideas for antler enteric preparation developments.
[Key words] Antler; Powder; Superfine powder; Total amino; Dissolution; Determination
鹿茸為脊索动物门哺乳纲鹿科的动物梅花鹿(Cervusnippon temminck)或马鹿(Cervuselaphus linnaues)雄鹿未骨化密生茸毛的幼角,鹿茸具有壮肾阳、益精血等功效,为温补肾阳之要药,更是滋补佳品。目前市场上鹿茸产品形式种类繁多,最常见的剂型均是由鹿茸粉体入药进而加工制成的保健酒、口服液、软胶囊等。选择合适的原料药,控制原料药的质量标准,对鹿茸产品的开发应用具有较为重要的影响。
超微粉碎可使药材破壁率增加,有效成分更易溶出,提高生物利用度[1]。通过单因素试验和正交试验优选鹿茸总氨基酸的提取工艺,测定鹿茸普通细粉和超微粉中的总氨基酸含量,并测定两种粉体在盐酸溶液(pH值1.2)、醋酸-醋酸钠缓冲盐溶液(pH值4.0)、磷酸盐缓冲盐溶液(pH值6.8)三种溶出介质中的溶出度。
1 仪器与材料
RT静音粉碎机(荣聪精密科技有限公司);FA1204B电子天平(上海精密科学仪器有限公司);HWS-12电热恒温水浴锅(上海一恒科技有限公司);Spectrumlab752S紫外分光光度计(上海棱光技术有限公司);飞鸽 LXJ-OB 低速大容量多管离心机(上海安亭科学仪器厂);KQ-250B超声波清洗仪(昆山市超声仪器有限公司);ZRS-6G溶出试验仪(天津市天大天发科技有限公司)。
鹿茸药材购于吉林仙草药业有限公司,经长春中医药大学中药鉴定教研室姜大成教授鉴定为鹿科动物马鹿的雄性未骨化密生茸毛的幼角;鹿茸超微粉(济南倍力粉技术工程有限公司供);鹿茸细粉自制;甘氨酸对照品(批号:110713-201410,中国食品药品检定研究院);茚三酮(上海惠氏生化试剂有限公司);试剂均为国产分析纯。
2 方法与结果
2.1 总氨基酸的含量测定
2.1.1 对照品溶液的制备
称取干燥至恒重的甘氨酸对照品12.5 mg,精密称定,置于25 mL容量瓶中,加水摇匀,定容至刻度,制得浓度为0.505 mg/mL的对照品溶液。
2.1.2 供试品溶液的制备
精密称取细粉、超微粉各0.25 g,置具塞锥形瓶中,依据各工艺水平参数进行提取,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,收集续滤液,即得。
2.1.3 测定方法
精密量取“2.1.2”项下供试品溶液各2.0 mL,置于25 mL容量瓶中,依次加入醋酸-醋酸钠缓冲盐溶液(pH值5.0)0.5 mL、3%茚三酮乙醇溶液0.5 mL,沸水浴加热20 min取出,冷至室温,加50%异丙醇溶液定容至刻度,摇匀。同法制成空白溶液,于570 nm波长处测定吸光度(A),采用对照品比较法计算总氨基酸含量。
2.1.4 线性关系考察
精密吸取甘氨酸对照品溶液0.1、0.2、0.3、0.4、0.5 mL,置于50 mL容量瓶中,分别加水0.5、0.4、0.3、0.2、0.1 mL,以下操作同“2.1.3”项下测定法。以浓度为横坐标,吸光度为纵坐标,制作标准曲线。甘氨酸线性关系曲线方程为:Y = 144.88X + 0.06848,r=0.996,甘氨酸对照品在0.001~0.005 mg/mL范围内线性关系良好。
2.1.5 精密度试验
取甘氨酸对照品溶液0.3 mL,按“2.1.4”项下测定方法,连续测定6次。对照品溶液RSD为0.11%,小于5%,表明仪器精密度良好。
2.1.6 稳定性试验
精密吸取供试品溶液各2.0 mL,按照“2.1.3”项下测定方法,分别于0、30、60、90、120、150 min测定吸光度(A)。结果两种供试品溶液RSD为2.95%、3.72%,均小于5%,表明两种供试品溶液在150 min内稳定。
2.1.7 重复性试验 按照“2.1.2”项下细粉供试品溶液制备方法,制备6份供试品溶液,按照“2.1.3”项下测定方法,分别测定A值,结果总氨基酸含量平均值为4.16 mg,RSD为3.18%,说明重复性良好。
2.2 总氨基酸提取工艺筛选
2.2.1 单因素考察试验
2.2.1.1 料液比的筛选 分别称取细粉、超微粉各4份,每份0.25 g,分别加入30、50、100、150倍量70%乙醇,超声提取30 min,提取1次,按照“2.1.2”项下供试品溶液制备方法,按“2.1.3”项下进行测定。由图1可知:增大料液比可明显提高总氨基酸含量,且1∶100所得产物与1∶150所得产物总氨基酸含量差异不大,故从实际角度考察选择1∶100作为料液比。见图1。
2.2.1.2 提取时间的筛选 分别称取细粉、超微粉各4份,每份0.25 g,均加入100倍70%乙醇,分别超声提取30、45、60、80 min,提取1次,按照“2.1.2”项下供试品溶液制备方法,按“2.1.3”项下进行测定。增加提取时间可明显提高总氨基酸含量,且60 min所得产物与80 min所得產物总氨基酸含量差异不大,故从实际角度考察选择60 min作为提取时间。结果见图2。
2.2.1.3 提取次数的筛选 分别称取细粉、超微粉各4份,每份0.25 g,均加入100倍70%乙醇,分别超声提取60 min,分别提取1、2、3次,按照“2.1.2”项下供试品溶液制备方法,按“2.1.3”项下进行测定。增加提取次数对总氨基酸含量无明显影响,故从实际角度考察选择提取1次作为提取次数。结果见图3。
2.2.2 正交试验优选提取工艺
鹿茸粉体与提取介质的料液比、提取时间、提取次数可能会对鹿茸总氨基酸的提取产生一定的影响,因此使用L9(34)正交试验表对提取工艺影响因素进行正交试验,筛选最佳工艺条件。因素水平见表1。
称取鹿茸细粉各9份,每份0.25 g,精密称定,按照L9(34)正交试验表的实验条件进行提取,以总氨基酸含量为考察指标。通过正交试验直观分析结果显示,因素影响的强弱顺序为:A>B>C。通过综合评价直观分析结果显示,因素A(料液比)、因素B(提取时间)对总氨基酸的含量结果影响差异有统计学意义(P > 0.05);因素C(提取次数)对总氨基酸含量影响差异无统计学意义(P > 0.05)。最佳提取工艺为A3B3C1,即加入100倍量的提取溶剂,提取60 min,提取1次。
L9(34)直观分析结果见表2,综合评价直观分析结果见表3。
2.3 总氨基酸含量测定方法验证性试验
取三批细粉、超微粉样品,按照最佳提取工艺条件,制备三批样品的供试品溶液,结果鹿茸细粉、超微粉总氨基酸含量均值分别为均值为4.16、4.30 mg/g,RSD分别为1.70%、0.84%。工艺稳定、可靠。鹿茸细粉、超微粉中总氨基酸的含量按甘氨酸计算比较差异不大。
2.4 细粉与超微粉的体外溶出度测定
2.4.1 供试品溶液的制备
照溶出度测定法(《中国药典》2010年版二部附录XC)中桨法测定,分别以经脱气处理的HCl溶液(pH值1.2)、醋酸-醋酸钠缓冲盐溶液(pH值4.0)、磷酸盐缓冲溶液(pH值6.8)为溶出介质,体积为900 mL,转速为50 r/min,温度为(37.0±0.5)℃。分别称取三份鹿茸细粉、超微粉9 g,精密称定,投入溶出杯中。样品接触溶质即开始计时,分别于5、10、15、30、45、60、120 min,取样5 mL,立即补充等温等体积的溶出介质,样品溶液经0.45 μm微孔滤膜过滤,取续滤液,即得。
2.4.2 测定法
将两种供试品溶液置于25 mL容量瓶中,以下操作同“2.1.3”项下测定法。
2.4.3 溶出度的计算
2.4.4 溶出曲线的绘制
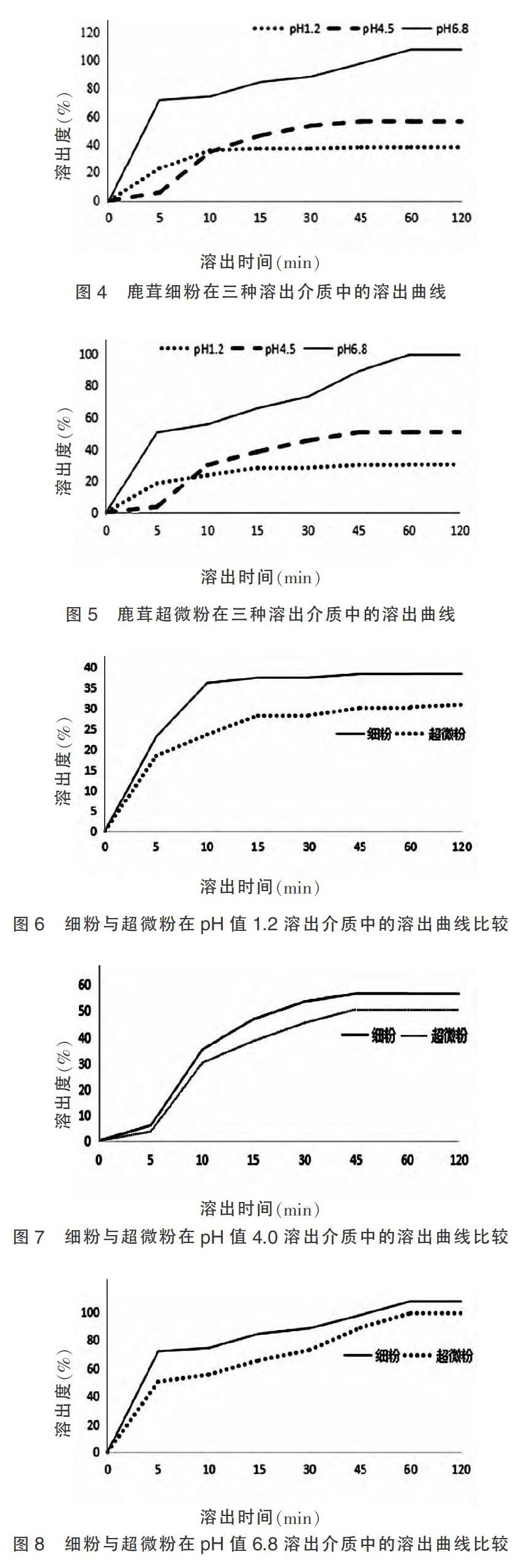
以总氨基酸在不同时间点的溶出度为纵坐标,以不同时间点为横坐标,绘制溶出曲线。结果见图4~8。
2.4.5 试验结果
细粉在pH值1.2、4.5、6.8介质中的溶出率分别为38.55%、56.42%、107.88%;超微粉在pH值1.2、4.5、6.8介质中溶出率分别为30.97%、50.85%、99.67%。在pH值1.2、4.0、6.8介质中,细粉与超微粉均在15、45、60 min后达到溶出平衡。为排除溶出时间不足的因素,同法测定了经24 h后的平衡溶出率,发现与120 min测定值无差异,故将溶出时间考察选定在120 min内。
3 讨论
鹿茸中含有丰富的氨基酸[2],含量最多的为甘氨酸、脯氨酸和谷氨酸[3],氨基酸总量在50%以上,包含人体不能合成的七种必需氨基酸[4]。大量药效学研究表明[5-12],总氨基酸是鹿茸发挥功效的一组有效部位群,课题组前期实验表明[13-15],氨基酸可能为鹿茸填益精髓、提高免疫力的药效物质基础。鹿茸制剂及其保健食品可以为人体提供更为丰富的氨基酸,是人体获得氨基酸的一种有效途径,水解氨基酸含量在一定程度上决定了鹿产品的药用价值[16]。因此选用总氨基酸作为测定指标,既是主要成分又是有效成分,为制订鹿茸及相关制剂的质量标准具有一定的意义。
生物活性成分通常是分布于初级代射产物的细胞内和细胞间质由其衍生出来的次级代射产物,如生物碱类、萜类、黄酮类、香豆素类、氨基酸等,它们在植物体内的含量很低。中药的超微粉碎主要是基本成分的破碎,次级代谢产物对中药粉碎的影响不大[17],超微粉碎对鹿茸氨基酸类成分的影响不大的原因可能在于此。鹿茸为动物类药材,其组织结构较为复杂,某些易碎组织在粉碎过程中易于形成小颗粒,而一些不易粉碎的组织则在大颗粒粉末中较多,会导致成分在不同粒径粉末中分布不均匀[18]。因此,为了使有效成分集中、避免原料浪费,则需要较为严格地控制原料药入药粒径的均一性、稳定性,避免分量不均匀,造成批内差异。
中药经不同程度粉碎后,表面能增加,使颗粒处于非稳定状态,从而造成流动性差、吸湿性强,产生了一定的胶黏性,因而其在投入到溶出杯中后,并没有迅速分散至溶出介质中,造成了超微粉较细粉溶出度较低的现象。有研究[19-20]也曾指出有效成分为水溶性成分溶出并非粒度越小越好,而应在一个最佳粒度范围内。总氨基酸在胃液环境中溶出较少,而在肠液环境中释放程度得到很大的提高,可考虑制备肠溶性固体分散体,提高鹿茸的生物利用度,但仍存在着一定的不足和局限,实验后期,应继续从蛋白质含量等多方面来评价鹿茸有效成分的在体内的吸收利用程度[21-23]。
[参考文献]
[1] 范凌云,王振恒,余琰.等不同粒径三黄粉粉体学性质及体外溶出度比较[J].中国中医药信息杂志,2015,9(22):91-94.
[2] 赵磊,李继海,朱大洲,等.5种鹿茸营养成分的主成分分析[J].光谱学与光谱分析,2010,30(9):2571-2575.
[3] 汪树理,孙继红,王艳梅.带血与排血梅花鹿茸骨片游离氨基酸含量的比较分析[J].氨基酸和生物资源,2009,31(3):62-63.
[4] 李和平.中国茸鹿品种(品系)的鹿茸化学成分[J].东北林业大学学报,2003,31(4):26-28.
[5] 齐艳萍.鹿茸对小鼠肿瘤及免疫功能的影响[J].黑龙江八一农垦大学学报,2012,24(1):55-57.
[6] 董万超,赵伟刚,刘春华,等.梅花鹿茸胶囊增強免疫力功能的研究[J].特产研究,2009,(3):8-10.
[7] 李腾,彭靖,吕尚军,等. 甘氨酸对烧伤大鼠心肌细胞能量代谢的影响[J].重庆医学,2012,41(33):3476-3478.
[8] 雷敏,王大维,冯东娟,等.不同剂量精氨酸对重度创伤患者术后免疫指标及结局的影响[J].中华临床营养杂志,2012,20(6):379-381.
[9] 肖立宁,陈剑伟,高朝辉,等.氨基酸维生素制剂的抗疲劳作用研究[J].解放军医学杂志,2012,37(1):23.
[10] 杨亚飞.氨基酸片增强小鼠免疫力的实验研究[J].四川生理科学杂志,2013,35(3):104-106.
[11] 张志领,孙佳明,牛晓晖,等鹿血化学成分及其药理作用研究[J].吉林中医药,2013,33(1):61.
[12] 肖立宁,陈剑伟,高朝辉,等.氨基酸维生素制剂的抗疲劳作用研究[J].解放军医学杂志,2012,37(1):23-25.
[13] 陈新.仿生法提取鹿茸中氨基酸的初步实验研究[J].吉林中医药,2012,32(8):832-833.
[14] 胡朝奇,陈新,徐会丹.鹿茸氨基酸口服液基础配方开发[J].中国实验方剂学杂志,2013,19(14):70-72.
[15] 胡朝奇,陈新,徐会丹.基于仿生提取理论的鹿茸氨基酸成分分析[J].上海中医药杂志,2013,47(10):78-81.
[16] 赵卉,刘继永,王峰.鹿茸等五种鹿产品中氨基酸含量及组成对比分析[J].时珍国医国药,2015,26(5):1056-1058.
[17] 赵国巍,张晓辉,廖正根,等.中药超微粉碎的影响因素研究概况[J].江西中医学院学报,2011,23(1):98-100.
[18] 张立国,闫志慧,陈露,等.粒径对甘草粉末中甘草酸、甘草苷的影响[J].中草药,2013,44(23):3328-3333.
[19] 管咏梅,李钰,杨明,等.不同粒径的发酵虫草菌菌粉体学及溶出度[J].中国实验方剂学,2011,17(23):7-10.
[20] 萧伟,徐连明,徐忠坤,等.不同粒径三七粉物理性质及体外溶出度的比较研究[J].世界科学技术,2013,15(2):305-309.
[21] 张广晶,杨莹莹,张舒媛,等.蓝桉化学成分研究[J].西部中医药,2014,27(9):162-164.
[22] 李怀平,马斌,任松鹏.塞北紫堇化学成分的研究[J].西部中医药,2015,28(10):43-45.
[23] 陈耀章.玉米须化学成分药理作用最新研究[J].西部中医药,2015,28(2):141-144.
(收稿日期:2015-11-25 本文编辑:赵鲁枫)
